2022-2023学年高一上学期化学人教版(2019)必修第一册2.1钠及其化合物(42张PPT)
文档属性
| 名称 | 2022-2023学年高一上学期化学人教版(2019)必修第一册2.1钠及其化合物(42张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-01 00:00:00 | ||
图片预览










文档简介
(共42张PPT)
第一课时 活泼的金属单质-钠
2.1 钠及其化合物
导入
钠的存在形式
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
导入
钠的存在形式
浩瀚的大海美丽而且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水中含量较高的元素,也是典型的金属元素和非金属元素。
钠的存在形式
钠在自然界中只以化合态存在,在海水中储藏极为丰富。主要以盐酸盐、碳酸盐和硫酸盐形式存在。
硫酸钠
氯化钠
碳酸钠
01 原子结构
02 物理性质
03 化学性质
04 制取与应用
CONTENTS
目录
原子结构
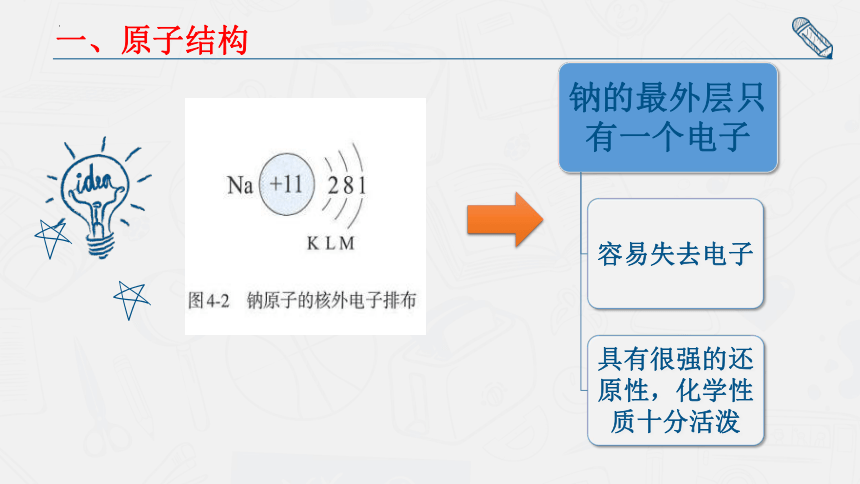
一、原子结构
物理性质
实验探究1
取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色以及表面颜色的变化。
金属钠银白色
金属钠在空气中表面变暗,生成氧化膜
观察钠的颜色和光泽,注意新切开的钠的表面
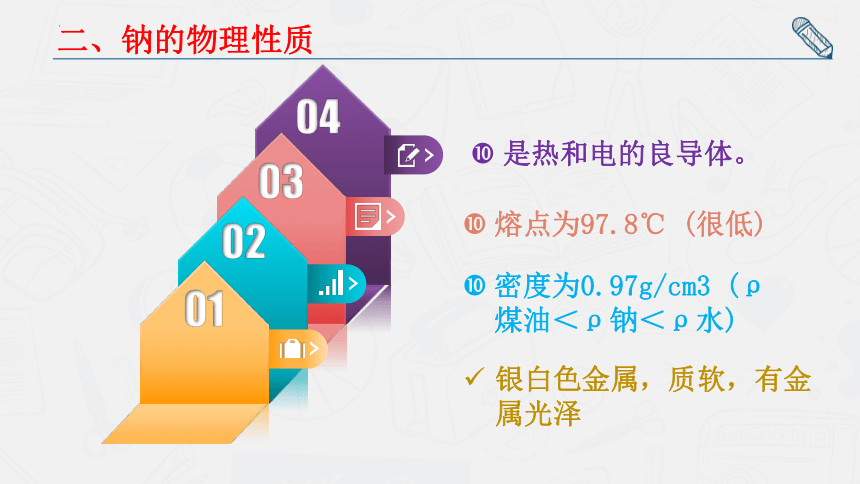
二、钠的物理性质
02
01
03
04
银白色金属,质软,有金属光泽
密度为0.97g/cm3 (ρ煤油<ρ钠<ρ水)
是热和电的良导体。
熔点为97.8℃ (很低)
化学性质
问题:钠应该保存在哪里?
钠单质和氧气在常温下发生化合反应,生成白色的氧化钠
钠的保存:保存在煤油或者石蜡油中,隔绝氧气
三、钠的化学性质
实验探究2
取一只破损无底的试管,取黄豆大金属钠,放到水平放置的试管中,用酒精灯先预热,然后对准放钠的部位加热,观察现象
现象:钠在空气中受热后,先熔化成闪亮的小球后剧烈燃烧产生黄色火焰,生成淡黄色固体
1、钠与氧气反应:
(1)空气中缓慢氧化
4Na + O2 2Na2O (白色)
(2)钠在空气中燃烧
注意:反应物相同,反应条件不同,产物不同!
3.1 钠与氧气的反应
2Na + O2 Na2 O2 (淡黄色)
现象:黄色火焰,生成淡黄色固体
钠除了能与氧气直接化合外,还能与氯气、硫等很多非金属直接化合
(3)与氯气反应:
点燃时:剧烈燃烧,有黄色的火焰,产生大量的白烟
2Na+Cl2=2NaCl
(4)钠与硫化合时甚至发生爆炸,生成硫化钠
2Na+S=Na2S
3.2 钠与非金属单质的反应
实验探究3
向一只盛有水的小烧杯中滴加几滴酚酞试液,然后将一小块金属钠(约绿豆般大小)投入烧杯中,观察实验现象。
钠除了能与氧气直接化合外,还能与水反应吗?
浮?沉?
静止的?
钠的形状?
有声音吗?
溶液颜色?
实验现象 分析结论
钠在水中的位置
钠的形状变化
钠的运动
反应的声音
溶液的颜色变化
反应方程式 离子方程式 同学间将观察到的实验现象,填下面的表格:
钠与水的反应
1
2
3
浮
熔
游
响
红
讨 论
浮
现 象
熔
红
响
游
小于水的密度,0.97g/cm3
反应放热 ,熔点低,97.81℃
有气体产生
有气体产生且反应剧烈
有碱生成,NaOH
实 验 现 象 讨 论
Na +11 2 8 1
在上述反应中,钠的化合价均由0价变为+1价,这是因为
容易失去,所以,钠具有还原性,是一种强还原剂。
最外层只有一个电子
上述反应中钠元素化合价如何变化?钠在反应中体现什么性质?
【问题探究】
例:2Na + 2H2O == 2NaOH + H2
失2×e-
得2×e-
0
+1
0
+1
还原剂 氧化剂
如果把钠投入到CuSO4溶液,会有铜析出吗?会有什么现象?
现象:既有气体又有蓝色沉淀。
分析:钠投入CuSO4溶液中先和水发生反应产生H2和NaOH,然后是生成的NaOH再与CuSO4继续反应。
2Na + 2H2O == 2NaOH + H2
2NaOH + CuSO4== Cu(OH )2 + Na2SO4
将金属钠投入氯化铁溶液中又有什么现象?
【思考与延伸1】钠与盐
加入钠单质
滴加酚酞试剂
蓝色絮状沉淀
实验探究6: 钠与CuSO4溶液反应
写出镁,铁与硫酸铜溶液的反应方程式:
Mg+ CuSO4=Cu+ MgSO4
Fe+ CuSO4=Cu+ FeSO4
思考:如果向硫酸铜溶液中加入更加活泼的金属钠又会出现什么现象呢?
现象:有气泡放出 产生蓝色沉淀
方程式:
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
钠与盐溶液反应规律:
钠先与水反应,生成的NaOH再与盐反应
如果把钠投入到浓盐酸,会有什么现象?
现象:有气泡产生。
分析:钠投入盐酸中,先与HCl反应
(1)当酸足够时:2Na + 2HCl == 2NaOH + H2
(1)当酸不足时:2Na + 2HCl == 2NaOH + H2
2Na + 2H2O == 2NaOH + H2
【思考与延伸2】钠与酸
思考:钠的性质的延伸:
(1)金属的置换反应为什么不能用“K、CA、Na”等金属呢?
(2)预测钠投入煤油和水的混合物中的现象。
(3)金属钠失火应该用什么灭火?
如果把钠投入到氢氧化钠溶液,会有什么现象?
现象:有气泡产生。
分析:钠投入氢氧化钠溶液中,与氢氧化钠不反应,与水发生反应
2Na + 2HCl == 2NaOH + H2
【思考与延伸3】钠与碱
思考·讨论
现象:
钠在界面与煤油中上下跳动,并与水反应产生气泡
钠与酸反应比与水反应剧烈。由于钠与水反应,实质上是钠跟水电离出的H+反应;而酸中的H+浓度比水中H+浓度大。
写出钠与少量盐酸反应的化学方程式
2Na+2HCl = 2NaCl+H2↑
2Na+2H2O = 2NaOH+H2↑
钠与酸反应规律:先跟酸反应后跟水反应
实验探究4:钠与煤油和水的混合溶液反应
实验探究5:钠与盐酸反应
加入钠单质
滴加酚酞试剂
蓝色絮状沉淀
实验探究6: 钠与CuSO4溶液反应
写出镁,铁与硫酸铜溶液的反应方程式:
Mg+ CuSO4=Cu+ MgSO4
Fe+ CuSO4=Cu+ FeSO4
思考:如果向硫酸铜溶液中加入更加活泼的金属钠又会出现什么现象呢?
现象:有气泡放出 产生蓝色沉淀
方程式:
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
钠与盐溶液反应规律:
钠先与水反应,生成的NaOH再与盐反应
制取和用途
(汉弗里·戴维 1778-1829)
英国化学家戴维坚持不懈地从事于利用电池分解各种物质的实验研究。1807年发现了金属钾,几天之后,他又从电解
碳酸钠中获得了金属钠。
思维启迪
钠的制取
工业上制取金属钠主要是用电解熔融的氯化钠的方法
2NaCl(熔融)—— 2Na + Cl2
电解
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
1、钠易与空气中的氧气、以及水反应,实验室中应如何保存钠?
2、当在火灾现场有大量钠存在时,应怎样灭火?
保存在盛有煤油的试剂瓶中。
干燥的沙土灭火
思考
与
交流
钠的用途
金属冶炼
金属冶炼是把金属从化合态变为游离态的过程。利用钠将其置换出来。
高压钠灯
高压钠灯使用时发出金白色光,具有发光效率高、耗电少、寿命长、透雾能力强和不锈蚀等优点。
钾钠合金
钠钾合金可作为冷却剂应用于实验室的快中子反应器中。
高压钠灯(充有钠蒸气)
钠 的 用 途
四、钠的用途
1 .制取过氧化钠等化合物;
2 .制取钛、锆、铌、钽等金属;(利用钠
的强还原性)
3 .钠钾合金用于原子反应堆的导热剂;
(钠钾合金为液态)
4 .制高压钠灯。(高压钠灯发出黄光,射
程远,透雾能力强)
TiCl4+4Na 4NaCl+Ti
课堂小结
银白色金属,质软;
密度为0.97g/cm3 熔点为97.8℃ (很低);
是热和电的良导体。
制取和用途
物理性质
化学性质
原子结构
和氧气反应;
和其他非金属反应
和水反应;
和酸反应
钠的制取
金属钠与水反应:
现象
密度比水小
反应放热,钠的熔点低
反应迅速,且有气体生成
生成NaOH
反应激烈
本质:
本质:
反应的化学方程式:2Na + 2H2O = 2NaOH + H2 ↑
1.钠的物理性质: 有金属光泽,质软的白色固体
2.钠的化学性质:与氧气反应,与Cl2、硫等非金属单质反应
与水反应
课堂小结
反思总结
1. 钠在各种水溶液中反应时,有酸氢为先,无酸水为先;
2. K、Ca、Na等活泼金属不能从盐溶液中置换出其他金属。
【典例】 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
[将少量钠投入题述四种物质的水溶液中,均有H2产生,故都满足题目的第一个条件“有气体放出”,而反应后“溶液质量减轻”是指投入的金属钠的质量小于脱离溶液的物质的质量。在A、B、C三个选项中只有H2放出,故溶液质量是增加的。D选项中由于Na与H2O反应生成的NaOH还能继续与CuSO4反应析出Cu(OH)2沉淀:2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑,故反应后溶液质量减轻。]
D
练习1.在烧杯中加入水和苯(密度:0.88 g·cm-3,不溶于水,不与钠反应)各50 mL。将一小粒金属钠(密度:0.97 g·cm-3)投入烧杯中,观察到的现象可能是( )
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能做上、下浮动
D
练习2、金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是( )
①密度较小 ②熔点较低 ③金属活动性强 ④该反应生成相应的碱 ⑤该反应是放热反应 ⑥金属钠导电性强
A.仅①②③④ B.仅①②④⑤
C.除③⑤之外 D.除⑥之外
D
钠露置于空气中的变化
金属钠长期露置于空气中,最终完成转变为Na2CO3粉末。此过程中的主要变化及现象如下:
银白色金属钠
表面变暗
出现白色固体
白色粉末状物质
白色块状物质
表面变成溶液
O2
( 生成Na2O )
H2O
( 生成NaOH )
H2O
( NaOH潮解 )
CO2
( 生成Na2CO3·xH2O )
风化
( 生成Na2CO3 )
将一块银白色的钠放在空气中会发生一系列的变化:
表面迅速变暗→“出汗”→变成白色固体(粉末)。
下列有关叙述中不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成了氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.白色固体(粉末)为碳酸钠
D.该过程的所有化学反应均为氧化还原反应
D
课堂作业
教学效果
1、在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中,从这个实验过程观察到的反应现象中,不可能得出的结论是( )
A.钠比较柔软 B.钠与水反应生成碱
C.钠与水反应放热 D.钠与水反应放出气体
2、下列叙述中,错误的是( )
A.钠燃烧时发出黄色的火焰
B.钠在空气中燃烧生成过氧化钠
C.钠与硫化合时可以发生爆炸
D.可以直接用手拿钠
D
A
课堂作业
教学效果
3、将一小块钠投入到盛有煤油和水的烧杯中(煤油和水均足够多),可以观察到的现象是 ( )
A.钠浮在煤油层上,不反应
B.钠沉在煤油层下,不反应
C.钠沉在煤油层下,浮在水层上,
在交界处剧烈反应
D.钠沉在水层下剧烈反应
C
课堂作业
教学效果
3、在实验室做钠与水反应的实验时,用到的仪器有( )
①试管夹 ②镊子 ③小刀 ④冷凝管
⑤滤纸 ⑥研钵 ⑦烧杯 ⑧坩埚
⑨石棉网 ⑩玻璃片
A.①②④⑨ B.③⑤⑥
C.②③⑤⑦⑩ D.⑥⑦⑧
C
课堂作业
教学效果
5、下列有关金属钠的说法中,错误的是( )
A.钠只有在加热的条件下才能与氧气反应
B.钠与氧气反应的产物与反应条件有关
C.钠在反应中易失电子,表现出还原性
D.钠应保存在煤油中
A
谢谢您的欣赏
第一课时 活泼的金属单质-钠
2.1 钠及其化合物
导入
钠的存在形式
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
导入
钠的存在形式
浩瀚的大海美丽而且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水中含量较高的元素,也是典型的金属元素和非金属元素。
钠的存在形式
钠在自然界中只以化合态存在,在海水中储藏极为丰富。主要以盐酸盐、碳酸盐和硫酸盐形式存在。
硫酸钠
氯化钠
碳酸钠
01 原子结构
02 物理性质
03 化学性质
04 制取与应用
CONTENTS
目录
原子结构
一、原子结构
物理性质
实验探究1
取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色以及表面颜色的变化。
金属钠银白色
金属钠在空气中表面变暗,生成氧化膜
观察钠的颜色和光泽,注意新切开的钠的表面
二、钠的物理性质
02
01
03
04
银白色金属,质软,有金属光泽
密度为0.97g/cm3 (ρ煤油<ρ钠<ρ水)
是热和电的良导体。
熔点为97.8℃ (很低)
化学性质
问题:钠应该保存在哪里?
钠单质和氧气在常温下发生化合反应,生成白色的氧化钠
钠的保存:保存在煤油或者石蜡油中,隔绝氧气
三、钠的化学性质
实验探究2
取一只破损无底的试管,取黄豆大金属钠,放到水平放置的试管中,用酒精灯先预热,然后对准放钠的部位加热,观察现象
现象:钠在空气中受热后,先熔化成闪亮的小球后剧烈燃烧产生黄色火焰,生成淡黄色固体
1、钠与氧气反应:
(1)空气中缓慢氧化
4Na + O2 2Na2O (白色)
(2)钠在空气中燃烧
注意:反应物相同,反应条件不同,产物不同!
3.1 钠与氧气的反应
2Na + O2 Na2 O2 (淡黄色)
现象:黄色火焰,生成淡黄色固体
钠除了能与氧气直接化合外,还能与氯气、硫等很多非金属直接化合
(3)与氯气反应:
点燃时:剧烈燃烧,有黄色的火焰,产生大量的白烟
2Na+Cl2=2NaCl
(4)钠与硫化合时甚至发生爆炸,生成硫化钠
2Na+S=Na2S
3.2 钠与非金属单质的反应
实验探究3
向一只盛有水的小烧杯中滴加几滴酚酞试液,然后将一小块金属钠(约绿豆般大小)投入烧杯中,观察实验现象。
钠除了能与氧气直接化合外,还能与水反应吗?
浮?沉?
静止的?
钠的形状?
有声音吗?
溶液颜色?
实验现象 分析结论
钠在水中的位置
钠的形状变化
钠的运动
反应的声音
溶液的颜色变化
反应方程式 离子方程式 同学间将观察到的实验现象,填下面的表格:
钠与水的反应
1
2
3
浮
熔
游
响
红
讨 论
浮
现 象
熔
红
响
游
小于水的密度,0.97g/cm3
反应放热 ,熔点低,97.81℃
有气体产生
有气体产生且反应剧烈
有碱生成,NaOH
实 验 现 象 讨 论
Na +11 2 8 1
在上述反应中,钠的化合价均由0价变为+1价,这是因为
容易失去,所以,钠具有还原性,是一种强还原剂。
最外层只有一个电子
上述反应中钠元素化合价如何变化?钠在反应中体现什么性质?
【问题探究】
例:2Na + 2H2O == 2NaOH + H2
失2×e-
得2×e-
0
+1
0
+1
还原剂 氧化剂
如果把钠投入到CuSO4溶液,会有铜析出吗?会有什么现象?
现象:既有气体又有蓝色沉淀。
分析:钠投入CuSO4溶液中先和水发生反应产生H2和NaOH,然后是生成的NaOH再与CuSO4继续反应。
2Na + 2H2O == 2NaOH + H2
2NaOH + CuSO4== Cu(OH )2 + Na2SO4
将金属钠投入氯化铁溶液中又有什么现象?
【思考与延伸1】钠与盐
加入钠单质
滴加酚酞试剂
蓝色絮状沉淀
实验探究6: 钠与CuSO4溶液反应
写出镁,铁与硫酸铜溶液的反应方程式:
Mg+ CuSO4=Cu+ MgSO4
Fe+ CuSO4=Cu+ FeSO4
思考:如果向硫酸铜溶液中加入更加活泼的金属钠又会出现什么现象呢?
现象:有气泡放出 产生蓝色沉淀
方程式:
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
钠与盐溶液反应规律:
钠先与水反应,生成的NaOH再与盐反应
如果把钠投入到浓盐酸,会有什么现象?
现象:有气泡产生。
分析:钠投入盐酸中,先与HCl反应
(1)当酸足够时:2Na + 2HCl == 2NaOH + H2
(1)当酸不足时:2Na + 2HCl == 2NaOH + H2
2Na + 2H2O == 2NaOH + H2
【思考与延伸2】钠与酸
思考:钠的性质的延伸:
(1)金属的置换反应为什么不能用“K、CA、Na”等金属呢?
(2)预测钠投入煤油和水的混合物中的现象。
(3)金属钠失火应该用什么灭火?
如果把钠投入到氢氧化钠溶液,会有什么现象?
现象:有气泡产生。
分析:钠投入氢氧化钠溶液中,与氢氧化钠不反应,与水发生反应
2Na + 2HCl == 2NaOH + H2
【思考与延伸3】钠与碱
思考·讨论
现象:
钠在界面与煤油中上下跳动,并与水反应产生气泡
钠与酸反应比与水反应剧烈。由于钠与水反应,实质上是钠跟水电离出的H+反应;而酸中的H+浓度比水中H+浓度大。
写出钠与少量盐酸反应的化学方程式
2Na+2HCl = 2NaCl+H2↑
2Na+2H2O = 2NaOH+H2↑
钠与酸反应规律:先跟酸反应后跟水反应
实验探究4:钠与煤油和水的混合溶液反应
实验探究5:钠与盐酸反应
加入钠单质
滴加酚酞试剂
蓝色絮状沉淀
实验探究6: 钠与CuSO4溶液反应
写出镁,铁与硫酸铜溶液的反应方程式:
Mg+ CuSO4=Cu+ MgSO4
Fe+ CuSO4=Cu+ FeSO4
思考:如果向硫酸铜溶液中加入更加活泼的金属钠又会出现什么现象呢?
现象:有气泡放出 产生蓝色沉淀
方程式:
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
钠与盐溶液反应规律:
钠先与水反应,生成的NaOH再与盐反应
制取和用途
(汉弗里·戴维 1778-1829)
英国化学家戴维坚持不懈地从事于利用电池分解各种物质的实验研究。1807年发现了金属钾,几天之后,他又从电解
碳酸钠中获得了金属钠。
思维启迪
钠的制取
工业上制取金属钠主要是用电解熔融的氯化钠的方法
2NaCl(熔融)—— 2Na + Cl2
电解
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
1、钠易与空气中的氧气、以及水反应,实验室中应如何保存钠?
2、当在火灾现场有大量钠存在时,应怎样灭火?
保存在盛有煤油的试剂瓶中。
干燥的沙土灭火
思考
与
交流
钠的用途
金属冶炼
金属冶炼是把金属从化合态变为游离态的过程。利用钠将其置换出来。
高压钠灯
高压钠灯使用时发出金白色光,具有发光效率高、耗电少、寿命长、透雾能力强和不锈蚀等优点。
钾钠合金
钠钾合金可作为冷却剂应用于实验室的快中子反应器中。
高压钠灯(充有钠蒸气)
钠 的 用 途
四、钠的用途
1 .制取过氧化钠等化合物;
2 .制取钛、锆、铌、钽等金属;(利用钠
的强还原性)
3 .钠钾合金用于原子反应堆的导热剂;
(钠钾合金为液态)
4 .制高压钠灯。(高压钠灯发出黄光,射
程远,透雾能力强)
TiCl4+4Na 4NaCl+Ti
课堂小结
银白色金属,质软;
密度为0.97g/cm3 熔点为97.8℃ (很低);
是热和电的良导体。
制取和用途
物理性质
化学性质
原子结构
和氧气反应;
和其他非金属反应
和水反应;
和酸反应
钠的制取
金属钠与水反应:
现象
密度比水小
反应放热,钠的熔点低
反应迅速,且有气体生成
生成NaOH
反应激烈
本质:
本质:
反应的化学方程式:2Na + 2H2O = 2NaOH + H2 ↑
1.钠的物理性质: 有金属光泽,质软的白色固体
2.钠的化学性质:与氧气反应,与Cl2、硫等非金属单质反应
与水反应
课堂小结
反思总结
1. 钠在各种水溶液中反应时,有酸氢为先,无酸水为先;
2. K、Ca、Na等活泼金属不能从盐溶液中置换出其他金属。
【典例】 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
[将少量钠投入题述四种物质的水溶液中,均有H2产生,故都满足题目的第一个条件“有气体放出”,而反应后“溶液质量减轻”是指投入的金属钠的质量小于脱离溶液的物质的质量。在A、B、C三个选项中只有H2放出,故溶液质量是增加的。D选项中由于Na与H2O反应生成的NaOH还能继续与CuSO4反应析出Cu(OH)2沉淀:2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑,故反应后溶液质量减轻。]
D
练习1.在烧杯中加入水和苯(密度:0.88 g·cm-3,不溶于水,不与钠反应)各50 mL。将一小粒金属钠(密度:0.97 g·cm-3)投入烧杯中,观察到的现象可能是( )
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能做上、下浮动
D
练习2、金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是( )
①密度较小 ②熔点较低 ③金属活动性强 ④该反应生成相应的碱 ⑤该反应是放热反应 ⑥金属钠导电性强
A.仅①②③④ B.仅①②④⑤
C.除③⑤之外 D.除⑥之外
D
钠露置于空气中的变化
金属钠长期露置于空气中,最终完成转变为Na2CO3粉末。此过程中的主要变化及现象如下:
银白色金属钠
表面变暗
出现白色固体
白色粉末状物质
白色块状物质
表面变成溶液
O2
( 生成Na2O )
H2O
( 生成NaOH )
H2O
( NaOH潮解 )
CO2
( 生成Na2CO3·xH2O )
风化
( 生成Na2CO3 )
将一块银白色的钠放在空气中会发生一系列的变化:
表面迅速变暗→“出汗”→变成白色固体(粉末)。
下列有关叙述中不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成了氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.白色固体(粉末)为碳酸钠
D.该过程的所有化学反应均为氧化还原反应
D
课堂作业
教学效果
1、在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中,从这个实验过程观察到的反应现象中,不可能得出的结论是( )
A.钠比较柔软 B.钠与水反应生成碱
C.钠与水反应放热 D.钠与水反应放出气体
2、下列叙述中,错误的是( )
A.钠燃烧时发出黄色的火焰
B.钠在空气中燃烧生成过氧化钠
C.钠与硫化合时可以发生爆炸
D.可以直接用手拿钠
D
A
课堂作业
教学效果
3、将一小块钠投入到盛有煤油和水的烧杯中(煤油和水均足够多),可以观察到的现象是 ( )
A.钠浮在煤油层上,不反应
B.钠沉在煤油层下,不反应
C.钠沉在煤油层下,浮在水层上,
在交界处剧烈反应
D.钠沉在水层下剧烈反应
C
课堂作业
教学效果
3、在实验室做钠与水反应的实验时,用到的仪器有( )
①试管夹 ②镊子 ③小刀 ④冷凝管
⑤滤纸 ⑥研钵 ⑦烧杯 ⑧坩埚
⑨石棉网 ⑩玻璃片
A.①②④⑨ B.③⑤⑥
C.②③⑤⑦⑩ D.⑥⑦⑧
C
课堂作业
教学效果
5、下列有关金属钠的说法中,错误的是( )
A.钠只有在加热的条件下才能与氧气反应
B.钠与氧气反应的产物与反应条件有关
C.钠在反应中易失电子,表现出还原性
D.钠应保存在煤油中
A
谢谢您的欣赏
