2.2分子结构与性质——键角大小比较 课件 (共12张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2分子结构与性质——键角大小比较 课件 (共12张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 | 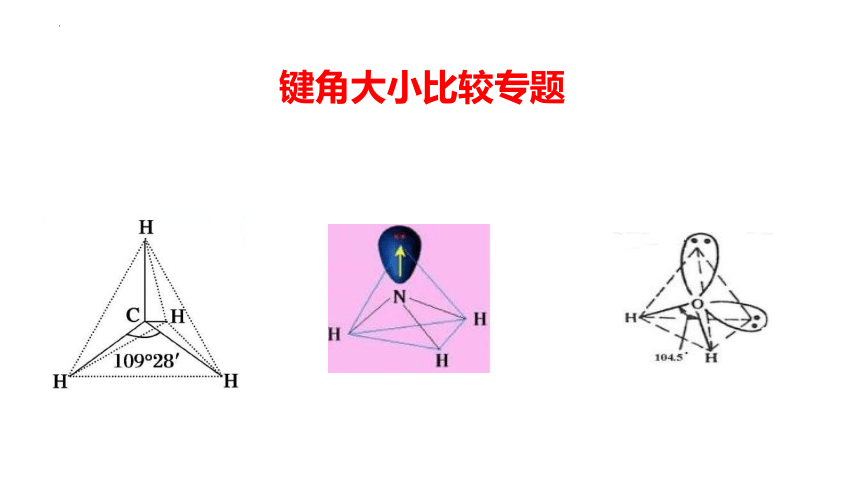 | |
| 格式 | pptx | ||
| 文件大小 | 229.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-01 08:39:20 | ||
图片预览





文档简介
(共12张PPT)
键角大小比较专题
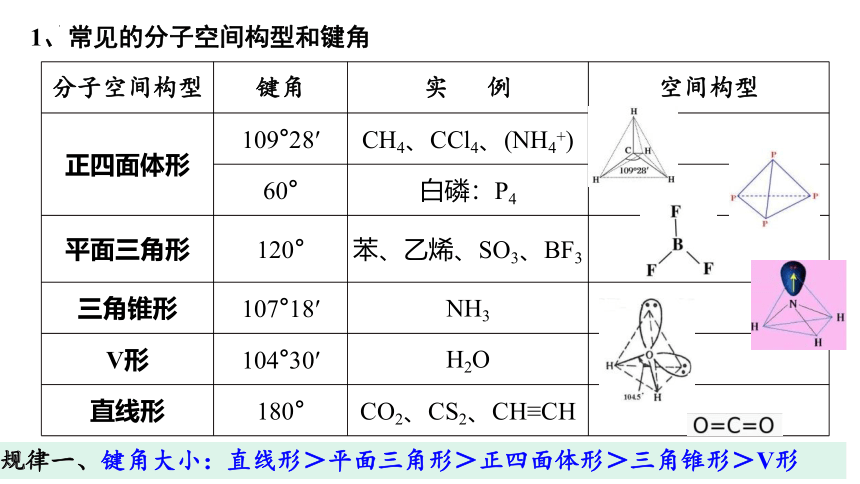
1、常见的分子空间构型和键角
分子空间构型 键角 实 例 空间构型
正四面体形 109°28′ CH4、CCl4、(NH4+)
60° 白磷:P4
平面三角形 120° 苯、乙烯、SO3、BF3
三角锥形 107°18′ NH3
V形 104°30′ H2O
直线形 180° CO2、CS2、CH≡CH
规律一、键角大小:直线形>平面三角形>正四面体形>三角锥形>V形
分子 杂化轨道角度 实际键角
H2O 109°28′ 105°
NH3 109°28′ 107°
COCl2 120° 形成两种键角分别为124°18′、111°24′
规律二、排斥力大小对键角的影响
(2)三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
(1)排斥力大小顺序为LP—LP LP—BP>BP—BP (LP代表孤电子对,BP代表成键电子对)
分子 杂化轨道角度 排斥力分析 实际键角
H2O 109°28′ LP—LP LP—BP>BP—BP 105°
NH3 109°28′ LP—BP>BP—BP 107°
COCl2 120° C===O对C—Cl的排斥力大于C—Cl对C—Cl的排斥力 形成两种键角分别为124°18′、111°24′
【例1】H3BO3 分子中的 O—B—O 的键角 (填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是
电子对构型(或杂化方式)不相同,空间构型也不相同。
大于 H3BO3分子中的B采取sp2杂化,而BH4-中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化
答题策略 键角大小:直线形>平面三角形>正四面体形>三角锥形>V形
答题模板 ×××中心原子采取×××杂化,键角为×××,而×××中心原子采取×××杂化,键角为×××。
题型一、电子对构型(或杂化方式)不相同,空间构型也不相同
题型二、电子对构型(或杂化方式)相同,但空间构型不相同 (看排斥力)
答题策略 ①排斥力大小顺序为LP—LP LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)②三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
答题模板 孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,×××分子中无孤对电子,×××分子中含有1对孤对电子,×××分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小
【例2】已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是CH4>NH3>H2O,原因为:_____________________________。
孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,CH4分子中无孤对电子,NH3分子中含有1对孤对电子,H2O分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小
【例3】NH3的键角____PH3的键角,原因是:_____________________;NF3的键角_____NH3的键角,理由是:_________________________。
题型三、空间构型相同,中心原子相同或配位原子相同
答题策略 看中心原子或配位原子的电负性
答题模板 中心原子不同,配位原子相同(AC3与BC3,且电负性A>B,键角:AC3>BC3):中心原子的电负性A强于B,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大
NH3的键角大于PH3的键角中心原子的电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大;NF3的键角小于NH3的键角,理由是:F的电负性比H大,NF3中成键电子对离中心原子较远,成键电子对之间的排斥力较小,因而键角较小。
1. Si与C元素位于同一主族,SiO2键角小于CO2的原因是:________。
【课后练习】
SiO2中心Si原子采用SP3杂化,键角109°28';CO2中心C原子采用sp杂化,键角为180°
2. SeO42—中Se—O的键角比SeO3的键角____(填“大”或“小”),原因是__________________________________。
小 空间构型为正四面体,键角为109°28′,空间构型为平面正三角形,键角为120°
3、高温陶瓷材料Si3N4晶体中键角N—Si—N______Si—N—Si,原因是______________________________。
> N原子上有孤电子对,由于孤电子对与成键电子对的排斥力更大,使得Si—N—Si键角较小
4. AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是 ________________________。
砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小
四面体形 >
【解析】 电负性:F>Cl,F-Cl中成键电子对离中心原子较远,成键电子对之间的排斥力较小,因而键角较小。
6. NH3分子在独立存在时H—N—H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H—N—H键角的测量值。解释NH3形成如图配合物后H—N—H键角变大的原因:_______
NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱
键角大小比较专题
1、常见的分子空间构型和键角
分子空间构型 键角 实 例 空间构型
正四面体形 109°28′ CH4、CCl4、(NH4+)
60° 白磷:P4
平面三角形 120° 苯、乙烯、SO3、BF3
三角锥形 107°18′ NH3
V形 104°30′ H2O
直线形 180° CO2、CS2、CH≡CH
规律一、键角大小:直线形>平面三角形>正四面体形>三角锥形>V形
分子 杂化轨道角度 实际键角
H2O 109°28′ 105°
NH3 109°28′ 107°
COCl2 120° 形成两种键角分别为124°18′、111°24′
规律二、排斥力大小对键角的影响
(2)三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
(1)排斥力大小顺序为LP—LP LP—BP>BP—BP (LP代表孤电子对,BP代表成键电子对)
分子 杂化轨道角度 排斥力分析 实际键角
H2O 109°28′ LP—LP LP—BP>BP—BP 105°
NH3 109°28′ LP—BP>BP—BP 107°
COCl2 120° C===O对C—Cl的排斥力大于C—Cl对C—Cl的排斥力 形成两种键角分别为124°18′、111°24′
【例1】H3BO3 分子中的 O—B—O 的键角 (填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是
电子对构型(或杂化方式)不相同,空间构型也不相同。
大于 H3BO3分子中的B采取sp2杂化,而BH4-中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化
答题策略 键角大小:直线形>平面三角形>正四面体形>三角锥形>V形
答题模板 ×××中心原子采取×××杂化,键角为×××,而×××中心原子采取×××杂化,键角为×××。
题型一、电子对构型(或杂化方式)不相同,空间构型也不相同
题型二、电子对构型(或杂化方式)相同,但空间构型不相同 (看排斥力)
答题策略 ①排斥力大小顺序为LP—LP LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)②三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
答题模板 孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,×××分子中无孤对电子,×××分子中含有1对孤对电子,×××分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小
【例2】已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是CH4>NH3>H2O,原因为:_____________________________。
孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,CH4分子中无孤对电子,NH3分子中含有1对孤对电子,H2O分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小
【例3】NH3的键角____PH3的键角,原因是:_____________________;NF3的键角_____NH3的键角,理由是:_________________________。
题型三、空间构型相同,中心原子相同或配位原子相同
答题策略 看中心原子或配位原子的电负性
答题模板 中心原子不同,配位原子相同(AC3与BC3,且电负性A>B,键角:AC3>BC3):中心原子的电负性A强于B,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大
NH3的键角大于PH3的键角中心原子的电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大;NF3的键角小于NH3的键角,理由是:F的电负性比H大,NF3中成键电子对离中心原子较远,成键电子对之间的排斥力较小,因而键角较小。
1. Si与C元素位于同一主族,SiO2键角小于CO2的原因是:________。
【课后练习】
SiO2中心Si原子采用SP3杂化,键角109°28';CO2中心C原子采用sp杂化,键角为180°
2. SeO42—中Se—O的键角比SeO3的键角____(填“大”或“小”),原因是__________________________________。
小 空间构型为正四面体,键角为109°28′,空间构型为平面正三角形,键角为120°
3、高温陶瓷材料Si3N4晶体中键角N—Si—N______Si—N—Si,原因是______________________________。
> N原子上有孤电子对,由于孤电子对与成键电子对的排斥力更大,使得Si—N—Si键角较小
4. AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是 ________________________。
砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小
四面体形 >
【解析】 电负性:F>Cl,F-Cl中成键电子对离中心原子较远,成键电子对之间的排斥力较小,因而键角较小。
6. NH3分子在独立存在时H—N—H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H—N—H键角的测量值。解释NH3形成如图配合物后H—N—H键角变大的原因:_______
NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱
