第七单元 常见的酸和碱 单元测试卷(含答案) 2022-2023学年九年级下册化学 鲁教版
文档属性
| 名称 | 第七单元 常见的酸和碱 单元测试卷(含答案) 2022-2023学年九年级下册化学 鲁教版 |  | |
| 格式 | zip | ||
| 文件大小 | 71.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 21:39:51 | ||
图片预览



文档简介
第七单元 常见的酸和碱 单元测试卷
一、单选题
1.黄金可以溶解在“王水”(浓盐酸与浓硝酸的混合液)中生成HAuCl4(四氯合金酸),没有氢气产生.根据以上信息,下列有关说法正确的是( )①“王水”溶解黄金是化学变化;②金比氢活泼 ③HAuCl4中,Au化合价为+3价,④可以将pH试纸伸入“王水”中测其酸碱度.
A.①④ B.①②③ C.③④ D.①③
2.下面的说法中,正确的是( )
A.最外层电子数为8的粒子,一定是稀有气体原子
B.某固体中加入稀盐酸,产生无色气体,该固体一定含CO32-
C.某无色溶液中滴加酚酞试液显红色,该溶液一定是碱溶液
D.只含有一种元素的物质,有可能是混合物
3.盛有石灰水的试剂瓶内壁常有一层白色固体物质,要清除它,应采用的方法是( )
A.用蒸馏水
B.用稀盐酸洗,再用水洗
C.用澄清的石灰水洗
D.用去污粉(主要成分为碳酸钠和细沙)洗
4.关于碱的下列说法正确的是( )
A.碱中一定含有H元素
B.使酚酞变红的都是碱溶液
C.碱和盐之间一定能发生复分解反应
D.酸与碱反应一定不产生沉淀
5.下列实验不能达到实验目的的是( )
A.除去MnO2中的KCl:加水溶解、过滤、洗涤、干燥
B.验证MnO2是H2O2分解的催化剂:向H2O2溶液中加入MnO2
C.检验Mg、Fe、Cu的活动性强弱:将铁丝分别插入氯化镁和氯化铜溶液中
D.稀释浓硫酸:将浓硫酸缓慢注入水中,并用玻璃棒不断搅拌
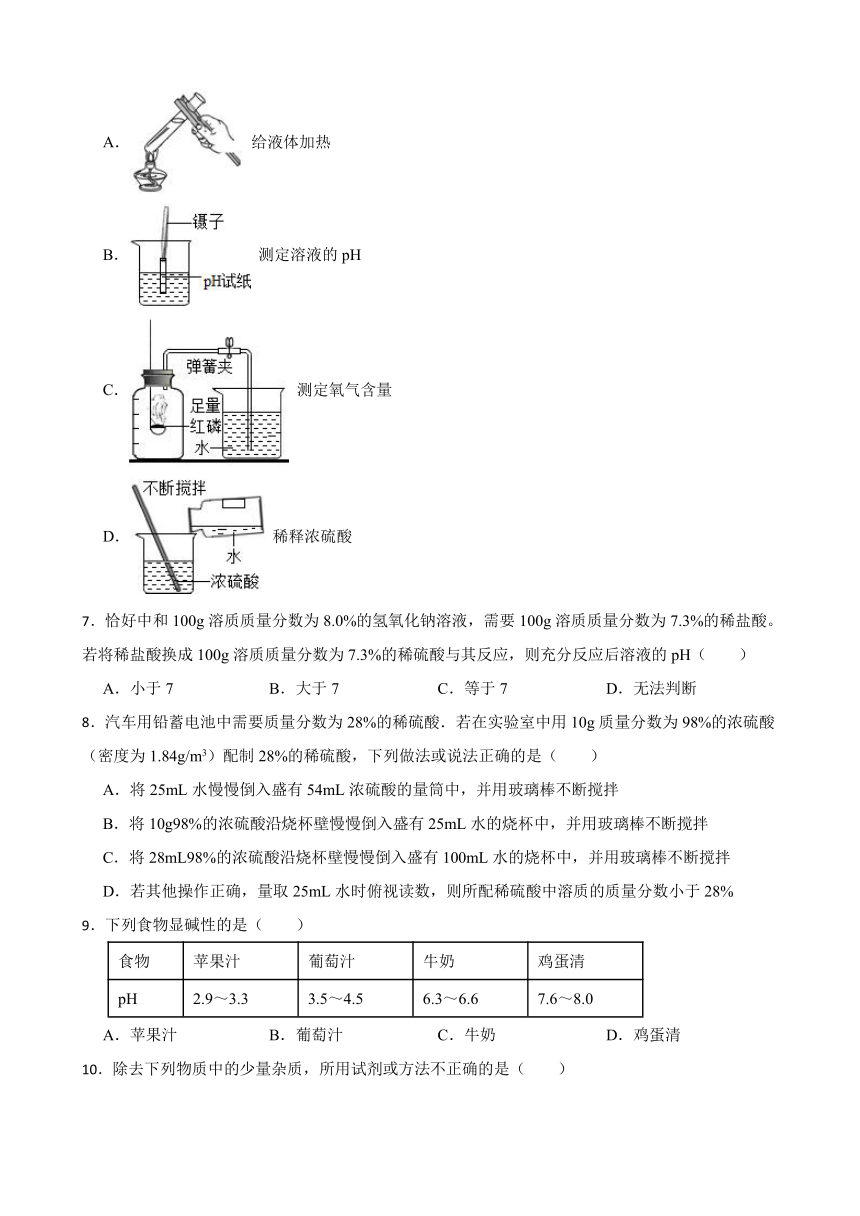
6.下列实验操作正确的是( )
A. 给液体加热
B. 测定溶液的pH
C. 测定氧气含量
D. 稀释浓硫酸
7.恰好中和100g溶质质量分数为8.0%的氢氧化钠溶液,需要100g溶质质量分数为7.3%的稀盐酸。若将稀盐酸换成100g溶质质量分数为7.3%的稀硫酸与其反应,则充分反应后溶液的pH( )
A.小于7 B.大于7 C.等于7 D.无法判断
8.汽车用铅蓄电池中需要质量分数为28%的稀硫酸.若在实验室中用10g质量分数为98%的浓硫酸(密度为1.84g/m3)配制28%的稀硫酸,下列做法或说法正确的是( )
A.将25mL水慢慢倒入盛有54mL浓硫酸的量筒中,并用玻璃棒不断搅拌
B.将10g98%的浓硫酸沿烧杯壁慢慢倒入盛有25mL水的烧杯中,并用玻璃棒不断搅拌
C.将28mL98%的浓硫酸沿烧杯壁慢慢倒入盛有100mL水的烧杯中,并用玻璃棒不断搅拌
D.若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28%
9.下列食物显碱性的是( )
食物 苹果汁 葡萄汁 牛奶 鸡蛋清
pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
A.苹果汁 B.葡萄汁 C.牛奶 D.鸡蛋清
10.除去下列物质中的少量杂质,所用试剂或方法不正确的是( )
选项 物质 杂质 试剂或方法
A NaCl固体 泥沙 加水溶解、过滤、蒸发
B MgCl2溶液 HCl 加过量Mg(OH)2、过滤
C KNO3 溶液 Ba(NO3)2 滴加过量K2SO4溶液、过滤
D CO2 H2O 通过浓硫酸干燥
A.A B.B C.C D.D
11.下列宏观事实的微观解释错误的是( )
A.一氧化碳和二氧化碳有不同的化学性质一一分子构成不同
B.蔗糖在热水中比在冷水中溶解快一一升高温度,分子运动速率加快
C.稀盐酸和稀硫酸均显酸性一一溶液中都含有氢离子
D.氧气经压缩储存在钢瓶中一一压强增大,分子体积变小
12.初中化学学习了很多化学反应,下列有关叙述中,不正确的是( )
A.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应
B.置换反应前后一定会有元素化合价的改变
C.两种化合物生成另外两种新化合物的反应一定是复分解反应
D.化合反应的生成物一定不是单质
二、填空题
13.学好化学能使我们更好地认识各种现象,更能合理地解决实际问题。下表列出生活中部分常见的问题和解决方法。
生活中常见问题 ⑴冰箱、汽车内有异味 ⑵洗涤油污 ⑶被蚂蚁、蚊子叮咬
解决方法 在冰箱、汽车内放活性炭 使用洗洁精清洗 涂上肥皂水
请你用化学知识分别叙述上表中三种解决方法的原理
(1)
(2)
(3)
14.形成酸雨的主要气体是 ,为了避免该气体对空气的污染,可用烧碱溶液吸收该气体,写出反应的方程式 .
15.请参与某学习小组进行研究性学习的过程,并协助完成相关任务:
【提出问题】在平时探讨酸的性质时,我们通常是讨论酸的水溶液.究竟水在酸显示酸的特性时扮演什么角色呢?
【确定研究对象】以我们最熟知的盐酸(氯化氢的水溶 液)和氯化氢进行探究.
【查阅资料】氯化氢溶于水时解离出氢离子和氯离子,而溶于干燥的甲苯(一种有机溶剂)时仍以氯化氢分子的形式分散(如图).
(1)【设计与实验】(请完成下表)
实验内容 实验现象 解释与结论
测定导电性 氯化氢的水溶液:导电性良好 氯化氢的水溶液中有自由移动的离子
氯化氢的甲苯溶液:不导电 氯化氢的甲苯溶液没有自由移动的离子
与镁作用 氯化氢的水溶液: 化学方程式:
氯化氢的甲苯溶液:没有明显现象 氯化氢的甲苯溶液没有解离出氢离子
与固态碳酸钠作用 氯化氢的水溶液:产生气泡 化学方程式:
氯化氢的甲苯溶液: 氯化氢的甲苯溶液没有解离出氢离子
(2)【讨论与反思】盐酸的酸性是因为氯化氢在水分子的作用下解离出了
16.金属与人类生活息息相关.
(1)生铁和钢是世界上用量最大的 (填“金属”或“合成”)材料,钢铁制品在 中易生锈.
(2)焊锡与其组成金属相比具有 的特性,可用来焊接电子元件.
(3)将铁粉投入含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则该溶质是 .
17.化学兴趣小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研细,加入酒精充分浸泡后过滤,得到三种溶液,将三种溶液分别加到下列液体中,得到以后信息:
花的种类 所制成溶液颜色 在有关试剂中呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
试回答:如果所制的溶液检验花盆中土壤的酸碱性,你会建议选择 花的酒精溶液来作酸碱指示剂:在以上三种酒精溶液中,酒精属于 ,(“溶质”或“溶剂”)
18.小宇同学去象牙山旅游时,用瓶装了一些山下的泉水,带回实验室,在老师的指导下,按下列流程进行实验,制取蒸馏水.
请回答下列问题:
(1)取水后加入明矾的作用是
(2)进行过滤操作时,下列做法错误的是 .
A.玻璃棒要靠在三层滤纸的一边 B.漏斗下端的管口要紧靠烧杯的内壁
C.滤纸的边缘要低于漏斗口 D.液面不要低于滤纸边缘
(3)向滤液中加入活性炭,利用其 性,除去水样中的色素和异味.
(4)在制取蒸馏水的过程中,在水中要放碎瓷片,其作用是 .
三、综合题
19.回答下列有关碱的性质的问题。
(1)无色酚酞溶液滴入NaOH、Ca(OH)2溶液中都会变成 色;
(2)NaOH、Ca(OH)2都需要密封保存,因为他们都能与空气中的 反应而变质;
(3)Ca(OH)2可用来改良 (填“酸”或“碱”)性土壤,但NaOH不能,应为NaOH具有强烈的 性。
20.化学与生活、生产息息相关.请你用所学化学知识回答下列问题
(1)在农业活动中,人们常用 来改良酸性土壤,写出一种常见的复合肥的化学式 .
(2)高铁酸钠(Na2FeO4)是一种新型高效的水处理剂,其中铁元素的化合价为 .
(3)净水器中经常使用活性炭,主要是利用活性炭的 .
(4)元素与身体健康密切相关,人体缺 会导致骨质酥松或佝偻病.
(5)用墨绘制的字画能够保存很长时间不变色,是因为 .
21.为了探究酸、碱、盐的化学性质,某实验小组在实验室进行了一系列实验。
(1)我国制碱工业的先驱是 (填字母)。
a.道尔顿 b.张青莲 c.门捷列夫 d.侯德榜
(2)为了探究酸与盐的反应,该小组同学进行了如图实验,将氯化钡溶液分别滴入稀盐酸和稀硫酸中,产生了不同的现象,从微观构成的角度解释其原因: 。
(3)该小组同学在试剂柜中发现一瓶粗盐水(含杂质MgSO4),为了得到NaCl晶体,进行了以下实验操作:
①写出加入过量的Ba(OH)2溶液发生反应的化学方程式: 。
②加适量盐酸的目的是什么? 。
③写出操作Ⅲ中玻璃棒的作用 。
(4)该小组同学用氢氧化钠溶液和稀盐酸进行酸碱中和实验,并根据实验数据绘制了如图图像。请回答下列问题:
①该实验是将 (填“稀盐酸”或“氢氧化钠溶液”)滴加到另一溶液中。
②图2中a点对应的温度最高,根据图1可知,a点时,加入试剂的体积是 mL。
③若用溶质质量分数为7.3%的稀盐酸来中和溶质质量为8g的氢氧化钠溶液,需要稀盐酸的质量是 ?
22.
(1)自来水属于 (填“纯净物”或“混合物”);检验自来水是硬水还是软水,可选用的物质是 ;生活中既能降低水的硬度,又能杀菌消毒的方法是 。
(2)某同学收集到一杯有臭味的浑浊河水,先用滤纸进行过滤,需用到的玻璃仪器有玻璃棒、 和 ,其中玻璃棒的作用是 ,过滤后发现水虽然变清,但依然有臭味,能除去臭味的物质是 。
(3)同学们为了探究水的组成,做了电解水实验,如右图所示,写出该实验中反应的文字表达式: ,实验开始后,发现两极都产生气泡,试管A中的气体是 。该实验证明: 。
(4)请写出一种生活中的节水方法: 。
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】B
4.【答案】A
5.【答案】B
6.【答案】C
7.【答案】B
8.【答案】B
9.【答案】D
10.【答案】C
11.【答案】D
12.【答案】C
13.【答案】(1)活性炭具有吸附性
(2)可以吸附色素和异味洗洁精对油污起到了乳化作用
(3)酸碱中和反应
14.【答案】SO2;SO2+2NaOH═Na2SO3+H2O
15.【答案】(1)产生气泡;Mg+2HCl═MgCl2+H2↑;没有明显现象;Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)氢离子(H+)
16.【答案】金属;潮湿的空气;熔点低;Fe(NO3)2
17.【答案】玫瑰;溶剂
18.【答案】溶于水后生成的胶状物对杂质的吸附,使杂质沉降来达到净水的目的;D;吸附;防止加热时出现暴沸
19.【答案】(1)红
(2)二氧化碳
(3)酸;腐蚀
20.【答案】(1)熟石灰;KNO3
(2)+6
(3)吸附
(4)钙
(5)常温下,碳的化学性质比较稳定
21.【答案】(1)d
(2)酸根离子不同
(3)Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;除去过量的碳酸钠和生成的氢氧化钠;搅拌,防止局部温度过高,造成液滴飞溅
(4)氢氧化钠溶液;30;解:设需要稀盐酸的质量为x, 答:要稀盐酸的质量是100g。
22.【答案】(1)混合物;肥皂水;煮沸
(2)漏斗;烧杯;引流;活性炭
(3)水 氢气+氧气;氢气;水是由氢、氧元素组成
(4)洗菜水浇花(合理均可)
一、单选题
1.黄金可以溶解在“王水”(浓盐酸与浓硝酸的混合液)中生成HAuCl4(四氯合金酸),没有氢气产生.根据以上信息,下列有关说法正确的是( )①“王水”溶解黄金是化学变化;②金比氢活泼 ③HAuCl4中,Au化合价为+3价,④可以将pH试纸伸入“王水”中测其酸碱度.
A.①④ B.①②③ C.③④ D.①③
2.下面的说法中,正确的是( )
A.最外层电子数为8的粒子,一定是稀有气体原子
B.某固体中加入稀盐酸,产生无色气体,该固体一定含CO32-
C.某无色溶液中滴加酚酞试液显红色,该溶液一定是碱溶液
D.只含有一种元素的物质,有可能是混合物
3.盛有石灰水的试剂瓶内壁常有一层白色固体物质,要清除它,应采用的方法是( )
A.用蒸馏水
B.用稀盐酸洗,再用水洗
C.用澄清的石灰水洗
D.用去污粉(主要成分为碳酸钠和细沙)洗
4.关于碱的下列说法正确的是( )
A.碱中一定含有H元素
B.使酚酞变红的都是碱溶液
C.碱和盐之间一定能发生复分解反应
D.酸与碱反应一定不产生沉淀
5.下列实验不能达到实验目的的是( )
A.除去MnO2中的KCl:加水溶解、过滤、洗涤、干燥
B.验证MnO2是H2O2分解的催化剂:向H2O2溶液中加入MnO2
C.检验Mg、Fe、Cu的活动性强弱:将铁丝分别插入氯化镁和氯化铜溶液中
D.稀释浓硫酸:将浓硫酸缓慢注入水中,并用玻璃棒不断搅拌
6.下列实验操作正确的是( )
A. 给液体加热
B. 测定溶液的pH
C. 测定氧气含量
D. 稀释浓硫酸
7.恰好中和100g溶质质量分数为8.0%的氢氧化钠溶液,需要100g溶质质量分数为7.3%的稀盐酸。若将稀盐酸换成100g溶质质量分数为7.3%的稀硫酸与其反应,则充分反应后溶液的pH( )
A.小于7 B.大于7 C.等于7 D.无法判断
8.汽车用铅蓄电池中需要质量分数为28%的稀硫酸.若在实验室中用10g质量分数为98%的浓硫酸(密度为1.84g/m3)配制28%的稀硫酸,下列做法或说法正确的是( )
A.将25mL水慢慢倒入盛有54mL浓硫酸的量筒中,并用玻璃棒不断搅拌
B.将10g98%的浓硫酸沿烧杯壁慢慢倒入盛有25mL水的烧杯中,并用玻璃棒不断搅拌
C.将28mL98%的浓硫酸沿烧杯壁慢慢倒入盛有100mL水的烧杯中,并用玻璃棒不断搅拌
D.若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28%
9.下列食物显碱性的是( )
食物 苹果汁 葡萄汁 牛奶 鸡蛋清
pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
A.苹果汁 B.葡萄汁 C.牛奶 D.鸡蛋清
10.除去下列物质中的少量杂质,所用试剂或方法不正确的是( )
选项 物质 杂质 试剂或方法
A NaCl固体 泥沙 加水溶解、过滤、蒸发
B MgCl2溶液 HCl 加过量Mg(OH)2、过滤
C KNO3 溶液 Ba(NO3)2 滴加过量K2SO4溶液、过滤
D CO2 H2O 通过浓硫酸干燥
A.A B.B C.C D.D
11.下列宏观事实的微观解释错误的是( )
A.一氧化碳和二氧化碳有不同的化学性质一一分子构成不同
B.蔗糖在热水中比在冷水中溶解快一一升高温度,分子运动速率加快
C.稀盐酸和稀硫酸均显酸性一一溶液中都含有氢离子
D.氧气经压缩储存在钢瓶中一一压强增大,分子体积变小
12.初中化学学习了很多化学反应,下列有关叙述中,不正确的是( )
A.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应
B.置换反应前后一定会有元素化合价的改变
C.两种化合物生成另外两种新化合物的反应一定是复分解反应
D.化合反应的生成物一定不是单质
二、填空题
13.学好化学能使我们更好地认识各种现象,更能合理地解决实际问题。下表列出生活中部分常见的问题和解决方法。
生活中常见问题 ⑴冰箱、汽车内有异味 ⑵洗涤油污 ⑶被蚂蚁、蚊子叮咬
解决方法 在冰箱、汽车内放活性炭 使用洗洁精清洗 涂上肥皂水
请你用化学知识分别叙述上表中三种解决方法的原理
(1)
(2)
(3)
14.形成酸雨的主要气体是 ,为了避免该气体对空气的污染,可用烧碱溶液吸收该气体,写出反应的方程式 .
15.请参与某学习小组进行研究性学习的过程,并协助完成相关任务:
【提出问题】在平时探讨酸的性质时,我们通常是讨论酸的水溶液.究竟水在酸显示酸的特性时扮演什么角色呢?
【确定研究对象】以我们最熟知的盐酸(氯化氢的水溶 液)和氯化氢进行探究.
【查阅资料】氯化氢溶于水时解离出氢离子和氯离子,而溶于干燥的甲苯(一种有机溶剂)时仍以氯化氢分子的形式分散(如图).
(1)【设计与实验】(请完成下表)
实验内容 实验现象 解释与结论
测定导电性 氯化氢的水溶液:导电性良好 氯化氢的水溶液中有自由移动的离子
氯化氢的甲苯溶液:不导电 氯化氢的甲苯溶液没有自由移动的离子
与镁作用 氯化氢的水溶液: 化学方程式:
氯化氢的甲苯溶液:没有明显现象 氯化氢的甲苯溶液没有解离出氢离子
与固态碳酸钠作用 氯化氢的水溶液:产生气泡 化学方程式:
氯化氢的甲苯溶液: 氯化氢的甲苯溶液没有解离出氢离子
(2)【讨论与反思】盐酸的酸性是因为氯化氢在水分子的作用下解离出了
16.金属与人类生活息息相关.
(1)生铁和钢是世界上用量最大的 (填“金属”或“合成”)材料,钢铁制品在 中易生锈.
(2)焊锡与其组成金属相比具有 的特性,可用来焊接电子元件.
(3)将铁粉投入含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则该溶质是 .
17.化学兴趣小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研细,加入酒精充分浸泡后过滤,得到三种溶液,将三种溶液分别加到下列液体中,得到以后信息:
花的种类 所制成溶液颜色 在有关试剂中呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
试回答:如果所制的溶液检验花盆中土壤的酸碱性,你会建议选择 花的酒精溶液来作酸碱指示剂:在以上三种酒精溶液中,酒精属于 ,(“溶质”或“溶剂”)
18.小宇同学去象牙山旅游时,用瓶装了一些山下的泉水,带回实验室,在老师的指导下,按下列流程进行实验,制取蒸馏水.
请回答下列问题:
(1)取水后加入明矾的作用是
(2)进行过滤操作时,下列做法错误的是 .
A.玻璃棒要靠在三层滤纸的一边 B.漏斗下端的管口要紧靠烧杯的内壁
C.滤纸的边缘要低于漏斗口 D.液面不要低于滤纸边缘
(3)向滤液中加入活性炭,利用其 性,除去水样中的色素和异味.
(4)在制取蒸馏水的过程中,在水中要放碎瓷片,其作用是 .
三、综合题
19.回答下列有关碱的性质的问题。
(1)无色酚酞溶液滴入NaOH、Ca(OH)2溶液中都会变成 色;
(2)NaOH、Ca(OH)2都需要密封保存,因为他们都能与空气中的 反应而变质;
(3)Ca(OH)2可用来改良 (填“酸”或“碱”)性土壤,但NaOH不能,应为NaOH具有强烈的 性。
20.化学与生活、生产息息相关.请你用所学化学知识回答下列问题
(1)在农业活动中,人们常用 来改良酸性土壤,写出一种常见的复合肥的化学式 .
(2)高铁酸钠(Na2FeO4)是一种新型高效的水处理剂,其中铁元素的化合价为 .
(3)净水器中经常使用活性炭,主要是利用活性炭的 .
(4)元素与身体健康密切相关,人体缺 会导致骨质酥松或佝偻病.
(5)用墨绘制的字画能够保存很长时间不变色,是因为 .
21.为了探究酸、碱、盐的化学性质,某实验小组在实验室进行了一系列实验。
(1)我国制碱工业的先驱是 (填字母)。
a.道尔顿 b.张青莲 c.门捷列夫 d.侯德榜
(2)为了探究酸与盐的反应,该小组同学进行了如图实验,将氯化钡溶液分别滴入稀盐酸和稀硫酸中,产生了不同的现象,从微观构成的角度解释其原因: 。
(3)该小组同学在试剂柜中发现一瓶粗盐水(含杂质MgSO4),为了得到NaCl晶体,进行了以下实验操作:
①写出加入过量的Ba(OH)2溶液发生反应的化学方程式: 。
②加适量盐酸的目的是什么? 。
③写出操作Ⅲ中玻璃棒的作用 。
(4)该小组同学用氢氧化钠溶液和稀盐酸进行酸碱中和实验,并根据实验数据绘制了如图图像。请回答下列问题:
①该实验是将 (填“稀盐酸”或“氢氧化钠溶液”)滴加到另一溶液中。
②图2中a点对应的温度最高,根据图1可知,a点时,加入试剂的体积是 mL。
③若用溶质质量分数为7.3%的稀盐酸来中和溶质质量为8g的氢氧化钠溶液,需要稀盐酸的质量是 ?
22.
(1)自来水属于 (填“纯净物”或“混合物”);检验自来水是硬水还是软水,可选用的物质是 ;生活中既能降低水的硬度,又能杀菌消毒的方法是 。
(2)某同学收集到一杯有臭味的浑浊河水,先用滤纸进行过滤,需用到的玻璃仪器有玻璃棒、 和 ,其中玻璃棒的作用是 ,过滤后发现水虽然变清,但依然有臭味,能除去臭味的物质是 。
(3)同学们为了探究水的组成,做了电解水实验,如右图所示,写出该实验中反应的文字表达式: ,实验开始后,发现两极都产生气泡,试管A中的气体是 。该实验证明: 。
(4)请写出一种生活中的节水方法: 。
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】B
4.【答案】A
5.【答案】B
6.【答案】C
7.【答案】B
8.【答案】B
9.【答案】D
10.【答案】C
11.【答案】D
12.【答案】C
13.【答案】(1)活性炭具有吸附性
(2)可以吸附色素和异味洗洁精对油污起到了乳化作用
(3)酸碱中和反应
14.【答案】SO2;SO2+2NaOH═Na2SO3+H2O
15.【答案】(1)产生气泡;Mg+2HCl═MgCl2+H2↑;没有明显现象;Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)氢离子(H+)
16.【答案】金属;潮湿的空气;熔点低;Fe(NO3)2
17.【答案】玫瑰;溶剂
18.【答案】溶于水后生成的胶状物对杂质的吸附,使杂质沉降来达到净水的目的;D;吸附;防止加热时出现暴沸
19.【答案】(1)红
(2)二氧化碳
(3)酸;腐蚀
20.【答案】(1)熟石灰;KNO3
(2)+6
(3)吸附
(4)钙
(5)常温下,碳的化学性质比较稳定
21.【答案】(1)d
(2)酸根离子不同
(3)Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;除去过量的碳酸钠和生成的氢氧化钠;搅拌,防止局部温度过高,造成液滴飞溅
(4)氢氧化钠溶液;30;解:设需要稀盐酸的质量为x, 答:要稀盐酸的质量是100g。
22.【答案】(1)混合物;肥皂水;煮沸
(2)漏斗;烧杯;引流;活性炭
(3)水 氢气+氧气;氢气;水是由氢、氧元素组成
(4)洗菜水浇花(合理均可)
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
