2022-2023学年鲁科版高中化学必修1 2.3氧化还原反应的应用(共22张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修1 2.3氧化还原反应的应用(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 62.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-01 15:25:57 | ||
图片预览



文档简介
(共22张PPT)
2016年巴西奥运会室外游泳池
相关负责人说,池水变浑变绿是藻类生长造成的。该泳池在一直使用NaClO抑制藻类生长的情况下,这次事件中工作人员又误加入了H2O2消毒剂。
疑问 :
为什么加入H2O2后池水变绿了?
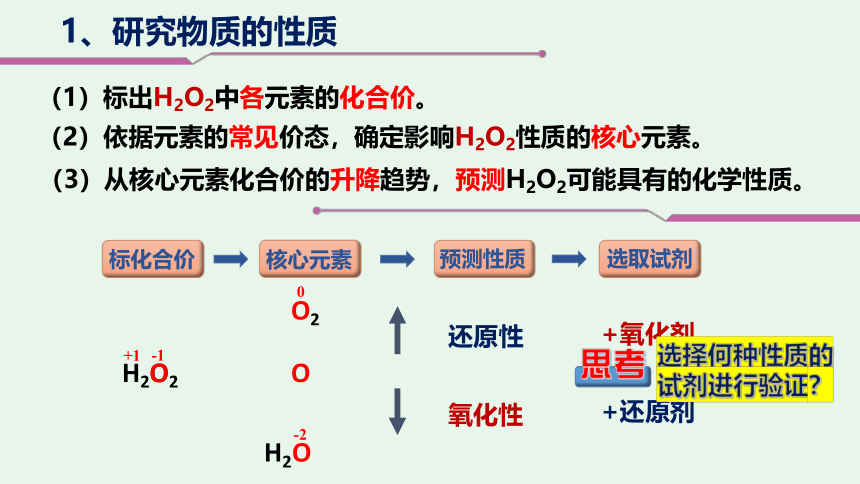
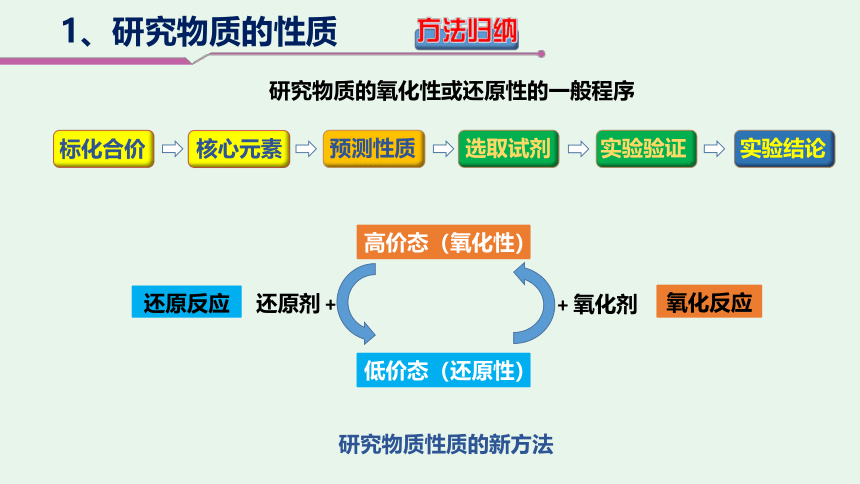
1、研究物质的性质
(1)标出H2O2中各元素的化合价。
(2)依据元素的常见价态,确定影响H2O2性质的核心元素。
O2
H2O2
H2O
-1
1、研究物质的性质
氧化性
还原性
+氧化剂
+还原剂
标化合价
预测性质
选取试剂
+1
O
0
-2
选择何种性质的试剂进行验证?
思考
核心元素
O
(3)从核心元素化合价的升降趋势,预测H2O2可能具有的化学性质。
可供选择实验试剂:5%H2O2、NaClO溶液、KI溶液、淀粉溶液
请选取合适试剂进行实验,并说明选取试剂的理由。
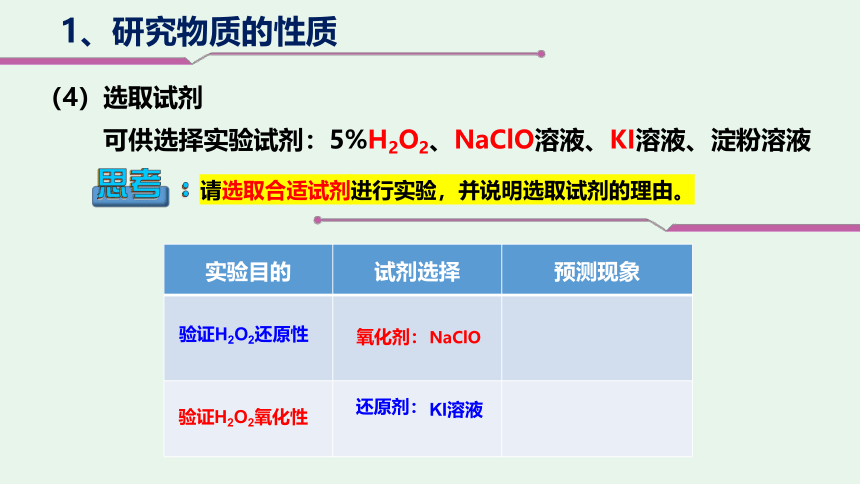
1、研究物质的性质
(4)选取试剂
实验目的 试剂选择 预测现象
验证H2O2氧化性
还原剂:
氧化剂:
验证H2O2还原性
思考 :
NaClO
KI溶液
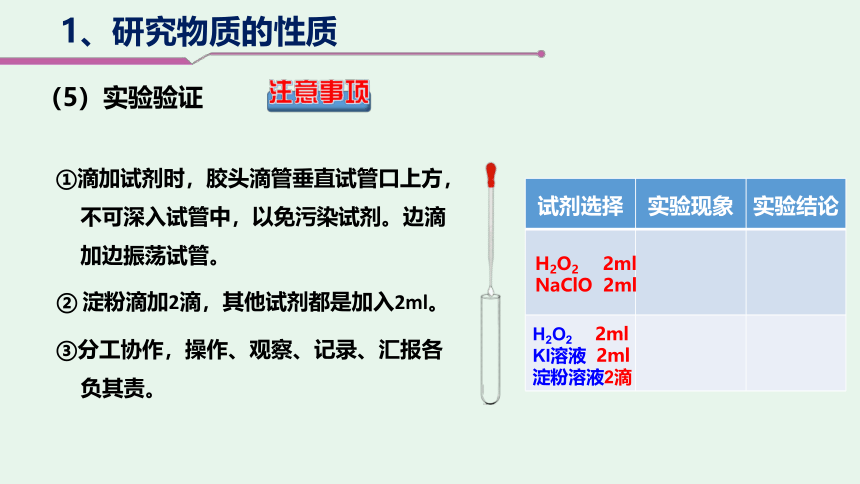
1、研究物质的性质
③分工协作,操作、观察、记录、汇报各
负其责。
①滴加试剂时,胶头滴管垂直试管口上方,
不可深入试管中,以免污染试剂。边滴
加边振荡试管。
注意事项
② 淀粉滴加2滴,其他试剂都是加入2ml。
试剂选择 实验现象 实验结论
H2O2 2ml
KI溶液 2ml
淀粉溶液2滴
H2O2 2ml
NaClO 2ml
(5)实验验证
1、研究物质的性质
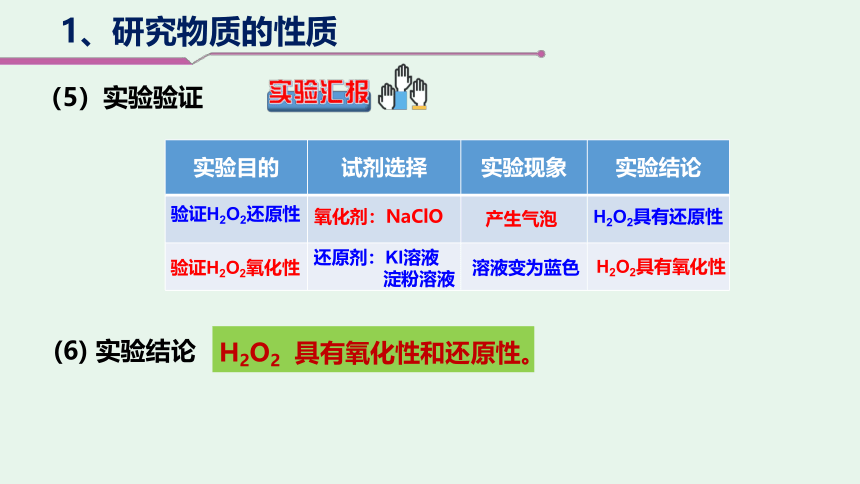
实验目的 试剂选择 实验现象 实验结论
验证H2O2氧化性
还原剂:KI溶液
淀粉溶液
溶液变为蓝色
H2O2具有氧化性
氧化剂:NaClO
产生气泡
H2O2具有还原性
验证H2O2还原性
(6) 实验结论
H2O2 具有氧化性和还原性。
(5)实验验证
实验汇报
1、研究物质的性质
标化合价
预测性质
选取试剂
实验验证
实验结论
低价态(还原性)
高价态(氧化性)
还原反应
研究物质的氧化性或还原性的一般程序
核心元素
方法归纳
研究物质性质的新方法
还原剂 +
+ 氧化剂
氧化反应
1、研究物质的性质
H2O2和NaClO
不可以同时使用。
NaClO+H2O2=NaCl+O2↑+H2O
问题解析
为什么加入H2O2后池水变绿了?
写出该反应的化学方程式
HClO
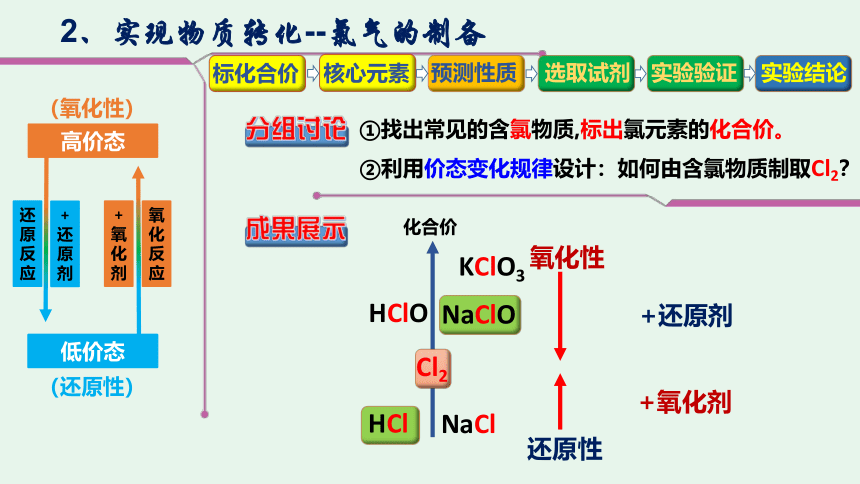
化合价
NaClO
Cl2
HCl
NaCl
KClO3
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
分组讨论
+
氧化剂
+还原剂
①找出常见的含氯物质,标出氯元素的化合价。
②利用价态变化规律设计:如何由含氯物质制取Cl2?
氧化性
还原性
+氧化剂
+还原剂
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
成果展示
2、实现物质转化--氯气的制备
NaClO
HCl
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
分组讨论
① 玻璃瓶中已放入NaClO溶液。
注意事项
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
② 注射器中吸入一定量HCl溶液,用注射
器把盐酸注入玻璃瓶中,观察实验现象。
③ 实验过程中不要将橡胶塞拔出。
①找出常见的含氯物质,标出氯元素的化合价。
②利用价态变化规律设计:如何由含氯物质制取Cl2?
2、实现物质转化--氯气的制备
写出该反应的化学方程式
NaClO+2HCl=NaCl+Cl2↑+H2O
HClO
化合价
NaClO
Cl2
HCl
NaCl
KClO3
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
分组讨论
+
氧化剂
+还原剂
氧化性
还原性
+氧化剂
+还原剂
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
成果展示
①找出常见的含氯物质,标出氯元素的化合价。
②利用价态变化规律设计由含氯物质制取Cl2的思路?
2、实现物质转化--氯气的制备
2、实现物质转化--氯气的制备
1774年瑞典化学家舍勒(C.W.Scheele),把浓HCl和软锰矿石(主要成分是MnO2)混合加热时,意外地收获了Cl2。至今,实验室中还用这种方法制取氯气。
NaClO+ 2HCl
NaCl + Cl2 ↑ + H2O
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
试剂选择的条件:科学性、安全性、易操作、速率适中等。
MnO2+ 4HCl(浓)
MnCl2 + Cl2 ↑ + 2H2O
写出该反应的化学方程式
2、实现物质转化--金属的冶炼
思考 :
①金属在自然界主要以游离态还是化合态形式存在?
黄铜矿
赤铁矿
铝土矿
菱镁矿
氯化钠
CuFeS2
Fe2O3
Al(OH)3
MgCO
NaCl
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
Au 单质
Ag 单质
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
2、实现物质转化--金属的冶炼
思考 :
②请标出Fe2O3中铁元素的化合价,分析如何实现转化?
实验结论
标化合价
预测性质
选取试剂
实验验证
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
Fe2O3
Fe
+还原剂
+3
0
CO
热还原法
?
2、实现物质转化--金属的冶炼
热还原法
电解法
金属
置换法
Mg
Al
Na
实验结论
标化合价
预测性质
选取试剂
实验验证
金属活动性顺序逐渐减弱
+2
+3
+1
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
黄铜矿
赤铁矿
铝土矿
菱镁矿
氯化钠
CuFeS2
Fe2O3
Al2O3
MgCO
NaCl
+3
+2
Cu
Fe
M
M
+x
热还原法
?
金属冶炼实质
得电子
2、实现物质转化--金属的冶炼
Li
合金材料
Ti
Fe
Mg
Al
W
Cu
Ni
Mn
Cr
Fe
Zn
富锌漆
储能电池
壳体材料
飞行甲板
燃气舵材料
火
箭
壳
体
逃
逸
塔
3、获得能量
2 N2H4+ 2NO2= 3N2+4H2O
2 H2+ O2= 2H2O
聚合物锂离子电池
锂电池
银锌纽扣电池
碱性锌锰干电池
新型磷酸铁锂电池
获得热能
获得电能
Fe +CuSO4=FeSO4+Cu
e-
氧化还原反应
实现物质的转化
获得能量
研究物质的性质
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
实验结论
标化合价
预测性质
选取试剂
实验验证
1.某元素在化学反应中由化合态变成游离态,则需要加入( )
A.一定是还原剂
B.一定是氧化剂
C.可能是还原剂也可能是氧化剂
C
Fe2O3+3CO === 2Fe+3CO2
高温
2H2O2 === 2H2O +O2
MnO2
(氧化性)
中间价态
低价态
(还原性)
高价态
+氧化剂
+还原剂
当
测
检
堂
MnCl2 + Cl2 ↑ + 2H2O
MnO2+ 4HCl(浓)
2. 钛(Ti)被称为继铁、铝之后的第三金属,由TiO2制取Ti的主要反应有:
①TiO2+2C+2Cl2 = TiCl4+2CO
②TiCl4+2Mg=2MgCl2+Ti
下列叙述正确的是 ( )
A.反应①是置换反应 B.反应②是置换反应
C.反应①中TiO2是还原剂 D. 反应②说明Mg是氧化剂
当
测
检
堂
B
3. 汽车尾气中常含有NO、CO等气体,在催化剂的作用下NO和CO可反应生成和,请写出该反应的化学方程式:___________________________________。
当
测
检
堂
4. 鲜榨的苹果汁饮料中含有Fe2+,暴露在空气中,Fe2+会被氧化为Fe3+,由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有( )
A.氧化性 B.还原性 C.酸性 D.碱性
B
祝愿同学们学业精进,梦想成真!
敬请各位专家、老师批评指正!
2016年巴西奥运会室外游泳池
相关负责人说,池水变浑变绿是藻类生长造成的。该泳池在一直使用NaClO抑制藻类生长的情况下,这次事件中工作人员又误加入了H2O2消毒剂。
疑问 :
为什么加入H2O2后池水变绿了?
1、研究物质的性质
(1)标出H2O2中各元素的化合价。
(2)依据元素的常见价态,确定影响H2O2性质的核心元素。
O2
H2O2
H2O
-1
1、研究物质的性质
氧化性
还原性
+氧化剂
+还原剂
标化合价
预测性质
选取试剂
+1
O
0
-2
选择何种性质的试剂进行验证?
思考
核心元素
O
(3)从核心元素化合价的升降趋势,预测H2O2可能具有的化学性质。
可供选择实验试剂:5%H2O2、NaClO溶液、KI溶液、淀粉溶液
请选取合适试剂进行实验,并说明选取试剂的理由。
1、研究物质的性质
(4)选取试剂
实验目的 试剂选择 预测现象
验证H2O2氧化性
还原剂:
氧化剂:
验证H2O2还原性
思考 :
NaClO
KI溶液
1、研究物质的性质
③分工协作,操作、观察、记录、汇报各
负其责。
①滴加试剂时,胶头滴管垂直试管口上方,
不可深入试管中,以免污染试剂。边滴
加边振荡试管。
注意事项
② 淀粉滴加2滴,其他试剂都是加入2ml。
试剂选择 实验现象 实验结论
H2O2 2ml
KI溶液 2ml
淀粉溶液2滴
H2O2 2ml
NaClO 2ml
(5)实验验证
1、研究物质的性质
实验目的 试剂选择 实验现象 实验结论
验证H2O2氧化性
还原剂:KI溶液
淀粉溶液
溶液变为蓝色
H2O2具有氧化性
氧化剂:NaClO
产生气泡
H2O2具有还原性
验证H2O2还原性
(6) 实验结论
H2O2 具有氧化性和还原性。
(5)实验验证
实验汇报
1、研究物质的性质
标化合价
预测性质
选取试剂
实验验证
实验结论
低价态(还原性)
高价态(氧化性)
还原反应
研究物质的氧化性或还原性的一般程序
核心元素
方法归纳
研究物质性质的新方法
还原剂 +
+ 氧化剂
氧化反应
1、研究物质的性质
H2O2和NaClO
不可以同时使用。
NaClO+H2O2=NaCl+O2↑+H2O
问题解析
为什么加入H2O2后池水变绿了?
写出该反应的化学方程式
HClO
化合价
NaClO
Cl2
HCl
NaCl
KClO3
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
分组讨论
+
氧化剂
+还原剂
①找出常见的含氯物质,标出氯元素的化合价。
②利用价态变化规律设计:如何由含氯物质制取Cl2?
氧化性
还原性
+氧化剂
+还原剂
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
成果展示
2、实现物质转化--氯气的制备
NaClO
HCl
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
分组讨论
① 玻璃瓶中已放入NaClO溶液。
注意事项
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
② 注射器中吸入一定量HCl溶液,用注射
器把盐酸注入玻璃瓶中,观察实验现象。
③ 实验过程中不要将橡胶塞拔出。
①找出常见的含氯物质,标出氯元素的化合价。
②利用价态变化规律设计:如何由含氯物质制取Cl2?
2、实现物质转化--氯气的制备
写出该反应的化学方程式
NaClO+2HCl=NaCl+Cl2↑+H2O
HClO
化合价
NaClO
Cl2
HCl
NaCl
KClO3
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
分组讨论
+
氧化剂
+还原剂
氧化性
还原性
+氧化剂
+还原剂
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
成果展示
①找出常见的含氯物质,标出氯元素的化合价。
②利用价态变化规律设计由含氯物质制取Cl2的思路?
2、实现物质转化--氯气的制备
2、实现物质转化--氯气的制备
1774年瑞典化学家舍勒(C.W.Scheele),把浓HCl和软锰矿石(主要成分是MnO2)混合加热时,意外地收获了Cl2。至今,实验室中还用这种方法制取氯气。
NaClO+ 2HCl
NaCl + Cl2 ↑ + H2O
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
试剂选择的条件:科学性、安全性、易操作、速率适中等。
MnO2+ 4HCl(浓)
MnCl2 + Cl2 ↑ + 2H2O
写出该反应的化学方程式
2、实现物质转化--金属的冶炼
思考 :
①金属在自然界主要以游离态还是化合态形式存在?
黄铜矿
赤铁矿
铝土矿
菱镁矿
氯化钠
CuFeS2
Fe2O3
Al(OH)3
MgCO
NaCl
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
Au 单质
Ag 单质
标化合价
预测性质
选取试剂
实验验证
实验结论
核心元素
2、实现物质转化--金属的冶炼
思考 :
②请标出Fe2O3中铁元素的化合价,分析如何实现转化?
实验结论
标化合价
预测性质
选取试剂
实验验证
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
Fe2O3
Fe
+还原剂
+3
0
CO
热还原法
?
2、实现物质转化--金属的冶炼
热还原法
电解法
金属
置换法
Mg
Al
Na
实验结论
标化合价
预测性质
选取试剂
实验验证
金属活动性顺序逐渐减弱
+2
+3
+1
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
黄铜矿
赤铁矿
铝土矿
菱镁矿
氯化钠
CuFeS2
Fe2O3
Al2O3
MgCO
NaCl
+3
+2
Cu
Fe
M
M
+x
热还原法
?
金属冶炼实质
得电子
2、实现物质转化--金属的冶炼
Li
合金材料
Ti
Fe
Mg
Al
W
Cu
Ni
Mn
Cr
Fe
Zn
富锌漆
储能电池
壳体材料
飞行甲板
燃气舵材料
火
箭
壳
体
逃
逸
塔
3、获得能量
2 N2H4+ 2NO2= 3N2+4H2O
2 H2+ O2= 2H2O
聚合物锂离子电池
锂电池
银锌纽扣电池
碱性锌锰干电池
新型磷酸铁锂电池
获得热能
获得电能
Fe +CuSO4=FeSO4+Cu
e-
氧化还原反应
实现物质的转化
获得能量
研究物质的性质
低价态
高价态
还原反应
氧化反应
(氧化性)
(还原性)
+
氧化剂
+还原剂
实验结论
标化合价
预测性质
选取试剂
实验验证
1.某元素在化学反应中由化合态变成游离态,则需要加入( )
A.一定是还原剂
B.一定是氧化剂
C.可能是还原剂也可能是氧化剂
C
Fe2O3+3CO === 2Fe+3CO2
高温
2H2O2 === 2H2O +O2
MnO2
(氧化性)
中间价态
低价态
(还原性)
高价态
+氧化剂
+还原剂
当
测
检
堂
MnCl2 + Cl2 ↑ + 2H2O
MnO2+ 4HCl(浓)
2. 钛(Ti)被称为继铁、铝之后的第三金属,由TiO2制取Ti的主要反应有:
①TiO2+2C+2Cl2 = TiCl4+2CO
②TiCl4+2Mg=2MgCl2+Ti
下列叙述正确的是 ( )
A.反应①是置换反应 B.反应②是置换反应
C.反应①中TiO2是还原剂 D. 反应②说明Mg是氧化剂
当
测
检
堂
B
3. 汽车尾气中常含有NO、CO等气体,在催化剂的作用下NO和CO可反应生成和,请写出该反应的化学方程式:___________________________________。
当
测
检
堂
4. 鲜榨的苹果汁饮料中含有Fe2+,暴露在空气中,Fe2+会被氧化为Fe3+,由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有( )
A.氧化性 B.还原性 C.酸性 D.碱性
B
祝愿同学们学业精进,梦想成真!
敬请各位专家、老师批评指正!
