5.2.2 氨和铵盐(教学课件)(共32张PPT)-高中化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.2 氨和铵盐(教学课件)(共32张PPT)-高中化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 27.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 09:59:18 | ||
图片预览









文档简介
(共32张PPT)
组织建设
第2课时 氨和铵盐
导入
我们经常在城市的广场上看到美丽的喷泉,那么你知道,在实验室里也可以形成美丽的喷泉吗?这一节课,我们就讲一种可以形成喷泉的物质---NH3。
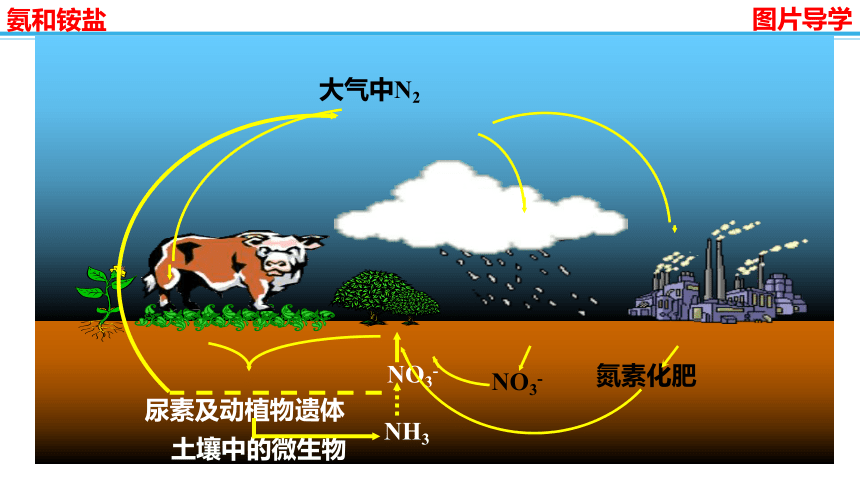
大气中N2
NO3-
NH3
尿素及动植物遗体
NO3-
土壤中的微生物
氮素化肥
图片导学
科学史话
N是一切动植物生长都需的营养元素。大气中含有N2,但不能被多数生物直接吸收,多数生物只能吸收含N的化合物。
合成氨是人类发展史上的一项重大突破,解决了因粮食不足而导致的饥饿和死亡问题。
哈伯(1868—1934),德国化学家,合成氨工业的奠基人。1918年哈伯由于对合成氨研究作出过重大贡献,而获诺贝尔化学奖。
1900年,化学家勒沙特列通过计算,认为N2、H2在高压条件下可直接生成氨,接着用实验来验证。但实验过程中发生了爆炸,他没调查事故原因,觉得这实验有危险,放弃了研究。勒沙特列的合成氨实验就这样夭折了。
稍后,德国耐斯特通过理论计算,认为合成氨是不可能的。故人工合成氨研究又一次止步
科学史话
在合成氨研究屡屡受挫的情况下,德国另一位化学家哈伯知难而进,对合成氨进行了全面系统地研究和实验,终于在1908年7月在实验室里用N2和H2在600℃、200个大气压下合成氨,产率虽只有2%,但却是科学上的一项重大突破。
当哈伯的合成氨工艺流程公众于世后,立即引起了德国统治者注意,他们为了达到吞并欧洲称霸世界的野心,同时也利用哈伯想成为百万富翁的贪婪心理,请哈伯继续研究。短短两年内,哈伯提高了合成氨产率,且合成了1000吨液氨,并用它造出3500吨烈性炸药TNT。
1913年第一次世界大战时,哈伯已为德国建了无数个合成氨工厂,制造了数百万吨炸药,从而导致并蔓延了秧祸全球的世界大战,这也是第一次世界大战德国为什么能坚持这么久的谜底。
当事实真相大白于天下时,哈伯受到了各国科学家的猛烈抨击,尤当他获得1918年诺贝尔化学奖时,更激起了世界人民的愤怒。
人工合成氨实验的成功令人欢心鼓舞,它对工农业生产、国防科技的重大意义是不言而喻的。但三位科学家留给后人的思考也是深刻的—科学必须造福于民!
NH3
物理性质
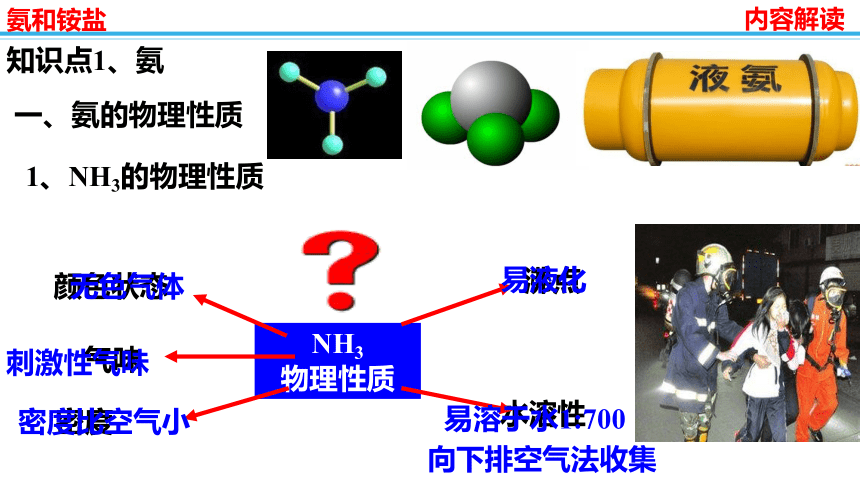
1、NH3的物理性质
内容解读
知识点1、氨
一、氨的物理性质
颜色状态
无色气体
气味
刺激性气味
密度
密度比空气小
沸点
易液化
水溶性
易溶于水1:700
向下排空气法收集
2、NH3的喷泉实验
视频导学
干燥的充满NH3的圆底烧瓶
玻璃管和滴管(预先加水)
盛水的烧杯(水中滴有酚酞溶液)
操作:打开止水夹,轻挤压胶头滴管,使少量的水进入烧瓶。
【迁移·应用】
1.(2019·石家庄高一检测) 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是( )
A.Cl2(饱和食盐水) 无色喷泉
B.NH3(H2O含石蕊) 蓝色喷泉
C.HCl(H2O含石蕊) 红色喷泉
D.CO2(NaOH溶液) 无色喷泉
A
探究讨论
形成喷泉原因:
氨气极易溶于水,瓶内外较大的压强差,大气压将水压入烧瓶。
现象:烧杯中的水进入烧瓶中,形成红色的喷泉
水溶液呈碱性,有OH-存在
胶头滴管的作用:形成负压差,引发
喷泉实验成功的关键:
装置气密性好;
烧瓶要干燥;
气体纯度高
溶液不能充满烧瓶:
收集气体混有空气
若VL烧瓶充满标况下的氨气,所得溶液物质的量浓度:
c
1
22.4
= mol/L
知识解读
二、氨的化学性质
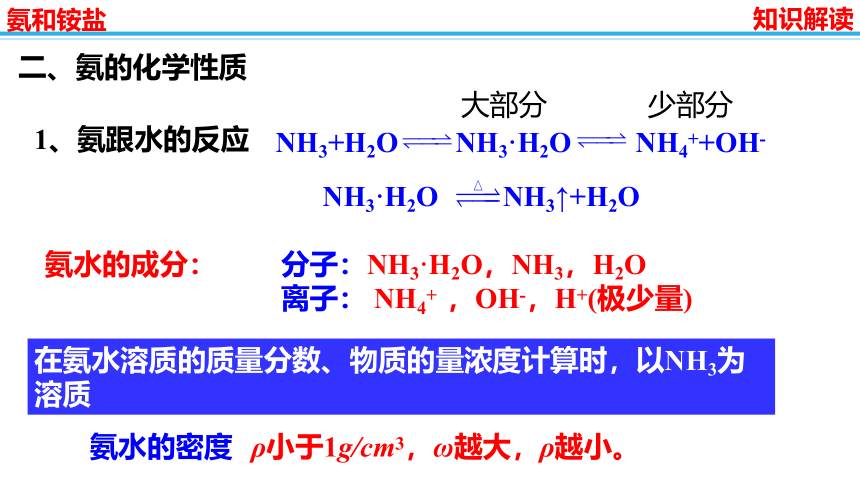
1、氨跟水的反应
分子:NH3·H2O,NH3,H2O
离子: NH4+ ,OH-,H+(极少量)
氨水的成分:
氨水的密度
ρ小于1g/cm3,ω越大,ρ越小。
在氨水溶质的质量分数、物质的量浓度计算时,以NH3为溶质
NH3+H2O NH3·H2O NH4++OH-
NH3·H2O NH3↑+H2O
大部分 少部分
知识解读
2、氨跟酸的反应
NH3+HCl = NH4Cl (现象:白烟)
2NH3+H2SO4= (NH4)2SO4
NH3+HNO3 = NH4NO3 (现象:白烟)
NH3+H+= NH4+(与酸反应的本质)
此反应可检验NH3或HCl
3、氨跟某些盐溶液的反应
Al3 + +3NH3+3H2O = Al(OH)3↓+3NH4+
知识解读
(1)氨的催化氧化
4、氨的氧化反应
4NH3+5O2==== 4NO+6H2O
催化剂
△
N2
NH3
NO
NO2
HNO3
O2
O2
H2O
H2
8NH3(过量) + 3Cl2 = N2 + 6NH4Cl (产生白烟)
(2)氨的一般氧化
2NH3(不足) + 3Cl2 = N2 + 6HCl
(可用来检验氯气管道是否漏气)
2NH3 + 3CuO N2 + 3Cu + 3H2O (实验室制氮气)
2xNH3 + 3NOx N2 + 3xH2O
△
催化剂
(治理氮氧化物的污染)
氨的用途
三、氨的用途
制尿素
内容解读
制纯碱
做致冷剂
制硝酸
内容解读
NH3
硝酸
铵盐
纯碱
有机合成
工业原料
稀氨水治疗
蚊虫叮咬
消除NO2
污染
吸收硫酸生产中的二氧化硫
致冷剂
1、铵盐:
由铵根离子(NH4+)与酸根离子构成的化合物
物理性质:无色或白色晶体,绝大多数铵盐都易溶于水
2、铵盐的化学性质
⑴不稳定性---受热易分解
内容解读
知识点2、铵盐
⑵与碱反应放出NH3
△
NH4NO3 + NaOH == NH3↑+NaNO3 + H2O
3、铵盐(NH4+)的检验
△
NH4Cl + NaOH == NH3↑+NaCl + H2O
(固体混合加热)
(液体混合加热)
1、工业制法:
N2+3H2 2NH3
高温高压
催化剂
四、氨气的制法
2、氨气的实验室制法
⑴原料:NH4Cl与Ca(OH)2混合加热
内容解读
注意:铵盐一般不选用NH4NO3、(NH4)2SO4、(NH4)2CO3,碱一般不选用KOH、NaOH。
⑵原理:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
⑶制取装置:
固固加热装置
⑷收集装置:
向下排空气法
棉花的作用:
防止空气对流
⑸验满:
a:湿润的红色石蕊试纸变蓝(唯一碱性气体)
b:蘸有浓HCl的玻璃棒接近试管口产生白烟
⑹环保措施:
浓硫酸吸收多余的氨气.
⑺干燥装置
水——装置:倒扣漏斗
用碱石灰干燥
方法二:加热浓氨水制氨气
NH3·H2O === NH3↑+H2O
△
方法三:浓氨水滴入生石灰(NaOH)中制氨气
CaO或NaOH
浓氨水
内容解读
氨气的物理性质
氨气的用途
氨气的化学性质
铵盐及其性质
氨气的实验室制法
合成氨
当堂总结
课时小结
2、能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4四种溶液一一区别开来的试剂是 ( )
A 、NaOH B、 AgNO3 C、 BaCl2 D、 Ba(OH)2
1、A、B、C三种气体,A无色,在一定条件下A能与O2反应生成B,
B不溶于水,它能与O2反应生成红棕色气体C;A、C气体均溶与水,其水溶液分别呈碱性与酸性,推断A ,B ,C 。
NH3
NO
NO2
课堂巩固
BaSO4 白色沉淀
D
刺激性气味 NH3
组织建设
第2课时 氨和铵盐
导入
我们经常在城市的广场上看到美丽的喷泉,那么你知道,在实验室里也可以形成美丽的喷泉吗?这一节课,我们就讲一种可以形成喷泉的物质---NH3。
大气中N2
NO3-
NH3
尿素及动植物遗体
NO3-
土壤中的微生物
氮素化肥
图片导学
科学史话
N是一切动植物生长都需的营养元素。大气中含有N2,但不能被多数生物直接吸收,多数生物只能吸收含N的化合物。
合成氨是人类发展史上的一项重大突破,解决了因粮食不足而导致的饥饿和死亡问题。
哈伯(1868—1934),德国化学家,合成氨工业的奠基人。1918年哈伯由于对合成氨研究作出过重大贡献,而获诺贝尔化学奖。
1900年,化学家勒沙特列通过计算,认为N2、H2在高压条件下可直接生成氨,接着用实验来验证。但实验过程中发生了爆炸,他没调查事故原因,觉得这实验有危险,放弃了研究。勒沙特列的合成氨实验就这样夭折了。
稍后,德国耐斯特通过理论计算,认为合成氨是不可能的。故人工合成氨研究又一次止步
科学史话
在合成氨研究屡屡受挫的情况下,德国另一位化学家哈伯知难而进,对合成氨进行了全面系统地研究和实验,终于在1908年7月在实验室里用N2和H2在600℃、200个大气压下合成氨,产率虽只有2%,但却是科学上的一项重大突破。
当哈伯的合成氨工艺流程公众于世后,立即引起了德国统治者注意,他们为了达到吞并欧洲称霸世界的野心,同时也利用哈伯想成为百万富翁的贪婪心理,请哈伯继续研究。短短两年内,哈伯提高了合成氨产率,且合成了1000吨液氨,并用它造出3500吨烈性炸药TNT。
1913年第一次世界大战时,哈伯已为德国建了无数个合成氨工厂,制造了数百万吨炸药,从而导致并蔓延了秧祸全球的世界大战,这也是第一次世界大战德国为什么能坚持这么久的谜底。
当事实真相大白于天下时,哈伯受到了各国科学家的猛烈抨击,尤当他获得1918年诺贝尔化学奖时,更激起了世界人民的愤怒。
人工合成氨实验的成功令人欢心鼓舞,它对工农业生产、国防科技的重大意义是不言而喻的。但三位科学家留给后人的思考也是深刻的—科学必须造福于民!
NH3
物理性质
1、NH3的物理性质
内容解读
知识点1、氨
一、氨的物理性质
颜色状态
无色气体
气味
刺激性气味
密度
密度比空气小
沸点
易液化
水溶性
易溶于水1:700
向下排空气法收集
2、NH3的喷泉实验
视频导学
干燥的充满NH3的圆底烧瓶
玻璃管和滴管(预先加水)
盛水的烧杯(水中滴有酚酞溶液)
操作:打开止水夹,轻挤压胶头滴管,使少量的水进入烧瓶。
【迁移·应用】
1.(2019·石家庄高一检测) 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是( )
A.Cl2(饱和食盐水) 无色喷泉
B.NH3(H2O含石蕊) 蓝色喷泉
C.HCl(H2O含石蕊) 红色喷泉
D.CO2(NaOH溶液) 无色喷泉
A
探究讨论
形成喷泉原因:
氨气极易溶于水,瓶内外较大的压强差,大气压将水压入烧瓶。
现象:烧杯中的水进入烧瓶中,形成红色的喷泉
水溶液呈碱性,有OH-存在
胶头滴管的作用:形成负压差,引发
喷泉实验成功的关键:
装置气密性好;
烧瓶要干燥;
气体纯度高
溶液不能充满烧瓶:
收集气体混有空气
若VL烧瓶充满标况下的氨气,所得溶液物质的量浓度:
c
1
22.4
= mol/L
知识解读
二、氨的化学性质
1、氨跟水的反应
分子:NH3·H2O,NH3,H2O
离子: NH4+ ,OH-,H+(极少量)
氨水的成分:
氨水的密度
ρ小于1g/cm3,ω越大,ρ越小。
在氨水溶质的质量分数、物质的量浓度计算时,以NH3为溶质
NH3+H2O NH3·H2O NH4++OH-
NH3·H2O NH3↑+H2O
大部分 少部分
知识解读
2、氨跟酸的反应
NH3+HCl = NH4Cl (现象:白烟)
2NH3+H2SO4= (NH4)2SO4
NH3+HNO3 = NH4NO3 (现象:白烟)
NH3+H+= NH4+(与酸反应的本质)
此反应可检验NH3或HCl
3、氨跟某些盐溶液的反应
Al3 + +3NH3+3H2O = Al(OH)3↓+3NH4+
知识解读
(1)氨的催化氧化
4、氨的氧化反应
4NH3+5O2==== 4NO+6H2O
催化剂
△
N2
NH3
NO
NO2
HNO3
O2
O2
H2O
H2
8NH3(过量) + 3Cl2 = N2 + 6NH4Cl (产生白烟)
(2)氨的一般氧化
2NH3(不足) + 3Cl2 = N2 + 6HCl
(可用来检验氯气管道是否漏气)
2NH3 + 3CuO N2 + 3Cu + 3H2O (实验室制氮气)
2xNH3 + 3NOx N2 + 3xH2O
△
催化剂
(治理氮氧化物的污染)
氨的用途
三、氨的用途
制尿素
内容解读
制纯碱
做致冷剂
制硝酸
内容解读
NH3
硝酸
铵盐
纯碱
有机合成
工业原料
稀氨水治疗
蚊虫叮咬
消除NO2
污染
吸收硫酸生产中的二氧化硫
致冷剂
1、铵盐:
由铵根离子(NH4+)与酸根离子构成的化合物
物理性质:无色或白色晶体,绝大多数铵盐都易溶于水
2、铵盐的化学性质
⑴不稳定性---受热易分解
内容解读
知识点2、铵盐
⑵与碱反应放出NH3
△
NH4NO3 + NaOH == NH3↑+NaNO3 + H2O
3、铵盐(NH4+)的检验
△
NH4Cl + NaOH == NH3↑+NaCl + H2O
(固体混合加热)
(液体混合加热)
1、工业制法:
N2+3H2 2NH3
高温高压
催化剂
四、氨气的制法
2、氨气的实验室制法
⑴原料:NH4Cl与Ca(OH)2混合加热
内容解读
注意:铵盐一般不选用NH4NO3、(NH4)2SO4、(NH4)2CO3,碱一般不选用KOH、NaOH。
⑵原理:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
⑶制取装置:
固固加热装置
⑷收集装置:
向下排空气法
棉花的作用:
防止空气对流
⑸验满:
a:湿润的红色石蕊试纸变蓝(唯一碱性气体)
b:蘸有浓HCl的玻璃棒接近试管口产生白烟
⑹环保措施:
浓硫酸吸收多余的氨气.
⑺干燥装置
水——装置:倒扣漏斗
用碱石灰干燥
方法二:加热浓氨水制氨气
NH3·H2O === NH3↑+H2O
△
方法三:浓氨水滴入生石灰(NaOH)中制氨气
CaO或NaOH
浓氨水
内容解读
氨气的物理性质
氨气的用途
氨气的化学性质
铵盐及其性质
氨气的实验室制法
合成氨
当堂总结
课时小结
2、能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4四种溶液一一区别开来的试剂是 ( )
A 、NaOH B、 AgNO3 C、 BaCl2 D、 Ba(OH)2
1、A、B、C三种气体,A无色,在一定条件下A能与O2反应生成B,
B不溶于水,它能与O2反应生成红棕色气体C;A、C气体均溶与水,其水溶液分别呈碱性与酸性,推断A ,B ,C 。
NH3
NO
NO2
课堂巩固
BaSO4 白色沉淀
D
刺激性气味 NH3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
