1.1.3构造原理 课件(共17张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.3构造原理 课件(共17张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 10:43:32 | ||
图片预览



文档简介
(共17张PPT)
选择性必修二 第一章原子结构和性质
原子结构
第三课时
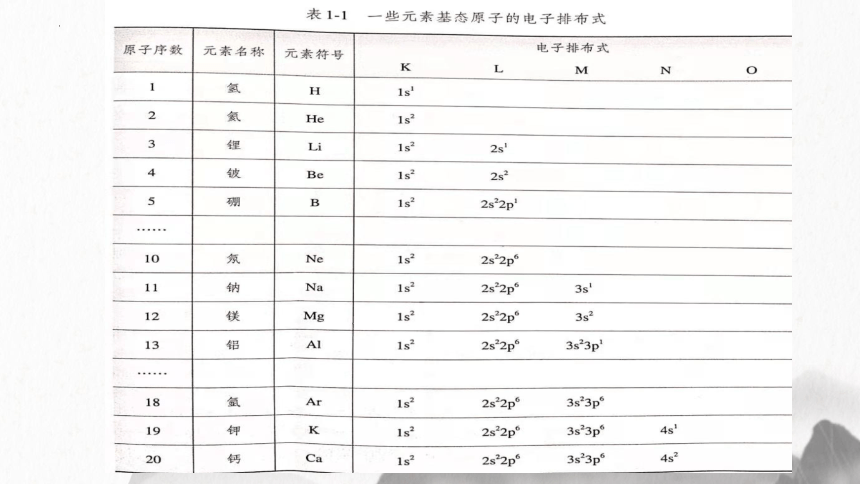
这就是Mg的核外电子排布式
1s2 2s2 2p6 3s2
请标出能层上的能级符号,并将能级上
所含有的电子数标在能级符号的右上角
【问题探究】
根据已有知识,试写出K原子的可能电子排布式与原子结构示意图?
猜想一:
+19
2 8 9
1s22s22p63s23p63d1
猜想二:
+19
2 8 8 1
1s22s22p63s23p64s1
×
√
+12
2 8 2
Mg
构造原理与电子排布式
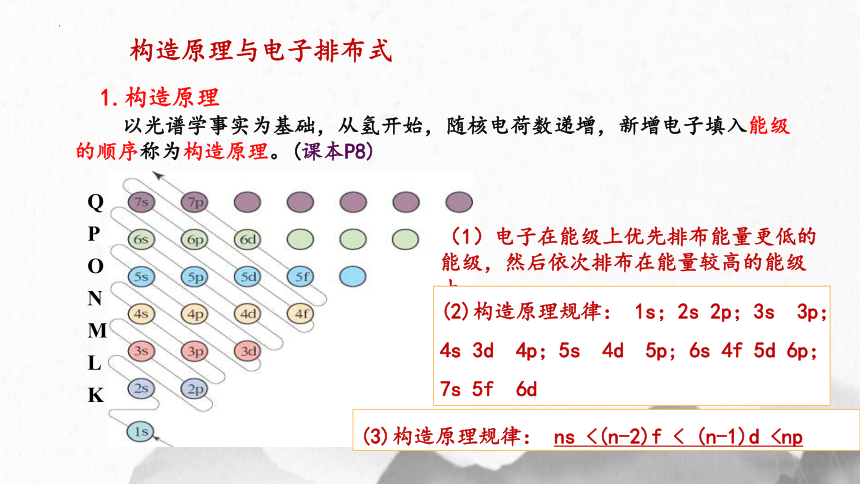
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。(课本P8)
Q
P
O
N
M
L
K
(1)电子在能级上优先排布能量更低的能级,然后依次排布在能量较高的能级上。
(2)构造原理规律: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
(3)构造原理规律: ns <(n-2)f < (n-1)d各能级的能量高低顺序:
ns < (n-2)f < (n-1)d < np
2. 能级交错现象:
构造原理与电子排布式 P8
从第三能层开始部分能级不完全遵循能层顺序,内层能级能量比外层能级高,称之为能级交错现象.
如 E(4s)记住
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p ... ...
构造原理
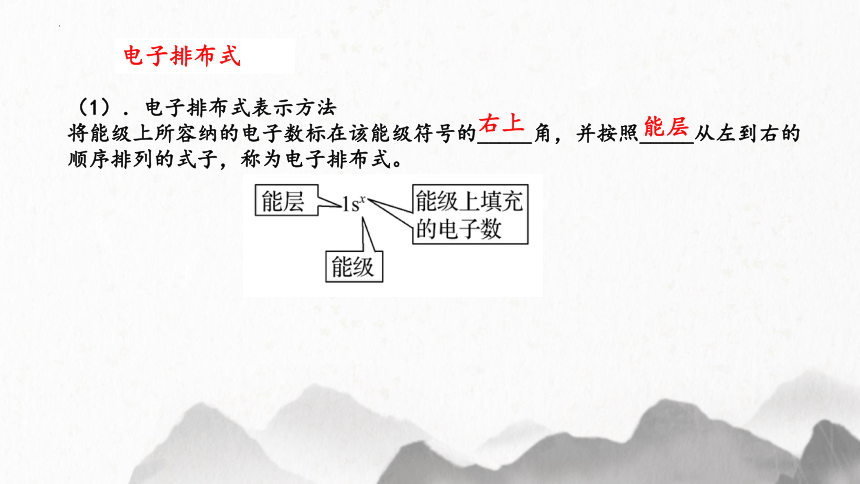
电子排布式
(1).电子排布式表示方法
将能级上所容纳的电子数标在该能级符号的_____角,并按照_____从左到右的
顺序排列的式子,称为电子排布式。
右上
能层
跟踪练习书写原则
按照构造原理将电子依次填充到能量逐渐升高的能级中
各能级的能量高低顺序
ns<(n-2)f<(n-1)d<np (n为能层序数)
一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
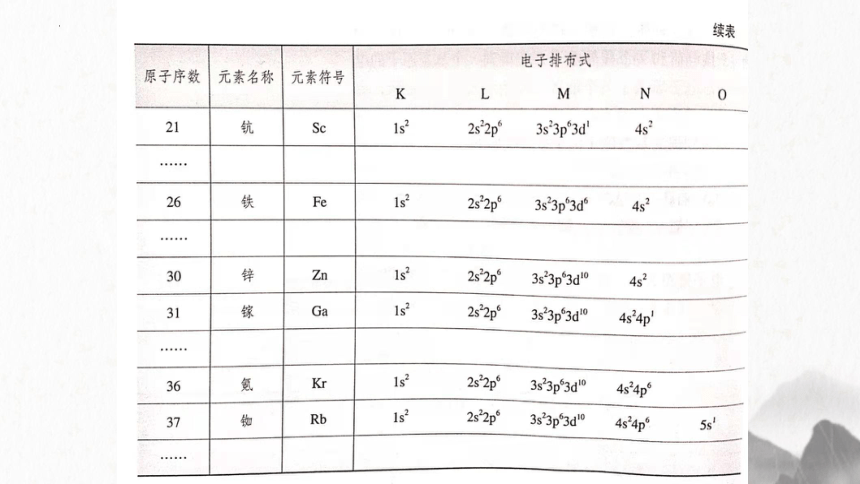
26Fe 1s22s22p63s23p63d64s2,
基态铬、铜的核外电子排布不符合构造原理
Cr基态原子的电子排布式:
Cu基态原子的电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
半充满
全充满
能级交错
随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的,这种现象被称为能级交错。
从第三能层开始出现能级交错现象,能级交错排列的顺序即电子能量由低到高的顺序,即Ens<E(n-2)f<E(n-1)d<Enp
电子排布式的书写
特殊原子的核外电子排布式
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。
(1)24Cr的电子排布式的书写
半充满
29Cu的电子排布式的书写
全充满
试写出下列原子的价层电子排布:
①13Al:_______;②34Se:_______;
③ 29Cu:_______; ④ 26Fe:_______;
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。如:28Ni的简化电子排布式为__________,价层电子排布为______,
[Ar]3d84s2
3d84s2
3s23p1
4s24p4
:表示价电子的式子称为价电子排布式。
特点:
①主族元素的价电子就是最外层电子数;
②过渡金属元素的价电子主要包括:最外层电子和次外层d能级上的电子。
3d64s2
3d104s1
价电子排布式
(3)原子得到电子形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
离子的电子排布式
(1)判断该原子变成离子时会得到或失去的电子数。
(2)原子失去电子时,总是从能量高的能层失去电子,
即失去电子的顺序是由外向里。
一般来说,主族元素只失去它们的最外层电子,而副族元素可能还会进一步向里失去内层电子。
Cl-:1s22s22p63s23p6
Cl:1s22s22p63s23p5
如
(得到的电子填充在最外面的3p能级上)
Na+ 1s22s22p6
Na 1s22s22p63s1
如
(失去最外层的3s能级上的电子)
练习:试写出Fe、 Fe2+ 、Fe3+的电子排布式。
1s22s22p63s23p63d64s2
Fe2+
或者[Ar]3d6
(失去最外层的4s能级上的2个电子)
Fe3+
或者[Ar]3d5
(失去最外层的4s能级上的2个电子和内层3d上的1个电子)
26Fe:
1s22s22p63s23p63d6
1s22s22p63s23p63d5
或者[Ar]3d64s2
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
能层
能级
符号:K L M N O P Q
能量:K → Q依次升高
符号:s、p、d、f、g
能级数=能层序数
课堂小结
选择性必修二 第一章原子结构和性质
原子结构
第三课时
这就是Mg的核外电子排布式
1s2 2s2 2p6 3s2
请标出能层上的能级符号,并将能级上
所含有的电子数标在能级符号的右上角
【问题探究】
根据已有知识,试写出K原子的可能电子排布式与原子结构示意图?
猜想一:
+19
2 8 9
1s22s22p63s23p63d1
猜想二:
+19
2 8 8 1
1s22s22p63s23p64s1
×
√
+12
2 8 2
Mg
构造原理与电子排布式
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。(课本P8)
Q
P
O
N
M
L
K
(1)电子在能级上优先排布能量更低的能级,然后依次排布在能量较高的能级上。
(2)构造原理规律: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
(3)构造原理规律: ns <(n-2)f < (n-1)d
ns < (n-2)f < (n-1)d < np
2. 能级交错现象:
构造原理与电子排布式 P8
从第三能层开始部分能级不完全遵循能层顺序,内层能级能量比外层能级高,称之为能级交错现象.
如 E(4s)
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p ... ...
构造原理
电子排布式
(1).电子排布式表示方法
将能级上所容纳的电子数标在该能级符号的_____角,并按照_____从左到右的
顺序排列的式子,称为电子排布式。
右上
能层
跟踪练习书写原则
按照构造原理将电子依次填充到能量逐渐升高的能级中
各能级的能量高低顺序
ns<(n-2)f<(n-1)d<np (n为能层序数)
一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
26Fe 1s22s22p63s23p63d64s2,
基态铬、铜的核外电子排布不符合构造原理
Cr基态原子的电子排布式:
Cu基态原子的电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
半充满
全充满
能级交错
随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的,这种现象被称为能级交错。
从第三能层开始出现能级交错现象,能级交错排列的顺序即电子能量由低到高的顺序,即Ens<E(n-2)f<E(n-1)d<Enp
电子排布式的书写
特殊原子的核外电子排布式
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。
(1)24Cr的电子排布式的书写
半充满
29Cu的电子排布式的书写
全充满
试写出下列原子的价层电子排布:
①13Al:_______;②34Se:_______;
③ 29Cu:_______; ④ 26Fe:_______;
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。如:28Ni的简化电子排布式为__________,价层电子排布为______,
[Ar]3d84s2
3d84s2
3s23p1
4s24p4
:表示价电子的式子称为价电子排布式。
特点:
①主族元素的价电子就是最外层电子数;
②过渡金属元素的价电子主要包括:最外层电子和次外层d能级上的电子。
3d64s2
3d104s1
价电子排布式
(3)原子得到电子形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
离子的电子排布式
(1)判断该原子变成离子时会得到或失去的电子数。
(2)原子失去电子时,总是从能量高的能层失去电子,
即失去电子的顺序是由外向里。
一般来说,主族元素只失去它们的最外层电子,而副族元素可能还会进一步向里失去内层电子。
Cl-:1s22s22p63s23p6
Cl:1s22s22p63s23p5
如
(得到的电子填充在最外面的3p能级上)
Na+ 1s22s22p6
Na 1s22s22p63s1
如
(失去最外层的3s能级上的电子)
练习:试写出Fe、 Fe2+ 、Fe3+的电子排布式。
1s22s22p63s23p63d64s2
Fe2+
或者[Ar]3d6
(失去最外层的4s能级上的2个电子)
Fe3+
或者[Ar]3d5
(失去最外层的4s能级上的2个电子和内层3d上的1个电子)
26Fe:
1s22s22p63s23p63d6
1s22s22p63s23p63d5
或者[Ar]3d64s2
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
能层
能级
符号:K L M N O P Q
能量:K → Q依次升高
符号:s、p、d、f、g
能级数=能层序数
课堂小结
