5.2.3 铵盐、氨气的制备课件(共16张ppt) 2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3 铵盐、氨气的制备课件(共16张ppt) 2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 10:48:20 | ||
图片预览






文档简介
第二节 氮及其化合物
第3课时 铵盐、氨气的制备
第五章 化工生产中的重要非金属元素
氮——植物生长的守护神
植物缺氮症状:
叶片黄化,植株瘦弱
缺氮小麦麦穗发育不良
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3、NH4NO3、 CO(NH2)2等。
一
铵盐
绝大多数铵盐是白色 或无色晶体,都易溶于水
铵盐的物理性质
01
铵盐是由铵根离子(????????????+)和酸根离子组成的化合物
?
不稳定性
——受热易分解
NH4Cl === NH3↑+HCl ↑
NH4HCO3 === NH3 ↑ +CO2 ↑ +H2O
注意:并不是所有的铵盐都受热分解生成NH3
2NH4NO3==========2N2↑+O2↑+4H2O
高温或猛烈撞击
NH4NO3 === N2O ↑ +2H2O
铵盐的化学性质
02
两者遇冷又马上化合成NH4Cl
(NH4)2CO3 == 2NH3↑ + H2O + CO2↑
Δ
NH4+
思考:怎样存放铵态氮肥?
密封包装并放在阴凉通风干燥处
向盛有少量NH4Cl溶液,NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因。
现象:
湿润的红色石蕊试纸变蓝。
反应中有碱性气体产生。
结论:
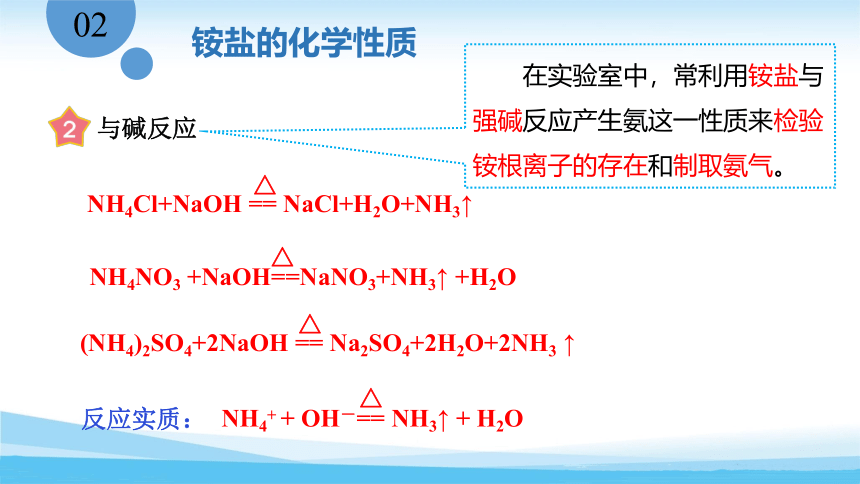
实验5-7 铵盐与强碱的反应
与碱反应
△
NH4NO3 +NaOH==NaNO3+NH3↑ +H2O
(NH4)2SO4+2NaOH == Na2SO4+2H2O+2NH3 ↑
△
NH4Cl+NaOH == NaCl+H2O+NH3↑
△
NH4+ + OH-== NH3↑ + H2O
△
反应实质:
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨气。
铵盐的化学性质
02
为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
草木灰中含有K2CO3, K2CO3溶液显碱性。铵盐能与碱性物质反应生成氨,如果与碱性物质混合施用,会造成肥效降低。
思考与讨论
取少许样品与碱混合于试管中共热,将湿润的红色石蕊试纸靠近管口,若试纸变蓝,则证明样品中含有NH4+ 。
取少许样品于试管中,放入碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
铵根离子的检验
03
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
装置
验满
试剂
原理
固+固→加热型
向下排空气法
或蘸浓盐酸的玻璃棒靠近有白烟生成
(与氧气的制取装置相同)
氯化铵晶体、消石灰固体
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
收集
湿润的红色石蕊试纸变蓝
二
氨气的实验室制法
碱石灰、固体氧化钙、固体氢氧化钠
干燥
也不能用无水CaCl2
会反应产生CaCl2?8NH3
浓硫酸等酸性干燥剂不能干燥NH3
尾气处理
酸溶液或水
二
氨气的实验室制法
可在导管口放一团用酸溶液或水浸湿的棉花球
棉花作用: 减少NH3与空气的对流,吸收多余的NH3,防止污染空气
易溶于水的要用防倒吸装置
1. 加热NH4Cl能制取NH3吗?
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3
思考与讨论
2. 碱不选用NaOH、KOH,为什么?
NaOH、KOH易吸水结块,且对玻璃腐蚀性较强
氨水具有不稳定性和挥发性,受热易分解。
NH3·H2O ==== NH3↑ + H2O
氨气的快速简易制法
02
加热浓氨水
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。
氨气的快速简易制法
02
浓氨水滴入生石灰(或NaOH)中
催化剂
高温、高压
N2 + 3H2 2NH3
氨气的工业制法
03
第3课时 铵盐、氨气的制备
第五章 化工生产中的重要非金属元素
氮——植物生长的守护神
植物缺氮症状:
叶片黄化,植株瘦弱
缺氮小麦麦穗发育不良
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3、NH4NO3、 CO(NH2)2等。
一
铵盐
绝大多数铵盐是白色 或无色晶体,都易溶于水
铵盐的物理性质
01
铵盐是由铵根离子(????????????+)和酸根离子组成的化合物
?
不稳定性
——受热易分解
NH4Cl === NH3↑+HCl ↑
NH4HCO3 === NH3 ↑ +CO2 ↑ +H2O
注意:并不是所有的铵盐都受热分解生成NH3
2NH4NO3==========2N2↑+O2↑+4H2O
高温或猛烈撞击
NH4NO3 === N2O ↑ +2H2O
铵盐的化学性质
02
两者遇冷又马上化合成NH4Cl
(NH4)2CO3 == 2NH3↑ + H2O + CO2↑
Δ
NH4+
思考:怎样存放铵态氮肥?
密封包装并放在阴凉通风干燥处
向盛有少量NH4Cl溶液,NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因。
现象:
湿润的红色石蕊试纸变蓝。
反应中有碱性气体产生。
结论:
实验5-7 铵盐与强碱的反应
与碱反应
△
NH4NO3 +NaOH==NaNO3+NH3↑ +H2O
(NH4)2SO4+2NaOH == Na2SO4+2H2O+2NH3 ↑
△
NH4Cl+NaOH == NaCl+H2O+NH3↑
△
NH4+ + OH-== NH3↑ + H2O
△
反应实质:
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨气。
铵盐的化学性质
02
为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
草木灰中含有K2CO3, K2CO3溶液显碱性。铵盐能与碱性物质反应生成氨,如果与碱性物质混合施用,会造成肥效降低。
思考与讨论
取少许样品与碱混合于试管中共热,将湿润的红色石蕊试纸靠近管口,若试纸变蓝,则证明样品中含有NH4+ 。
取少许样品于试管中,放入碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
铵根离子的检验
03
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
装置
验满
试剂
原理
固+固→加热型
向下排空气法
或蘸浓盐酸的玻璃棒靠近有白烟生成
(与氧气的制取装置相同)
氯化铵晶体、消石灰固体
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
收集
湿润的红色石蕊试纸变蓝
二
氨气的实验室制法
碱石灰、固体氧化钙、固体氢氧化钠
干燥
也不能用无水CaCl2
会反应产生CaCl2?8NH3
浓硫酸等酸性干燥剂不能干燥NH3
尾气处理
酸溶液或水
二
氨气的实验室制法
可在导管口放一团用酸溶液或水浸湿的棉花球
棉花作用: 减少NH3与空气的对流,吸收多余的NH3,防止污染空气
易溶于水的要用防倒吸装置
1. 加热NH4Cl能制取NH3吗?
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3
思考与讨论
2. 碱不选用NaOH、KOH,为什么?
NaOH、KOH易吸水结块,且对玻璃腐蚀性较强
氨水具有不稳定性和挥发性,受热易分解。
NH3·H2O ==== NH3↑ + H2O
氨气的快速简易制法
02
加热浓氨水
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。
氨气的快速简易制法
02
浓氨水滴入生石灰(或NaOH)中
催化剂
高温、高压
N2 + 3H2 2NH3
氨气的工业制法
03
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
