第五章第一节第一课时硫和二氧化硫课件(共27张PPT) 2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章第一节第一课时硫和二氧化硫课件(共27张PPT) 2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 42.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 10:55:15 | ||
图片预览







文档简介
(共27张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第一课时 硫和二氧化硫
1.了解硫的物理、化学性质。
2.掌握二氧化硫的主要化学性质。(重点)
3.了解三氧化硫的物理、化学性质。
本节学习目标
预习检测1:
1.硫的存在
2.物理性质
3.如何洗涤
1.1硫的存在:
游离态:
存在于火山喷口附近或地壳的岩层里。
硫广泛存在于自然界。
石膏(CaSO4 2H2O)
芒硝(Na2SO4 10H2O)
化合态:
主要以硫化物和硫酸盐的形式存在。
黄铜矿(CuFeS2)
黄铁矿(FeS2)
硫还是一种生命元素,组成某些蛋白质离不开它
蛋白质中的硫:蛋黄内含硫,如果煮鸡蛋的时间过长,硫会转移到蛋黄的边缘,形成灰色的细环。
硫是增强人们体质的蛋白质中至关重要的一部分。蛋白质分解后会产生硫化氢,有臭蛋味的有毒气体。
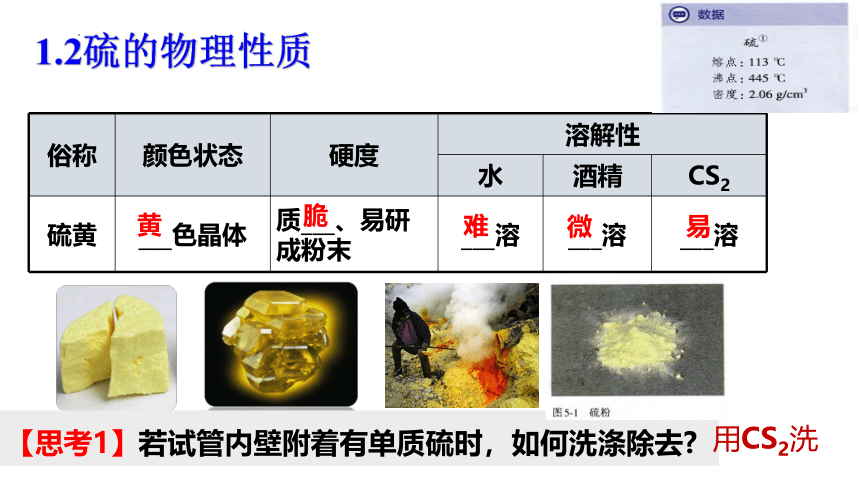
俗称 颜色状态 硬度 溶解性
水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
难
微
易
【思考1】若试管内壁附着有单质硫时,如何洗涤除去
用CS2洗
1.2硫的物理性质
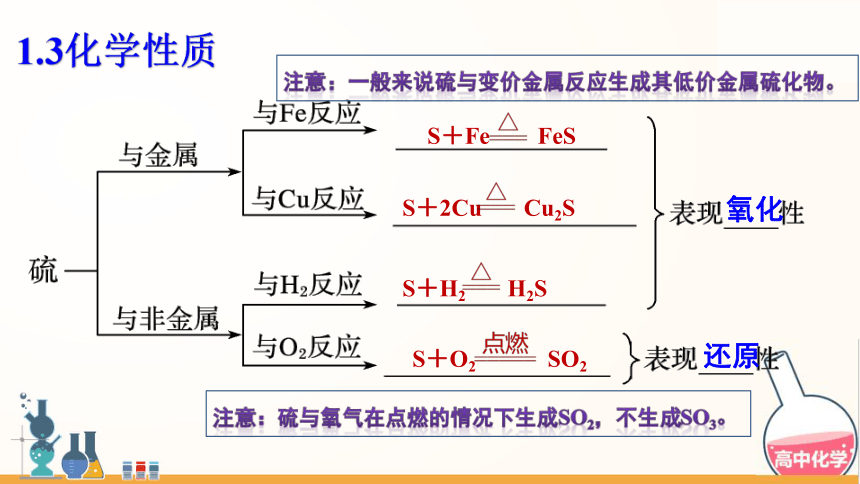
S+Fe FeS
S+2Cu Cu2S
S+H2 H2S
S+O2 SO2
氧化
还原
1.3化学性质
注意:一般来说硫与变价金属反应生成其低价金属硫化物。
注意:硫与氧气在点燃的情况下生成so2,不生成so3。
(1)在自然界中有游离态的硫存在( )
(2)试管内壁的硫粉可以用热碱液或 CS2 除去( )
(3)硫与金属反应,生成金属的低价态化合物( )
(4)硫的氧化性比氯气强( )
(5)硫是一种黄色的能溶于水的晶体( )
(6)硫的化合物常存在于火山喷出的气体中和矿泉水里( )
(7)硫在空气中燃烧的产物是二氧化硫,硫在纯氧中燃烧的产物是三氧化硫( )
(8)我国古代四大发明之一的黑火药是以硫黄等为原料配制而成的( )
√
√
√
×
×
√
×
√
2.已知0.1 mol某单质与足量的硫在一定条件下充分反应后质量增加了1.6 g,则该单质可能是
A.钙 B.铜 C.铁 D.铝
____色, __________气味的_____毒气体,密
度比空气____,沸点是-10 ℃,易______。
无
有刺激性
有
大
液化
易溶于水
(1:40)
2.1二氧化硫物理性质
预习检测2:
1.原理:
SO2的实验室制法
H2SO4 (浓) + Na2SO3 = SO2 ↑ +H2O+ Na2SO4
收集:用“向上排空气法”
或“排饱和NaHSO3溶液法”。
验满:湿润的蓝色石蕊试纸
2.收集与验满
探究一:二氧化硫是否溶于水,是否与水反应?
把充满SO2,塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度。
探究结论:
探究现象:
试管内液面上升,试纸变红
SO2易溶于水,溶液呈酸性
SO2 + H2O
正反应
逆反应
H2SO3
在相同条件下, 既能向正反应方向进行, 同时又能向逆反应方向进行的化学反应。(反应体系中,反应物和生成物共存)
可逆反应:
H2 燃烧生成水, 水通电时生成氢气和氧气, 是可逆反应吗?
① 酸性氧化物的通性
SO2+2NaOH===Na2SO3+H2O
SO2 +CaO===CaSO3
SO2+H2O H2SO3
SO3具有酸性氧化物的通性
SO3+Ca(OH)2===CaSO4+H2O
SO3+CaO===CaSO4
SO3+H2O===H2SO4(放出大量的热)
2.2二氧化硫(SO2)化学性质{四性}
CO2 通入澄清石灰水至过量,现象是?
SO2 通入澄清石灰水至过量,现象是?
二、二氧化硫
SO2+Br2+2H2O===H2SO4+2HBr
5SO2+2KMnO4+2H2O===K2SO4 + 2MnSO4+2H2SO4
②还原性(+4 → +6)
笔记:SO2可使氯水、溴水、KMnO4溶液褪色,可用于吸收或鉴别
③氧化性(+4 → 0)
SO2 + 2H2S = 3S + 2H2O
H2S
SO2
(弱氧化性)
2SO2+O2 ==== 2SO3
催化剂
△
④漂白性【实验5-2】
实验现象:
实验结论:
二氧化硫有漂白作用,但漂白后生成的新物质不稳定,易恢复到原来的颜色。
原理 范围 效果 物质
氧化 漂白 HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等
化合 漂白 SO2等
吸附 漂白 活性炭、胶体等
常见漂白剂的漂白原理及特点
可漂白大多数有机色质,
能使紫色石蕊试液先变红后褪色
漂白某些有机色物质,
不能使紫色石蕊试液褪色
可漂白大多数有色物质
暂时
永久
永久
2.10
食用这类食品,对人体的肝、肾脏等会造成严重损害,并会致癌。
北京市场黄白两种银耳对比 中央电视台《生活》栏目
丑小鸭
白天鹅
不可使用于食品漂白
但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
(2)可以漂白纸浆、毛、丝、草编制品等。
(3)杀灭霉菌和细菌。
(4)作食物和干果的防腐剂。
(5)二氧化硫在葡萄酒果汁中可以 杀菌、
抗氧化防腐的作用。(见教材第4页资料卡片)
(1)制造硫酸:
SO3: 无色固体, 熔点(16.8℃)和沸点(44.8℃) ,
标况下为非气体。化学性质:酸性氧化物的通性
二氧化硫的用途
2SO2 + O2 2SO3
催化剂
△
二氧化硫的化学性质
还原性
SO2
+4
S H2S
0
-2
SO3
+6
SO42-
+6
氧化性
漂白性
使品红溶液褪色
酸性氧化物的通性
SO32-
+4
H2SO3
+4
分类观
价态观
价态观
特殊性
1.标准状况下,2.24 L SO3中含有硫原子数为NA ( )
2.将SO2通入紫色石蕊溶液中,紫色石蕊溶液先变红后褪色( )
3.SO2具有氧化性,可用于漂白纸浆( )
4.SO2中少量的HCl可通过饱和NaHSO3溶液除去( )
5.SO2使滴有酚酞的NaOH溶液褪色,体现了SO2的漂白性( )
6.SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,
漂白效果更好( )
7.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同( )
×
×
×
√
×
×
×
2.9
2.如图是实验室探究二氧化硫化学性质的实验装置,分析每个装置反应和现象:
H2SO4 (浓) + Na2SO3 = SO2 ↑ +H2O+ Na2SO4
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2 + Ba(OH)2 = BaCO3↓+H2O
SO2 + 2H2S = 3S↓+ 2H2O
3.某混合气体由SO2 CO2 和水蒸气组成,为分别检验三
种气体,使用下列装置:
d装置作用是___________________________
说明存在CO2的实验现象是___________________
a
b
c
d
e
无水硫酸铜
品红
高锰酸钾
品红
澄清石灰水
d中品红不褪色,e中出现白色浑浊
检验SO2是否除净
可供选择的药品为:酸性高锰酸钾溶液、品红溶液、澄清石灰水、无水硫酸铜,指明各容器中的药品
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第一课时 硫和二氧化硫
1.了解硫的物理、化学性质。
2.掌握二氧化硫的主要化学性质。(重点)
3.了解三氧化硫的物理、化学性质。
本节学习目标
预习检测1:
1.硫的存在
2.物理性质
3.如何洗涤
1.1硫的存在:
游离态:
存在于火山喷口附近或地壳的岩层里。
硫广泛存在于自然界。
石膏(CaSO4 2H2O)
芒硝(Na2SO4 10H2O)
化合态:
主要以硫化物和硫酸盐的形式存在。
黄铜矿(CuFeS2)
黄铁矿(FeS2)
硫还是一种生命元素,组成某些蛋白质离不开它
蛋白质中的硫:蛋黄内含硫,如果煮鸡蛋的时间过长,硫会转移到蛋黄的边缘,形成灰色的细环。
硫是增强人们体质的蛋白质中至关重要的一部分。蛋白质分解后会产生硫化氢,有臭蛋味的有毒气体。
俗称 颜色状态 硬度 溶解性
水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
难
微
易
【思考1】若试管内壁附着有单质硫时,如何洗涤除去
用CS2洗
1.2硫的物理性质
S+Fe FeS
S+2Cu Cu2S
S+H2 H2S
S+O2 SO2
氧化
还原
1.3化学性质
注意:一般来说硫与变价金属反应生成其低价金属硫化物。
注意:硫与氧气在点燃的情况下生成so2,不生成so3。
(1)在自然界中有游离态的硫存在( )
(2)试管内壁的硫粉可以用热碱液或 CS2 除去( )
(3)硫与金属反应,生成金属的低价态化合物( )
(4)硫的氧化性比氯气强( )
(5)硫是一种黄色的能溶于水的晶体( )
(6)硫的化合物常存在于火山喷出的气体中和矿泉水里( )
(7)硫在空气中燃烧的产物是二氧化硫,硫在纯氧中燃烧的产物是三氧化硫( )
(8)我国古代四大发明之一的黑火药是以硫黄等为原料配制而成的( )
√
√
√
×
×
√
×
√
2.已知0.1 mol某单质与足量的硫在一定条件下充分反应后质量增加了1.6 g,则该单质可能是
A.钙 B.铜 C.铁 D.铝
____色, __________气味的_____毒气体,密
度比空气____,沸点是-10 ℃,易______。
无
有刺激性
有
大
液化
易溶于水
(1:40)
2.1二氧化硫物理性质
预习检测2:
1.原理:
SO2的实验室制法
H2SO4 (浓) + Na2SO3 = SO2 ↑ +H2O+ Na2SO4
收集:用“向上排空气法”
或“排饱和NaHSO3溶液法”。
验满:湿润的蓝色石蕊试纸
2.收集与验满
探究一:二氧化硫是否溶于水,是否与水反应?
把充满SO2,塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度。
探究结论:
探究现象:
试管内液面上升,试纸变红
SO2易溶于水,溶液呈酸性
SO2 + H2O
正反应
逆反应
H2SO3
在相同条件下, 既能向正反应方向进行, 同时又能向逆反应方向进行的化学反应。(反应体系中,反应物和生成物共存)
可逆反应:
H2 燃烧生成水, 水通电时生成氢气和氧气, 是可逆反应吗?
① 酸性氧化物的通性
SO2+2NaOH===Na2SO3+H2O
SO2 +CaO===CaSO3
SO2+H2O H2SO3
SO3具有酸性氧化物的通性
SO3+Ca(OH)2===CaSO4+H2O
SO3+CaO===CaSO4
SO3+H2O===H2SO4(放出大量的热)
2.2二氧化硫(SO2)化学性质{四性}
CO2 通入澄清石灰水至过量,现象是?
SO2 通入澄清石灰水至过量,现象是?
二、二氧化硫
SO2+Br2+2H2O===H2SO4+2HBr
5SO2+2KMnO4+2H2O===K2SO4 + 2MnSO4+2H2SO4
②还原性(+4 → +6)
笔记:SO2可使氯水、溴水、KMnO4溶液褪色,可用于吸收或鉴别
③氧化性(+4 → 0)
SO2 + 2H2S = 3S + 2H2O
H2S
SO2
(弱氧化性)
2SO2+O2 ==== 2SO3
催化剂
△
④漂白性【实验5-2】
实验现象:
实验结论:
二氧化硫有漂白作用,但漂白后生成的新物质不稳定,易恢复到原来的颜色。
原理 范围 效果 物质
氧化 漂白 HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等
化合 漂白 SO2等
吸附 漂白 活性炭、胶体等
常见漂白剂的漂白原理及特点
可漂白大多数有机色质,
能使紫色石蕊试液先变红后褪色
漂白某些有机色物质,
不能使紫色石蕊试液褪色
可漂白大多数有色物质
暂时
永久
永久
2.10
食用这类食品,对人体的肝、肾脏等会造成严重损害,并会致癌。
北京市场黄白两种银耳对比 中央电视台《生活》栏目
丑小鸭
白天鹅
不可使用于食品漂白
但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
(2)可以漂白纸浆、毛、丝、草编制品等。
(3)杀灭霉菌和细菌。
(4)作食物和干果的防腐剂。
(5)二氧化硫在葡萄酒果汁中可以 杀菌、
抗氧化防腐的作用。(见教材第4页资料卡片)
(1)制造硫酸:
SO3: 无色固体, 熔点(16.8℃)和沸点(44.8℃) ,
标况下为非气体。化学性质:酸性氧化物的通性
二氧化硫的用途
2SO2 + O2 2SO3
催化剂
△
二氧化硫的化学性质
还原性
SO2
+4
S H2S
0
-2
SO3
+6
SO42-
+6
氧化性
漂白性
使品红溶液褪色
酸性氧化物的通性
SO32-
+4
H2SO3
+4
分类观
价态观
价态观
特殊性
1.标准状况下,2.24 L SO3中含有硫原子数为NA ( )
2.将SO2通入紫色石蕊溶液中,紫色石蕊溶液先变红后褪色( )
3.SO2具有氧化性,可用于漂白纸浆( )
4.SO2中少量的HCl可通过饱和NaHSO3溶液除去( )
5.SO2使滴有酚酞的NaOH溶液褪色,体现了SO2的漂白性( )
6.SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,
漂白效果更好( )
7.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同( )
×
×
×
√
×
×
×
2.9
2.如图是实验室探究二氧化硫化学性质的实验装置,分析每个装置反应和现象:
H2SO4 (浓) + Na2SO3 = SO2 ↑ +H2O+ Na2SO4
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2 + Ba(OH)2 = BaCO3↓+H2O
SO2 + 2H2S = 3S↓+ 2H2O
3.某混合气体由SO2 CO2 和水蒸气组成,为分别检验三
种气体,使用下列装置:
d装置作用是___________________________
说明存在CO2的实验现象是___________________
a
b
c
d
e
无水硫酸铜
品红
高锰酸钾
品红
澄清石灰水
d中品红不褪色,e中出现白色浑浊
检验SO2是否除净
可供选择的药品为:酸性高锰酸钾溶液、品红溶液、澄清石灰水、无水硫酸铜,指明各容器中的药品
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
