1.2.1电解质的电离课件(共17张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离课件(共17张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 882.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 10:56:13 | ||
图片预览




文档简介
(共17张PPT)
第一章 物质及其变化
第二节 离子反应
第一课时 电解质的电离
夏天,出了很多汗的手不能去接触电器或擦拭电器,否则容易发生触电事故。一旦有人因接触电线发生触电事故,在取走电线时应用干燥的木杆挑走,切不可直接用手拿走。
知识源于生活
NaCl、H2O
向三个烧杯中分别加入干燥的氯化钠固体、硝酸钾固体和蒸馏水。按照图示连接装置,将石墨电极伸入到烧杯中,观察小灯泡是否发光。
实验现象:
三次实验中,小灯泡均不发光
实验结论:
硝酸钾固体、氯化钠固体和蒸馏水均不导电
严格的说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
实验1-2
实验1-2
将少量硝酸钾固体和氯化钠固体加入盛有水的烧杯中,搅拌使其完全溶解转化为相应的溶液,重复上述的导电性实验,观察小灯泡是否发光。
实验现象:
两次实验中,小灯泡均发光。
实验结论:
硝酸钾溶液和氯化钠溶液和蒸馏水均导电。
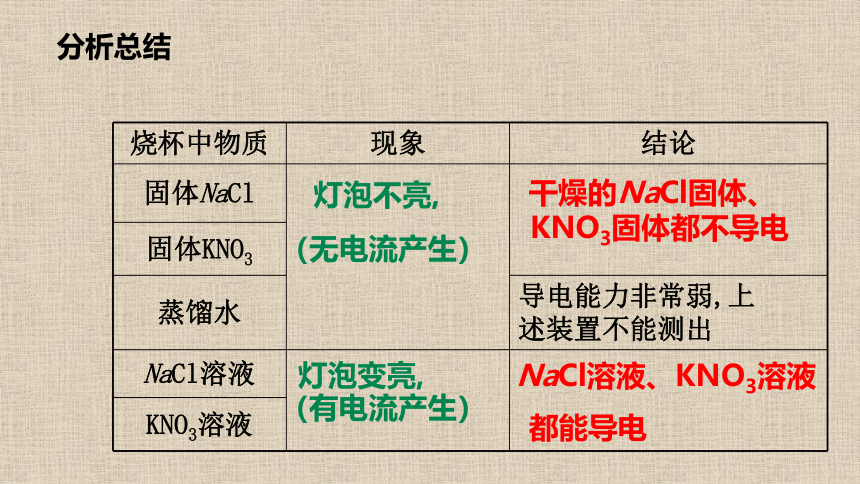
分析总结
烧杯中物质 现象 结论
固体NaCl
固体KNO3 导电能力非常弱,上
述装置不能测出
蒸馏水 NaCl溶液
KNO3溶液 灯泡不亮,
(无电流产生)
干燥的NaCl固体、
KNO3固体都不导电
灯泡变亮,
(有电流产生)
NaCl溶液、KNO3溶液
都能导电
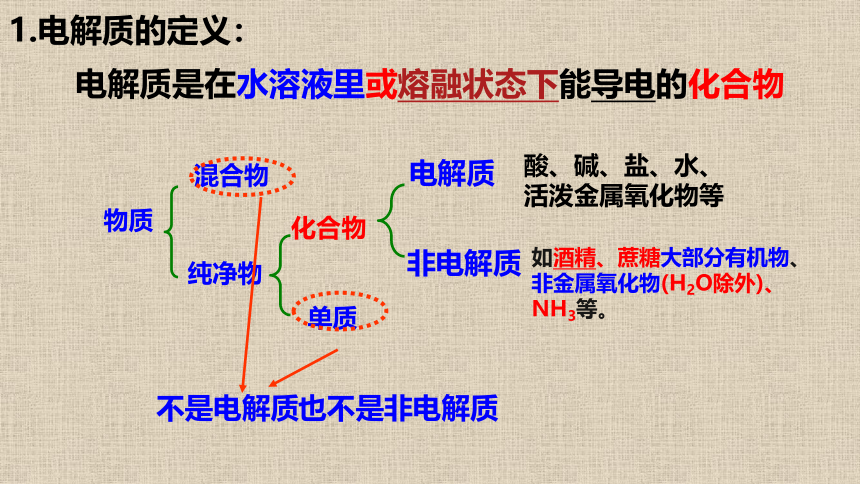
电解质是在水溶液里或熔融状态下能导电的化合物
1.电解质的定义:
物质
混合物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物等
如酒精、蔗糖大部分有机物、非金属氧化物(H2O除外)、NH3等。
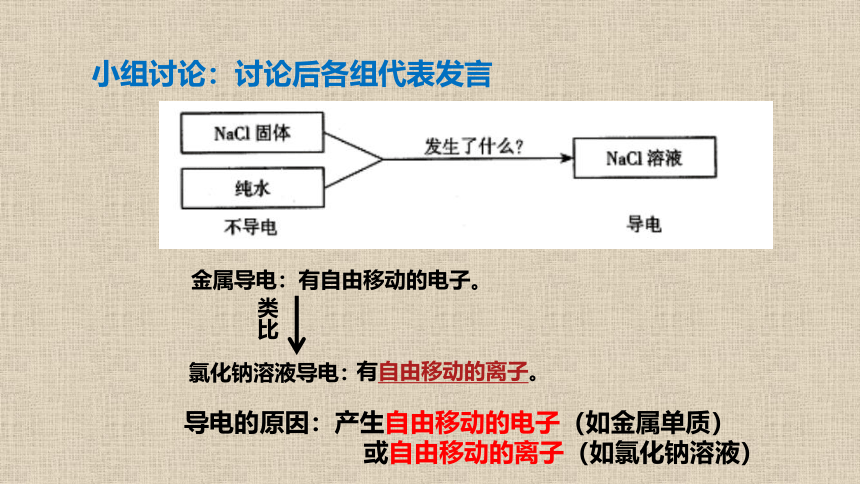
小组讨论:讨论后各组代表发言
导电的原因:产生自由移动的电子(如金属单质)
或自由移动的离子(如氯化钠溶液)
氯化钠溶液导电:
类比
有自由移动的离子。
金属导电:有自由移动的电子。
氯化钠溶于水的过程
氯化钠固体加入水中
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合钠离子与水合氯离子
氯化钠溶液导电
2.电离:电解质溶于水或受到热熔化时,形成自由移动的离子的过程
电离
3.电解质的导电条件:
状态 物质 固体 熔融(或液体) 水溶液
强碱和盐 不导电 能导电 导电(难溶物的溶液浓度小,导电能力差)
酸 不导电 不导电 导电
电解质溶液的导电能力与溶液中离子的浓度及离子所带电荷多少有关,离子浓度越大、离子所带电荷越多,溶液导电能力越强。
例:某同学做导电性实验时,向稀硫酸溶液中滴加Ba(OH)2溶液,发现灯泡明暗变化:明亮、变暗、几乎熄灭、变亮。
(1)溶液导电的原因是什么?
(2)灯泡的明暗程度与什么相关?
1)铜片和石墨能导电,它们是电解质吗?
2)稀硫酸是电解质吗?
3)CO2 ,NH3,SO3的水溶液能导电,CO2,NH3, SO3是电解质吗?
不是!本身直接电离出自由移动离子的化合物才是电解质
4)像AgCl、CaCO3 这些难溶盐 ,它们几乎不溶于水,它们是电解质吗?
不是!不是化合物!
不是!它是混合物!
是!熔融状态下可以导电!与溶解度无关!
总结:判断电解质的方法
物质
是否为化合物
非化合物
化合物
不是电解质也不是非电解质
能否水溶液或熔融状态下导电
非电解质
电解质
脑筋急转弯
4.电离方程式的书写
a.书写方法:将电解质拆分为离子。
b.表示形式:电解质=离子A+离子B+……
注:
(1)化学式的下标表示微粒数目,作为系数放在对应离子前。
(2)阴阳离子拆开写,但原子团不能拆。如:NO3-、SO42-、
OH-、NH4+、CO32-等
(3)强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根
(HCO3-、HSO3-等)不能拆。
(4)在水中电离一般不写条件,若在熔融状态必须注明。
(5)质量守恒、电荷守恒
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是H+的化合物。
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是 和 。
H+
ClO4-
书写下列物质的电离方程式:
NaOH
Ca(OH)2
NaCl
Na2SO4
NH4Cl
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
电荷守恒
原子守恒
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
特殊电离方程式书写
1.分别写出NaHSO4在水溶中和熔融状态下的电离方程式
2.写出NaHCO3和NaHSO4在水溶中的电离方程式
水溶液中:NaHSO4 = Na++H++SO42-
熔融状态:NaHSO4 (熔融) = Na++HSO4-
NaHCO3 = Na++HCO3-
NaHSO4 = Na++H++SO42-
用化学符号表示电解质电离过程的式子
电离方程式:
NaCl Na+ + Cl—
电离方程式书写要求:
①强电解质用“ ”连接
②弱电解质用“ 连接
③多元弱酸分步电离
④多元弱碱一步写完
⑤强酸酸式盐完全电离:NaHSO4
⑥弱酸酸式盐保留酸式酸根:NaHCO3、NaHS
注意: 电离方程式左右两边正负电荷之和相等。
强电解质 弱电解质
定义
物质类型
电离程度
电离过程
存在微粒
实例
方程式
水溶液或熔融全部电离
水溶液或熔融部分电离
完全电离
部分电离
阴、阳离子
阴阳离子、分子
强酸、强碱、大部分盐
弱酸、弱碱、水
可逆过程
不可逆
HF H+ +F-
NaOH Na++OH-
NaCl HCl NaOH
HF \氨水\ 水
对比填表:
第一章 物质及其变化
第二节 离子反应
第一课时 电解质的电离
夏天,出了很多汗的手不能去接触电器或擦拭电器,否则容易发生触电事故。一旦有人因接触电线发生触电事故,在取走电线时应用干燥的木杆挑走,切不可直接用手拿走。
知识源于生活
NaCl、H2O
向三个烧杯中分别加入干燥的氯化钠固体、硝酸钾固体和蒸馏水。按照图示连接装置,将石墨电极伸入到烧杯中,观察小灯泡是否发光。
实验现象:
三次实验中,小灯泡均不发光
实验结论:
硝酸钾固体、氯化钠固体和蒸馏水均不导电
严格的说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
实验1-2
实验1-2
将少量硝酸钾固体和氯化钠固体加入盛有水的烧杯中,搅拌使其完全溶解转化为相应的溶液,重复上述的导电性实验,观察小灯泡是否发光。
实验现象:
两次实验中,小灯泡均发光。
实验结论:
硝酸钾溶液和氯化钠溶液和蒸馏水均导电。
分析总结
烧杯中物质 现象 结论
固体NaCl
固体KNO3 导电能力非常弱,上
述装置不能测出
蒸馏水 NaCl溶液
KNO3溶液 灯泡不亮,
(无电流产生)
干燥的NaCl固体、
KNO3固体都不导电
灯泡变亮,
(有电流产生)
NaCl溶液、KNO3溶液
都能导电
电解质是在水溶液里或熔融状态下能导电的化合物
1.电解质的定义:
物质
混合物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物等
如酒精、蔗糖大部分有机物、非金属氧化物(H2O除外)、NH3等。
小组讨论:讨论后各组代表发言
导电的原因:产生自由移动的电子(如金属单质)
或自由移动的离子(如氯化钠溶液)
氯化钠溶液导电:
类比
有自由移动的离子。
金属导电:有自由移动的电子。
氯化钠溶于水的过程
氯化钠固体加入水中
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合钠离子与水合氯离子
氯化钠溶液导电
2.电离:电解质溶于水或受到热熔化时,形成自由移动的离子的过程
电离
3.电解质的导电条件:
状态 物质 固体 熔融(或液体) 水溶液
强碱和盐 不导电 能导电 导电(难溶物的溶液浓度小,导电能力差)
酸 不导电 不导电 导电
电解质溶液的导电能力与溶液中离子的浓度及离子所带电荷多少有关,离子浓度越大、离子所带电荷越多,溶液导电能力越强。
例:某同学做导电性实验时,向稀硫酸溶液中滴加Ba(OH)2溶液,发现灯泡明暗变化:明亮、变暗、几乎熄灭、变亮。
(1)溶液导电的原因是什么?
(2)灯泡的明暗程度与什么相关?
1)铜片和石墨能导电,它们是电解质吗?
2)稀硫酸是电解质吗?
3)CO2 ,NH3,SO3的水溶液能导电,CO2,NH3, SO3是电解质吗?
不是!本身直接电离出自由移动离子的化合物才是电解质
4)像AgCl、CaCO3 这些难溶盐 ,它们几乎不溶于水,它们是电解质吗?
不是!不是化合物!
不是!它是混合物!
是!熔融状态下可以导电!与溶解度无关!
总结:判断电解质的方法
物质
是否为化合物
非化合物
化合物
不是电解质也不是非电解质
能否水溶液或熔融状态下导电
非电解质
电解质
脑筋急转弯
4.电离方程式的书写
a.书写方法:将电解质拆分为离子。
b.表示形式:电解质=离子A+离子B+……
注:
(1)化学式的下标表示微粒数目,作为系数放在对应离子前。
(2)阴阳离子拆开写,但原子团不能拆。如:NO3-、SO42-、
OH-、NH4+、CO32-等
(3)强酸的酸式根(HSO4-)要拆开写,而弱酸的酸式根
(HCO3-、HSO3-等)不能拆。
(4)在水中电离一般不写条件,若在熔融状态必须注明。
(5)质量守恒、电荷守恒
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是H+的化合物。
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是 和 。
H+
ClO4-
书写下列物质的电离方程式:
NaOH
Ca(OH)2
NaCl
Na2SO4
NH4Cl
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
电荷守恒
原子守恒
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
特殊电离方程式书写
1.分别写出NaHSO4在水溶中和熔融状态下的电离方程式
2.写出NaHCO3和NaHSO4在水溶中的电离方程式
水溶液中:NaHSO4 = Na++H++SO42-
熔融状态:NaHSO4 (熔融) = Na++HSO4-
NaHCO3 = Na++HCO3-
NaHSO4 = Na++H++SO42-
用化学符号表示电解质电离过程的式子
电离方程式:
NaCl Na+ + Cl—
电离方程式书写要求:
①强电解质用“ ”连接
②弱电解质用“ 连接
③多元弱酸分步电离
④多元弱碱一步写完
⑤强酸酸式盐完全电离:NaHSO4
⑥弱酸酸式盐保留酸式酸根:NaHCO3、NaHS
注意: 电离方程式左右两边正负电荷之和相等。
强电解质 弱电解质
定义
物质类型
电离程度
电离过程
存在微粒
实例
方程式
水溶液或熔融全部电离
水溶液或熔融部分电离
完全电离
部分电离
阴、阳离子
阴阳离子、分子
强酸、强碱、大部分盐
弱酸、弱碱、水
可逆过程
不可逆
HF H+ +F-
NaOH Na++OH-
NaCl HCl NaOH
HF \氨水\ 水
对比填表:
