1.2.1电解质的电离课件(共18张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离课件(共18张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 17.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 10:57:29 | ||
图片预览




文档简介
(共18张PPT)
第一章 物质及其变化
第二节 离子反应
第一课时 电解质的电离
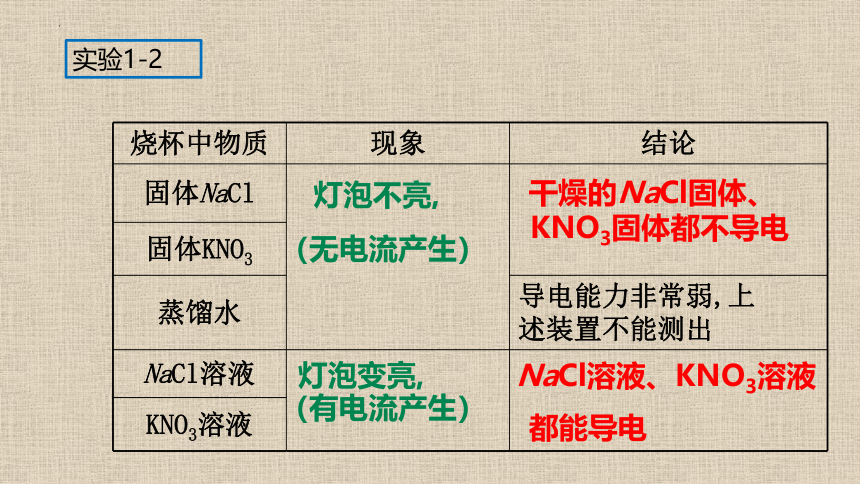
实验1-2
烧杯中物质 现象 结论
固体NaCl
固体KNO3
导电能力非常弱,上
述装置不能测出
蒸馏水
NaCl溶液
KNO3溶液
灯泡不亮,
(无电流产生)
干燥的NaCl固体、
KNO3固体都不导电
灯泡变亮,
(有电流产生)
NaCl溶液、KNO3溶液
都能导电
实验1-2
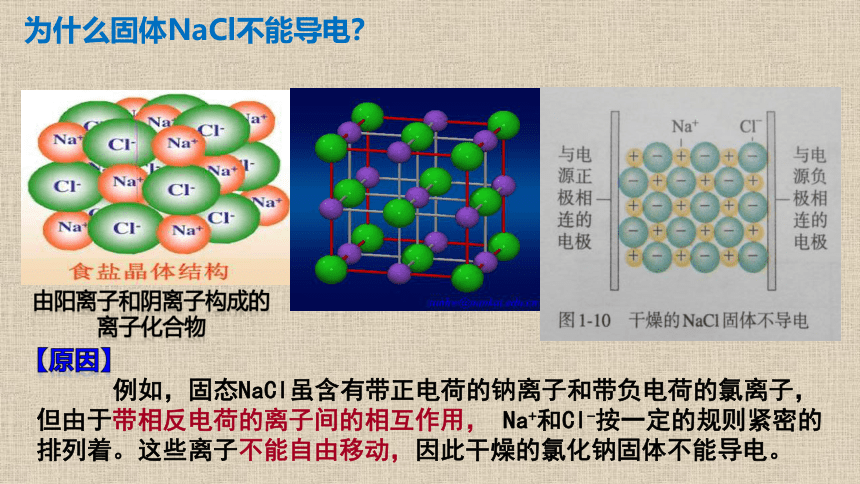
由阳离子和阴离子构成的离子化合物
例如,固态NaCl虽含有带正电荷的钠离子和带负电荷的氯离子, 但由于带相反电荷的离子间的相互作用, Na+和Cl-按一定的规则紧密的排列着。这些离子不能自由移动,因此干燥的氯化钠固体不能导电。
【原因】
为什么固体NaCl不能导电?
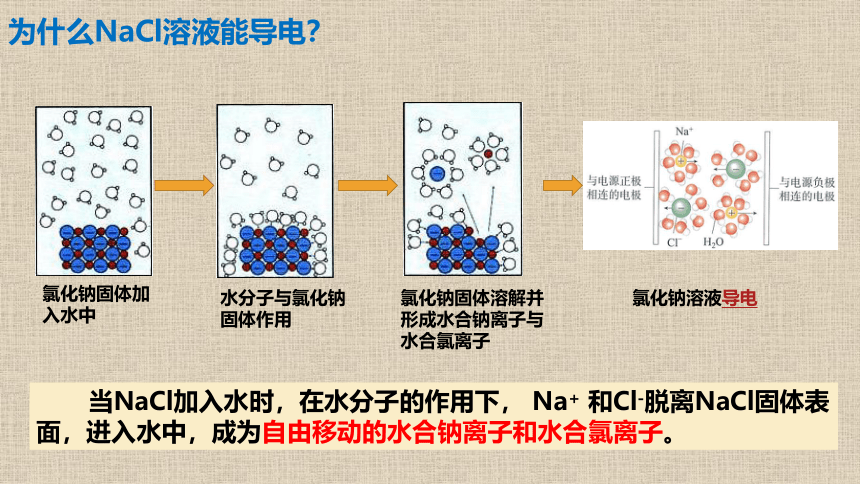
氯化钠固体加入水中
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合钠离子与水合氯离子
氯化钠溶液导电
为什么NaCl溶液能导电?
当NaCl加入水时,在水分子的作用下, Na+ 和Cl-脱离NaCl固体表面,进入水中,成为自由移动的水合钠离子和水合氯离子。
不加水,NaCl是否能导电?
熔融!
导电的原因:产生自由移动的带电粒子
氯化钠溶液导电:
类比
有自由移动的阴阳离子
金属导电:有自由移动的电子。
氯化钠固体不能导电:
无自由移动的阴阳离子存在
熔融氯化钠能导电:有自由移动的阴阳离子存在
电解质是在水溶液里或熔融状态下能导电的化合物
1.电解质的定义:
物质
混合物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物等
如乙醇、蔗糖大部分有机物、非金属氧化物(H2O除外)、NH3等。
盐酸(HCl的水溶液)、NaOH溶液、NaCl溶液等都能导电,NaCl、 KNO3、 NaOH等固体加热至熔化,也都能导电。
非电解质是在水溶液里和熔融状态下都不能导电的化合物。
1)铜片和石墨能导电,它们是电解质吗?
2)稀硫酸是电解质吗?
3)CO2 ,NH3,SO3的水溶液能导电,CO2,NH3, SO3是电解质吗?
不是!本身直接电离出自由移动离子的化合物才是电解质
4)像AgCl、CaCO3 这些难溶盐 ,它们几乎不溶于水,它们是电解质吗?
不是!不是化合物!
不是!它是混合物!
是!熔融状态下可以导电!与溶解度无关!
总结:判断电解质的方法
物质
是否为化合物
非化合物
化合物
不是电解质也不是非电解质
自身电离(水溶液/熔融状态)
非电解质
电解质
与水反应产物电离
5)液态HCl不导电,则液态HCl为非电解质
错!水溶液或熔融满足一个条件即可。
电解质
非电解质
NaCl溶液
CO2水溶液
电解质溶液
非电解质溶液
【图示】NaCl 、CO2溶于水导电分析
氯化钠溶于水的过程
氯化钠固体加入水中
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合钠离子与水合氯离子
氯化钠溶液导电
2.电离:电解质溶于水或受到热熔化时,形成自由移动的离子的过程
电离
3.电离方程式:用化学符号表示电解质电离过程的式子
a.书写方法:将电解质拆分为离子。
b.表示形式:电解质=离子A+离子B+……
注:
(1)化学式的下标表示微粒数目,作为系数放在对应离子前。
(2)阴阳离子拆开写,但原子团不能拆。如:NO3-、SO42-、
OH-、NH4+、CO32-等
(3)在水溶液中,强酸的酸式根(HSO4-)要拆开写,而弱酸
的酸式根(HCO3-、HSO3-等)不能拆。熔融状态下,酸
式盐均保留酸式酸根
(4)在水中电离一般不写条件,若在熔融状态必须注明。
(5)质量守恒(原子个数守恒)、电荷守恒
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是H+的化合物。
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是 和 。
H+
ClO4-
书写下列物质的电离方程式:
NaOH
Ca(OH)2
NaCl
Na2SO4
NH4Cl
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
电荷守恒
原子守恒
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
特殊电离方程式书写
1.分别写出NaHSO4在水溶中和熔融状态下的电离方程式
2.写出NaHCO3和NaHSO4在水溶中的电离方程式
水溶液中:NaHSO4 = Na++H++SO42-
熔融状态:NaHSO4 (熔融) = Na++HSO4-
NaHCO3 = Na++HCO3-
NaHSO4 = Na++H++SO42-
4.电解质的导电条件:
状态 物质 固体 熔融(或液体) 水溶液
强碱和盐 不导电 能导电 导电(难溶物的溶液浓度小,导电能力差)
酸 不导电 不导电 导电
电解质溶液的导电能力与溶液中离子的浓度及离子所带电荷多少有关,离子浓度越大、离子所带电荷越多,溶液导电能力越强。
例:某同学做导电性实验时,向稀硫酸溶液中滴加Ba(OH)2溶液,发现灯泡明暗变化:明亮、变暗、几乎熄灭、变亮。
(1)溶液导电的原因是什么?
(2)灯泡的明暗程度与什么相关?
第一章 物质及其变化
第二节 离子反应
第一课时 电解质的电离
实验1-2
烧杯中物质 现象 结论
固体NaCl
固体KNO3
导电能力非常弱,上
述装置不能测出
蒸馏水
NaCl溶液
KNO3溶液
灯泡不亮,
(无电流产生)
干燥的NaCl固体、
KNO3固体都不导电
灯泡变亮,
(有电流产生)
NaCl溶液、KNO3溶液
都能导电
实验1-2
由阳离子和阴离子构成的离子化合物
例如,固态NaCl虽含有带正电荷的钠离子和带负电荷的氯离子, 但由于带相反电荷的离子间的相互作用, Na+和Cl-按一定的规则紧密的排列着。这些离子不能自由移动,因此干燥的氯化钠固体不能导电。
【原因】
为什么固体NaCl不能导电?
氯化钠固体加入水中
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合钠离子与水合氯离子
氯化钠溶液导电
为什么NaCl溶液能导电?
当NaCl加入水时,在水分子的作用下, Na+ 和Cl-脱离NaCl固体表面,进入水中,成为自由移动的水合钠离子和水合氯离子。
不加水,NaCl是否能导电?
熔融!
导电的原因:产生自由移动的带电粒子
氯化钠溶液导电:
类比
有自由移动的阴阳离子
金属导电:有自由移动的电子。
氯化钠固体不能导电:
无自由移动的阴阳离子存在
熔融氯化钠能导电:有自由移动的阴阳离子存在
电解质是在水溶液里或熔融状态下能导电的化合物
1.电解质的定义:
物质
混合物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物等
如乙醇、蔗糖大部分有机物、非金属氧化物(H2O除外)、NH3等。
盐酸(HCl的水溶液)、NaOH溶液、NaCl溶液等都能导电,NaCl、 KNO3、 NaOH等固体加热至熔化,也都能导电。
非电解质是在水溶液里和熔融状态下都不能导电的化合物。
1)铜片和石墨能导电,它们是电解质吗?
2)稀硫酸是电解质吗?
3)CO2 ,NH3,SO3的水溶液能导电,CO2,NH3, SO3是电解质吗?
不是!本身直接电离出自由移动离子的化合物才是电解质
4)像AgCl、CaCO3 这些难溶盐 ,它们几乎不溶于水,它们是电解质吗?
不是!不是化合物!
不是!它是混合物!
是!熔融状态下可以导电!与溶解度无关!
总结:判断电解质的方法
物质
是否为化合物
非化合物
化合物
不是电解质也不是非电解质
自身电离(水溶液/熔融状态)
非电解质
电解质
与水反应产物电离
5)液态HCl不导电,则液态HCl为非电解质
错!水溶液或熔融满足一个条件即可。
电解质
非电解质
NaCl溶液
CO2水溶液
电解质溶液
非电解质溶液
【图示】NaCl 、CO2溶于水导电分析
氯化钠溶于水的过程
氯化钠固体加入水中
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合钠离子与水合氯离子
氯化钠溶液导电
2.电离:电解质溶于水或受到热熔化时,形成自由移动的离子的过程
电离
3.电离方程式:用化学符号表示电解质电离过程的式子
a.书写方法:将电解质拆分为离子。
b.表示形式:电解质=离子A+离子B+……
注:
(1)化学式的下标表示微粒数目,作为系数放在对应离子前。
(2)阴阳离子拆开写,但原子团不能拆。如:NO3-、SO42-、
OH-、NH4+、CO32-等
(3)在水溶液中,强酸的酸式根(HSO4-)要拆开写,而弱酸
的酸式根(HCO3-、HSO3-等)不能拆。熔融状态下,酸
式盐均保留酸式酸根
(4)在水中电离一般不写条件,若在熔融状态必须注明。
(5)质量守恒(原子个数守恒)、电荷守恒
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是H+的化合物。
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是 和 。
H+
ClO4-
书写下列物质的电离方程式:
NaOH
Ca(OH)2
NaCl
Na2SO4
NH4Cl
= Na + + OH-
= Ca2+ + 2OH-
= Na + + Cl-
= 2Na+ + SO42-
碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
电荷守恒
原子守恒
= NH4+ + Cl-
酸根离子:除OH-之外的阴离子
特殊电离方程式书写
1.分别写出NaHSO4在水溶中和熔融状态下的电离方程式
2.写出NaHCO3和NaHSO4在水溶中的电离方程式
水溶液中:NaHSO4 = Na++H++SO42-
熔融状态:NaHSO4 (熔融) = Na++HSO4-
NaHCO3 = Na++HCO3-
NaHSO4 = Na++H++SO42-
4.电解质的导电条件:
状态 物质 固体 熔融(或液体) 水溶液
强碱和盐 不导电 能导电 导电(难溶物的溶液浓度小,导电能力差)
酸 不导电 不导电 导电
电解质溶液的导电能力与溶液中离子的浓度及离子所带电荷多少有关,离子浓度越大、离子所带电荷越多,溶液导电能力越强。
例:某同学做导电性实验时,向稀硫酸溶液中滴加Ba(OH)2溶液,发现灯泡明暗变化:明亮、变暗、几乎熄灭、变亮。
(1)溶液导电的原因是什么?
(2)灯泡的明暗程度与什么相关?
