3.2.分子晶体与共价晶体课件(共23张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.分子晶体与共价晶体课件(共23张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 763.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 10:59:18 | ||
图片预览






文档简介
(共23张PPT)
第三章 晶体的结构与性质
第二节 分子晶体与共价晶体
开元学校 高二化学备课组
[学习目标]
1、了解分子晶体的结构。
2、掌握干冰、冰等典型的分子晶体的结构。(重点)
3、掌握共价晶体的结构特征和物理性质。
4、掌握金刚石、SiO2的结构和性质(重点)。
5、掌握常见的共价晶体物质类别。
[自学指导]
自学课本P78~ 84,思考下列问题:
1.什么是分子晶体?常见的分子 晶体有哪些?
2、分子晶体的结构是怎样的?
3.共价晶体的物理性质,常见的共价晶体有哪些
1、概念:
一、分子晶体
只含分子的晶体成为分子晶体。
2、构成微粒:
分子
3、 结构特征:
(1)若分子间只有范德华力,大多数晶体为分子密堆积,如CO2、C60。
分子密堆积:如果分子间作用力只是范德华力,以一个分子为中心,
其周围最多可以有12个紧邻的分子。
(2)若分子间以氢键和范德华力结合,则晶体呈现特定的空间结构,如冰。
4、常见的分子晶体
(1)所有的非金属氢化物,如H2S、H2O、NH3
(2)部分非金属单质,如I2、O2、S8 、C60、稀有气体
(3)部分非金属氧化物,如干冰、SO2、P4O6
(4)几乎所有的酸,如H2SO4、HNO3
(5)绝大多数有机物,如苯、乙醇、乙酸
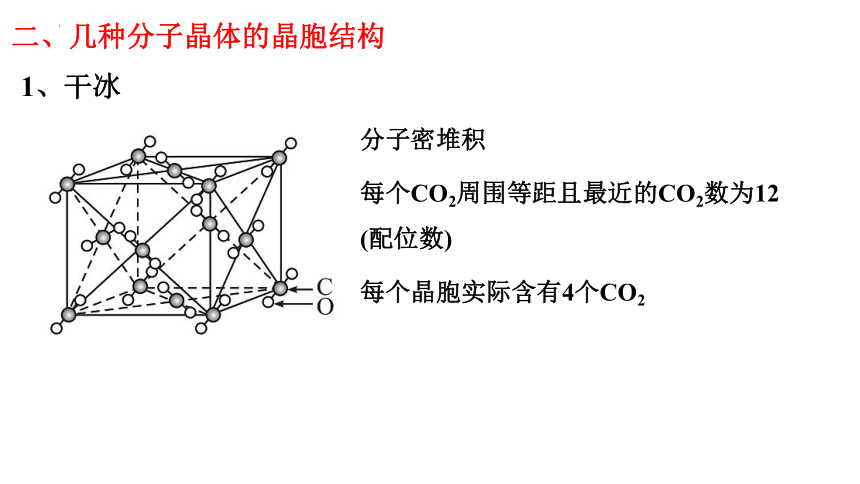
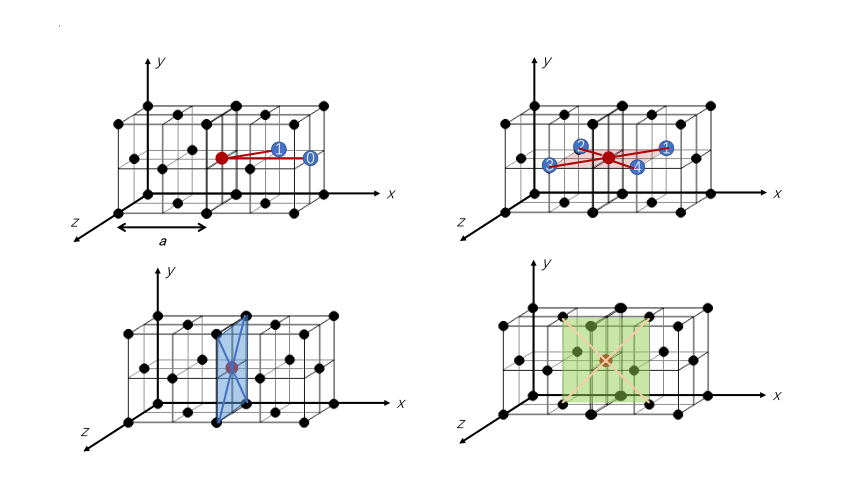
1、干冰
二、几种分子晶体的晶胞结构
分子密堆积
每个CO2周围等距且最近的CO2数为12
(配位数)
每个晶胞实际含有4个CO2
0
1
a
x
y
z
x
y
z
x
y
z
1
2
3
4
x
y
z
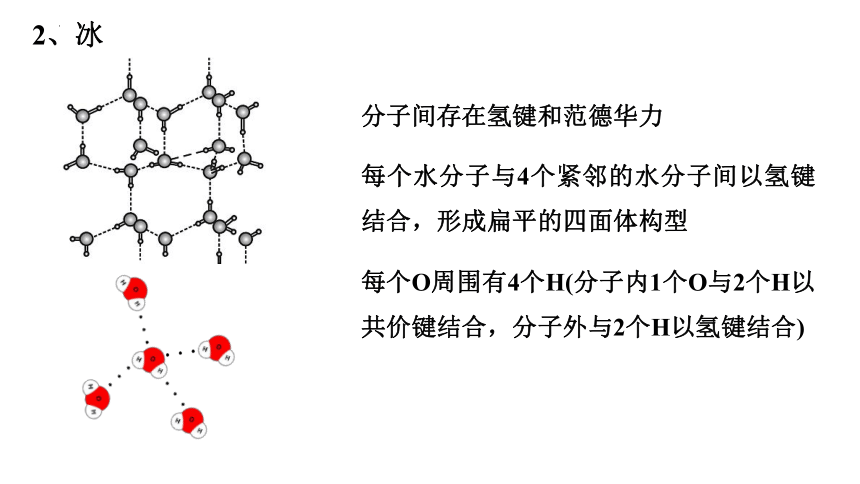
2、冰
分子间存在氢键和范德华力
每个水分子与4个紧邻的水分子间以氢键结合,形成扁平的四面体构型
每个O周围有4个H(分子内1个O与2个H以共价键结合,分子外与2个H以氢键结合)
(2)分子间作用力越大,物质的熔、沸点越高。
a、组成和结构相似的分子晶体,一般相对分子质量越大,范德华力
越大,其熔、沸点越高。如I2>Br2>Cl2>F2
(1)分子间形成氢键的分子晶体,其熔、沸点反常地高。
b、相对分子质量相似的分子晶体,分子的极性越大,其熔、沸点越高。
如CO>N2
如HF>HI>HBr>HCl
三、分子晶体的物理性质
1、熔点较低(一般不超过500℃)
2、易升华
3、硬度较小
4、固态和熔融态都不导电
注:分子晶体的状态发生改变时,只破坏分子间作用力,不破坏
分子内的共价键。
三、共价晶体
1、定义:
2、构成微粒和相互作用
共价晶体
构成微粒
原子
微粒间的作用力
共价键
相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体称为共价晶体
3、物质类别
某些单质:如金刚石(C)、硼(B) 、硅(Si)、锗(Ge)和灰锡(Sn)等
某些非金属化合物:如碳化硅(SiC)、二氧化硅(SiO2) 、氮化硅(SiN)等
[练习1] 下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
D
1、金刚石
(1)晶体结构:
在晶体中每个碳原子以 个共价
单键对称地与相邻的4个碳原子
相结合,形成 结构。
晶体中碳碳键之间的夹角为 ,碳原子采取了____杂化。
最小环上有 个碳原子,且不在同一平面。
(2)晶胞结构:一个金刚石晶胞中碳原子个数为 。
(3)共价键:金刚石中,1 mol C 形成的共价键数目是 mol
正四面体
sp3
6
8
4
109°28′
2
四、典型共价晶体的结构
2、二氧化硅
晶体结构:在二氧化硅晶体中,
1个Si原子与___个O原子相连,
Si原子位于正四面体的中心,
O原子位于四面体的顶角。每个O原子与___个Si原子相结合,硅原子和
氧原子个数比是_____,故二氧化硅的化学式为SiO2,但不存在SiO2分子。
最小的环是由___个Si原子和___个O原子组成的____元环。
(2)晶胞结构:一个二氧化硅晶胞中硅原子个数为____,氧原子个数为____。
(3) 共价键:1mol SiO2中含___mol Si-O键。
4
2
1:2
6
6
12
4
二氧化硅的晶胞
8
16
[练习2] 金刚石具有硬度大、熔点高等特点,大量用于制
造钻头、金属切割刀具等,其结构如图所示,下列
判断正确的是( )
A、金刚石中C-C的键角均为109°28′,所以
金刚石和CH4的晶体类型相同
B、金刚石的熔点高与C-C的键能无关
C、金刚石中碳原子个数与C-C数之比为1:2
D、金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
C
[练习3] 二氧化硅晶体是空间立体网状结构,如图所示,
下列关于二氧化硅晶体的说法中正确的是( )
A、 1 mol SiO2晶体中 Si-O为2 mol
B、二氧化硅晶体的分子式是SiO2
C、晶体中Si、O原子最外层电子都满足8电子结构
D、 SiO2晶体是由极性共价键与非极性共价键共同构成的
C
1、物理性质
(1)熔点高 (2)硬度大
五、共价晶体物理性质
2、熔点高低的比较规律
决定共价晶体熔点高低的因素是共价键的强度
规律:结构相似的共价晶体,若原子半径越小、键长短、键能大,
则共价键越强,晶体的熔点越高
[练习4]:判断下列物质的熔点(由高到低排序)
金刚石、晶体硅、碳化硅、晶体锗
金刚石>碳化硅>晶体硅>晶体锗
晶体的类型 分子晶体 共价晶体
概念
组成的粒子
作用力
熔点
硬度
分子晶体和共价晶体对比
小结
以分子间作用力结合
相邻原子间以共价键结合
分子
原子
分子间作用力
共价键
较低
较高
小
大
课后练习
1、下列说法正确的是 ( )
A、分子晶体中的分子间不可能存在共价键
B、分子晶体中一定有共价键
C、分子晶体中分子一定紧密堆积
D、碘升华时破坏了共价键
A
2、下列各物质的固体,属于分子晶体且分子内只含极性共
价键的是 ( )
A、干冰 B、葡萄糖
C、白磷 D、氯化铵
A
3、下列化合物,按其晶体的熔点由高到低排列正确的是( )
A、CI4> CCl4 > CBr4 > CF4
B、 CI4> CBr4 >CCl4 > CF4
C、 CF4> CCl4 > CBr4 >CI4
D、 CI4> CF4> CCl4 > CBr4
B
4、下列有关共价晶体的叙述不正确的是 ( )
A .金刚石和二氧化硅晶体的最小结构单元都是正四面体
B.含1 mol C 的金刚石中 C - C 数目是2NA,1 mol SiO2晶
体中 Si -O数目是4NA
C、水晶和干冰在熔化时,晶体中的共价键都会断裂
D、SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2
不是它的分子式中
C
5、下列对物质熔点的比较正确的是 ( )
A .F2>Cl2>Br2
B.金刚石> P4 > O2
C、S > HBr >金刚石
D、I2 > CH4 >冰
B
第三章 晶体的结构与性质
第二节 分子晶体与共价晶体
开元学校 高二化学备课组
[学习目标]
1、了解分子晶体的结构。
2、掌握干冰、冰等典型的分子晶体的结构。(重点)
3、掌握共价晶体的结构特征和物理性质。
4、掌握金刚石、SiO2的结构和性质(重点)。
5、掌握常见的共价晶体物质类别。
[自学指导]
自学课本P78~ 84,思考下列问题:
1.什么是分子晶体?常见的分子 晶体有哪些?
2、分子晶体的结构是怎样的?
3.共价晶体的物理性质,常见的共价晶体有哪些
1、概念:
一、分子晶体
只含分子的晶体成为分子晶体。
2、构成微粒:
分子
3、 结构特征:
(1)若分子间只有范德华力,大多数晶体为分子密堆积,如CO2、C60。
分子密堆积:如果分子间作用力只是范德华力,以一个分子为中心,
其周围最多可以有12个紧邻的分子。
(2)若分子间以氢键和范德华力结合,则晶体呈现特定的空间结构,如冰。
4、常见的分子晶体
(1)所有的非金属氢化物,如H2S、H2O、NH3
(2)部分非金属单质,如I2、O2、S8 、C60、稀有气体
(3)部分非金属氧化物,如干冰、SO2、P4O6
(4)几乎所有的酸,如H2SO4、HNO3
(5)绝大多数有机物,如苯、乙醇、乙酸
1、干冰
二、几种分子晶体的晶胞结构
分子密堆积
每个CO2周围等距且最近的CO2数为12
(配位数)
每个晶胞实际含有4个CO2
0
1
a
x
y
z
x
y
z
x
y
z
1
2
3
4
x
y
z
2、冰
分子间存在氢键和范德华力
每个水分子与4个紧邻的水分子间以氢键结合,形成扁平的四面体构型
每个O周围有4个H(分子内1个O与2个H以共价键结合,分子外与2个H以氢键结合)
(2)分子间作用力越大,物质的熔、沸点越高。
a、组成和结构相似的分子晶体,一般相对分子质量越大,范德华力
越大,其熔、沸点越高。如I2>Br2>Cl2>F2
(1)分子间形成氢键的分子晶体,其熔、沸点反常地高。
b、相对分子质量相似的分子晶体,分子的极性越大,其熔、沸点越高。
如CO>N2
如HF>HI>HBr>HCl
三、分子晶体的物理性质
1、熔点较低(一般不超过500℃)
2、易升华
3、硬度较小
4、固态和熔融态都不导电
注:分子晶体的状态发生改变时,只破坏分子间作用力,不破坏
分子内的共价键。
三、共价晶体
1、定义:
2、构成微粒和相互作用
共价晶体
构成微粒
原子
微粒间的作用力
共价键
相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体称为共价晶体
3、物质类别
某些单质:如金刚石(C)、硼(B) 、硅(Si)、锗(Ge)和灰锡(Sn)等
某些非金属化合物:如碳化硅(SiC)、二氧化硅(SiO2) 、氮化硅(SiN)等
[练习1] 下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
D
1、金刚石
(1)晶体结构:
在晶体中每个碳原子以 个共价
单键对称地与相邻的4个碳原子
相结合,形成 结构。
晶体中碳碳键之间的夹角为 ,碳原子采取了____杂化。
最小环上有 个碳原子,且不在同一平面。
(2)晶胞结构:一个金刚石晶胞中碳原子个数为 。
(3)共价键:金刚石中,1 mol C 形成的共价键数目是 mol
正四面体
sp3
6
8
4
109°28′
2
四、典型共价晶体的结构
2、二氧化硅
晶体结构:在二氧化硅晶体中,
1个Si原子与___个O原子相连,
Si原子位于正四面体的中心,
O原子位于四面体的顶角。每个O原子与___个Si原子相结合,硅原子和
氧原子个数比是_____,故二氧化硅的化学式为SiO2,但不存在SiO2分子。
最小的环是由___个Si原子和___个O原子组成的____元环。
(2)晶胞结构:一个二氧化硅晶胞中硅原子个数为____,氧原子个数为____。
(3) 共价键:1mol SiO2中含___mol Si-O键。
4
2
1:2
6
6
12
4
二氧化硅的晶胞
8
16
[练习2] 金刚石具有硬度大、熔点高等特点,大量用于制
造钻头、金属切割刀具等,其结构如图所示,下列
判断正确的是( )
A、金刚石中C-C的键角均为109°28′,所以
金刚石和CH4的晶体类型相同
B、金刚石的熔点高与C-C的键能无关
C、金刚石中碳原子个数与C-C数之比为1:2
D、金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
C
[练习3] 二氧化硅晶体是空间立体网状结构,如图所示,
下列关于二氧化硅晶体的说法中正确的是( )
A、 1 mol SiO2晶体中 Si-O为2 mol
B、二氧化硅晶体的分子式是SiO2
C、晶体中Si、O原子最外层电子都满足8电子结构
D、 SiO2晶体是由极性共价键与非极性共价键共同构成的
C
1、物理性质
(1)熔点高 (2)硬度大
五、共价晶体物理性质
2、熔点高低的比较规律
决定共价晶体熔点高低的因素是共价键的强度
规律:结构相似的共价晶体,若原子半径越小、键长短、键能大,
则共价键越强,晶体的熔点越高
[练习4]:判断下列物质的熔点(由高到低排序)
金刚石、晶体硅、碳化硅、晶体锗
金刚石>碳化硅>晶体硅>晶体锗
晶体的类型 分子晶体 共价晶体
概念
组成的粒子
作用力
熔点
硬度
分子晶体和共价晶体对比
小结
以分子间作用力结合
相邻原子间以共价键结合
分子
原子
分子间作用力
共价键
较低
较高
小
大
课后练习
1、下列说法正确的是 ( )
A、分子晶体中的分子间不可能存在共价键
B、分子晶体中一定有共价键
C、分子晶体中分子一定紧密堆积
D、碘升华时破坏了共价键
A
2、下列各物质的固体,属于分子晶体且分子内只含极性共
价键的是 ( )
A、干冰 B、葡萄糖
C、白磷 D、氯化铵
A
3、下列化合物,按其晶体的熔点由高到低排列正确的是( )
A、CI4> CCl4 > CBr4 > CF4
B、 CI4> CBr4 >CCl4 > CF4
C、 CF4> CCl4 > CBr4 >CI4
D、 CI4> CF4> CCl4 > CBr4
B
4、下列有关共价晶体的叙述不正确的是 ( )
A .金刚石和二氧化硅晶体的最小结构单元都是正四面体
B.含1 mol C 的金刚石中 C - C 数目是2NA,1 mol SiO2晶
体中 Si -O数目是4NA
C、水晶和干冰在熔化时,晶体中的共价键都会断裂
D、SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2
不是它的分子式中
C
5、下列对物质熔点的比较正确的是 ( )
A .F2>Cl2>Br2
B.金刚石> P4 > O2
C、S > HBr >金刚石
D、I2 > CH4 >冰
B
