2.2-2 杂化轨道理论介绍 课件(共21张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2-2 杂化轨道理论介绍 课件(共21张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 11:00:02 | ||
图片预览






文档简介
(共21张PPT)
☆ 价层电子对数=δ键电子对数+孤电子对数
δ键电子对数= 与中心原子结合的原子数
孤电子对数 = (a-xb)
a 对于原子:为中心原子的最外层电子数
(离子:a为中心原子最外层电子数减去离子电荷数)
x 为与中心原子结合的原子数
b 为与中心原子结合的原子最多能接受的电子数
(H为1,其他原子为“8-该原子的最外层电子数)
温故知新
价层电子对数 原子数 VSEPR模型 分子的立体构型
2
3 3
4
4 3
4
5
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
直线形
2.2-2 杂化轨道理论及其应用
学习目标
1、通过实例理解杂化轨道理论,会判断杂化轨道类型
2、能用杂化轨道理论解释简单分子或离子的立体构型
1
杂化轨道理论介绍
莱纳斯·卡尔·鲍林(Linus Carl Pauling,1901年2月28日-1994年8月19日),美国著名化学家,量子化学和结构生物学的先驱者之一。1954年因在化学键方面的工作取得诺贝尔化学奖,1962年因反对核弹在地面测试的行动获得诺贝尔和平奖,成为获得不同诺贝尔奖项的两人之一。
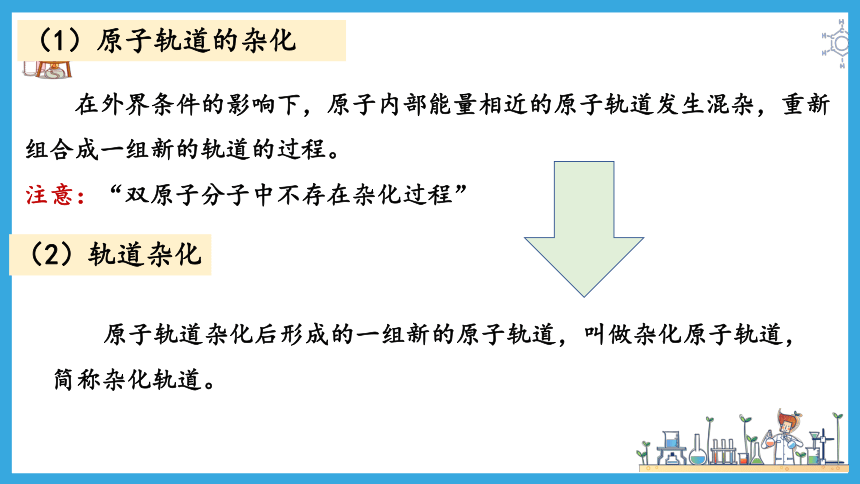
1、杂化轨道(p47)
杂化轨道理论是一种价键理论,是鲍林为了解释分子的立构构型提出的。
(1)原子轨道的杂化
在外界条件的影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
注意:“双原子分子中不存在杂化过程”
(2)轨道杂化
原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
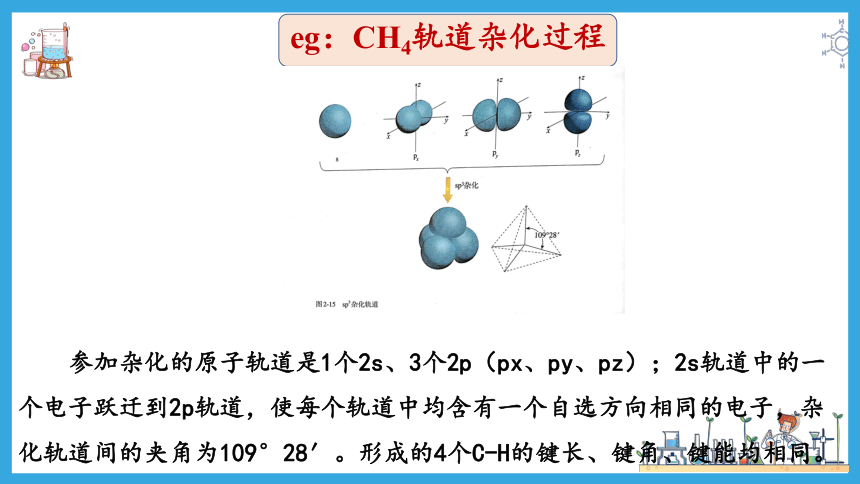
eg:CH4轨道杂化过程
参加杂化的原子轨道是1个2s、3个2p(px、py、pz);2s轨道中的一个电子跃迁到2p轨道,使每个轨道中均含有一个自选方向相同的电子,杂化轨道间的夹角为109°28′。形成的4个C-H的键长、键角、键能均相同。
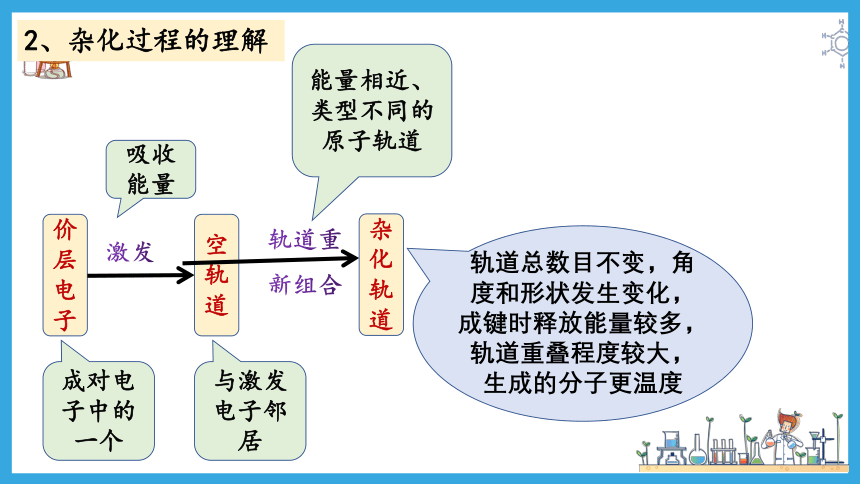
2、杂化过程的理解
价层电子
激发
空轨道
轨道重新组合
杂化轨道
成对电子中的一个
与激发电子邻居
吸收能量
能量相近、类型不同的原子轨道
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度较大,生成的分子更温度
【注意事项】
①原子形成分子时,通常存在激发态、杂化和轨道重叠等过程。
发生轨道杂化的原子一定是中心原子。
②只有能量相近的轨道才能进行杂化(eg:2s、2p)
③杂化前后原子轨道数目不变,且杂化后进行杂化的轨道能量相同
④杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。
⑤杂化轨道只用于形成σ键或孤电子对。
立体构型 杂化类型 杂化轨道数 夹角(θ) σ键总数 π键总数
乙烯
乙炔
试分析
2
分子构型与杂化类型的关系
价层电子对数 原子数 VSEPR模型 分子的立体构型
2
3 3
4
4 3
4
5
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
直线形
价层电子对数 杂化类型 VSEPR模型 分子的立体构型
2
3
4
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
直线形
sp
sp2
sp3
代表物 立体构型 中心原子杂化类型
CO2
CH2O
CH4
SO2
NH3
H2O
直线形
平面三角形
正四面体
v形
三角锥形
v形
sp杂化
sp2杂化
sp3杂化
sp2杂化
sp3杂化
sp3杂化
2
当堂训练
☆ 价层电子对数=δ键电子对数+孤电子对数
δ键电子对数= 与中心原子结合的原子数
孤电子对数 = (a-xb)
a 对于原子:为中心原子的最外层电子数
(离子:a为中心原子最外层电子数减去离子电荷数)
x 为与中心原子结合的原子数
b 为与中心原子结合的原子最多能接受的电子数
(H为1,其他原子为“8-该原子的最外层电子数)
温故知新
价层电子对数 原子数 VSEPR模型 分子的立体构型
2
3 3
4
4 3
4
5
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
直线形
2.2-2 杂化轨道理论及其应用
学习目标
1、通过实例理解杂化轨道理论,会判断杂化轨道类型
2、能用杂化轨道理论解释简单分子或离子的立体构型
1
杂化轨道理论介绍
莱纳斯·卡尔·鲍林(Linus Carl Pauling,1901年2月28日-1994年8月19日),美国著名化学家,量子化学和结构生物学的先驱者之一。1954年因在化学键方面的工作取得诺贝尔化学奖,1962年因反对核弹在地面测试的行动获得诺贝尔和平奖,成为获得不同诺贝尔奖项的两人之一。
1、杂化轨道(p47)
杂化轨道理论是一种价键理论,是鲍林为了解释分子的立构构型提出的。
(1)原子轨道的杂化
在外界条件的影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
注意:“双原子分子中不存在杂化过程”
(2)轨道杂化
原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
eg:CH4轨道杂化过程
参加杂化的原子轨道是1个2s、3个2p(px、py、pz);2s轨道中的一个电子跃迁到2p轨道,使每个轨道中均含有一个自选方向相同的电子,杂化轨道间的夹角为109°28′。形成的4个C-H的键长、键角、键能均相同。
2、杂化过程的理解
价层电子
激发
空轨道
轨道重新组合
杂化轨道
成对电子中的一个
与激发电子邻居
吸收能量
能量相近、类型不同的原子轨道
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度较大,生成的分子更温度
【注意事项】
①原子形成分子时,通常存在激发态、杂化和轨道重叠等过程。
发生轨道杂化的原子一定是中心原子。
②只有能量相近的轨道才能进行杂化(eg:2s、2p)
③杂化前后原子轨道数目不变,且杂化后进行杂化的轨道能量相同
④杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。
⑤杂化轨道只用于形成σ键或孤电子对。
立体构型 杂化类型 杂化轨道数 夹角(θ) σ键总数 π键总数
乙烯
乙炔
试分析
2
分子构型与杂化类型的关系
价层电子对数 原子数 VSEPR模型 分子的立体构型
2
3 3
4
4 3
4
5
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
直线形
价层电子对数 杂化类型 VSEPR模型 分子的立体构型
2
3
4
直线形
平面三角形
四面体形
V形
平面三角形
V形
三角锥形
四面体形
直线形
sp
sp2
sp3
代表物 立体构型 中心原子杂化类型
CO2
CH2O
CH4
SO2
NH3
H2O
直线形
平面三角形
正四面体
v形
三角锥形
v形
sp杂化
sp2杂化
sp3杂化
sp2杂化
sp3杂化
sp3杂化
2
当堂训练
