第五章化工生产中的重要非金属元素单元复习提升课件(共33张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章化工生产中的重要非金属元素单元复习提升课件(共33张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
2019人教版第二册
第五章化工生产中的重要非金属元素
章 末 复 习 提 升
1.了解硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。
2.了解氨气的实验室制法,进一步掌握气体制备的思路及其常见的实验装置。
3.理解喷泉实验,掌握喷泉实验实验的原理及实际应用。
4.了解无机非金属材料的性能及应用。
5.掌握硝酸与金属反应的相关计算原理和技巧。
重点难点
1. 硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。
2.氨气的实验室制法及喷泉实验原理和应用。
学习目标
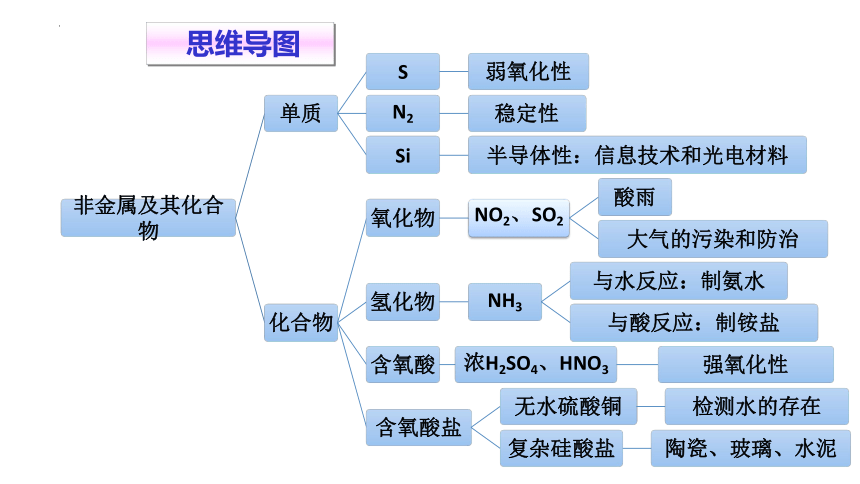
思维导图
知识梳理
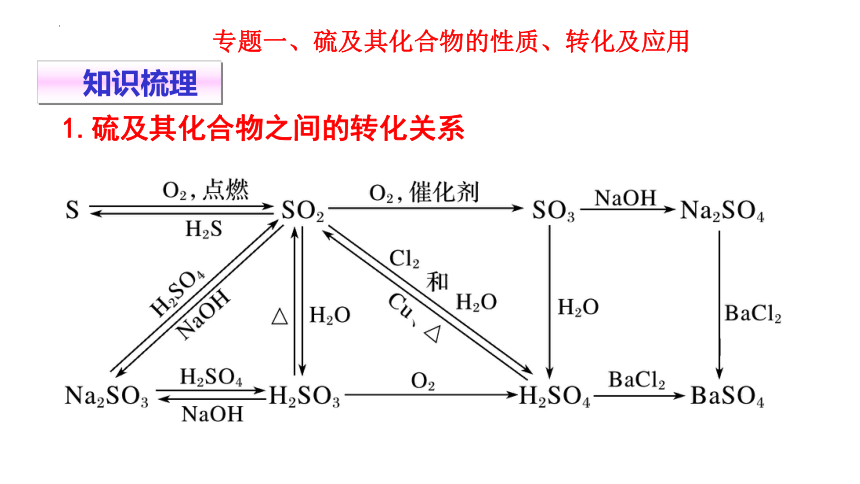
专题一、硫及其化合物的性质、转化及应用
1.硫及其化合物之间的转化关系
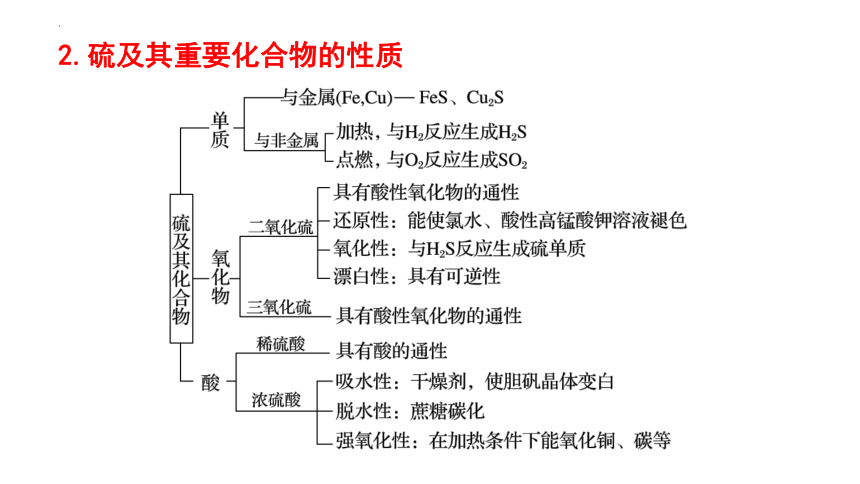
2.硫及其重要化合物的性质
例1 下列变化可以说明SO2具有漂白性的是( )
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
1)二氧化硫的漂白性和还原性
3.硫及其重要化合物重点专题突破
专题突破
易错解析
SO2不能使酸碱指示剂褪色;SO2能使品红溶液褪色,是因为其具有漂白性;SO2使KMnO4溶液、溴水褪色,是因为发生了氧化还原反应;SO2能使滴有酚酞的NaOH溶液褪色,是因为其是酸性氧化物。故选C
例2 等物质的量的SO2、Cl2通入水中,所得的溶液( )
A.具有中性、漂白性 B.具有酸性、漂白性
C.只有漂白性 D.只有酸性
SO2和氯水都有漂白作用,但是将等物质的量的SO2和Cl2同时通入同一品红溶液中,会发生反应SO2+Cl2+2H2O====H2SO4+2HCl,失去漂白能力,品红溶液不褪色,所得溶液为酸性。故选D
归纳总结
易错解析
2)二氧化硫和二氧化碳的比较与鉴别
例3 下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
A.①⑤ B.③④⑤ C.②⑥ D.②③④⑥
(1)二氧化硫具有漂白性,若将二者分别通入品红溶液中,能使品红溶液褪色的是二氧化硫,不能褪色的是二氧化碳。
(2)二氧化硫具有强还原性,若将二者分别通入溴水中,能使溴水褪色的是二氧化硫,不能褪色的是二氧化碳。
(3)二者都能使澄清石灰水变浑浊,过量时溶液又变澄清,所以不能用澄清石灰水鉴别二氧化硫和二氧化碳。
(4)二者通入氯化钡溶液中没有明显变化。
(5)二氧化硫与硫化氢有淡黄色沉淀生产。
故选D
易错解析
二氧
化硫
和
二氧
化碳
的
鉴别
方法
易错解析
SO2和CO2都是酸性氧化物,既有共同的性质又有差异,鉴别要应用它们性质上差异来区分, SO2有不同于CO2 的一些特性;SO2能使品红溶液褪色,使KMnO4溶液、溴水褪色,故先检验SO2,且确保SO2完全除尽,再检验CO2,故采用下列试剂及装置进行。
例4 :如何检验某混合气体中含有SO2和CO2?
SO2、CO2
澄清
石灰水
品红溶液
KMnO4
溶液
品红溶液
NaOH溶液
褪色 褪色 不褪色
先浑浊
后澄清
1.氮及其化合物之间的转化关系
知识梳理
专题二、硫及其化合物的性质、转化及应用
2.氮及其重要化合物的性质
1)喷泉实验的原理与判断
例5 如图是喷泉实验装置图,下列说法正确的是()
A.烧瓶中的溶液呈红色,则原气体一定是SO2
B.形成喷泉的原因是烧瓶内压强大于外界大气压
C.烧瓶中的溶液呈蓝色,则原气体一定属于碱性气体
D.若将石蕊溶液改成氢氧化钠溶液,则CO、CO2均能
形成喷泉
专题突破
3.氮及其重要化合物重点专题突破
(1)喷泉实验的原理
烧瓶内外形成较大的压强差。少量水可快速溶解大量的气体使烧瓶内压强迅速减小,外界大气压将烧杯中的水压入上面的烧瓶内,形成美丽的喷泉。
易错解析
(2)能形成喷泉的气体
①易溶于水的气体(如NH3、HCl、HBr等)均可用来做喷泉实验。
②在碱液中溶解度较大的气体(如CO2、H2S、Cl2等)也可以用来做喷泉实验。
故选C
例6 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管,下列与实验事实不相符的是( )
A.CO2(浓NaOH溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.SO2(浓NaOH溶液)/红色喷泉
D.HCl(AgNO3溶液)/白色喷泉
解析:易溶于水的气体或在碱液、酸液中溶解度较大的气体都可以形成喷泉,由于反应生成不同物质或加不同的指示剂,而形成不同颜色的喷泉,C向形成无色喷泉,故选C
2)“三酸变稀”对其反应的影响
例7 用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.50 mL 18.4 mol·L-1的浓硫酸与足量的铜在加热条件下反应,生成SO2分子的数目为0.46NA
B.3.2 g Cu与足量浓硝酸反应生成的气体为0.1 mol
C.在标准状况下,含4 mol HCl的浓盐酸与足量的MnO2反应可生成22.4 L氯气
D.1 mol Cu在加热条件下与足量浓硫酸反应产生1 mol SO2
典型的“三酸变稀”问题是指浓盐酸与二氧化锰反应、浓硫酸与铜、锌等反应、浓硝酸与铜等反应,随着反应的进行,三种酸都变稀,从而使反应停止或产物发生变化。
A项浓硫酸量一定,随着反应的进行浓硫酸浓度变稀,反应会停止,生成二氧化硫的物质的量小于0.46 mol。
B项理论上3.2克铜与足量的浓硝酸反应可以生成0.1mol二氧化氮,氮因为可逆反应2NO2 N2O4存在,不可能生成纯净的二氧化氮。
C项含4 mol HCl的浓盐酸与足量的MnO2若完全反应可生成22.4 L氯气,但实际上随着反应的进行浓盐酸浓度变稀,反应会停止。
故选D
易错解析
例8 化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是( )
A.铁片与过量浓硝酸(常温) B.铜粉与过量浓硝酸(常温)
C.浓盐酸与过量二氧化锰(共热) D.浓硫酸与过量铜片(共热)
解析:A项常温下铁片与过量浓硝酸发生钝化,铁不可能完全反应。C项浓盐酸与足量的MnO2反应随着反应的进行浓盐酸浓度变稀,反应会停止.D项随着反应的进行浓硫酸浓度变稀,反应会停止。故选B.
3)NO3-在离子共存判断中的特殊性
例9 下列各组离子,在指定溶液中一定能大量共存的是( )
A.在酸性溶液中:Na+、Ba2+、NO3-、CO32-
B.在酸性溶液中:NH、Fe2+、SO42-、NO3-
C.在pH>7的溶液中:Na+、K+、NO3-、Cl-
D.常温下,在pH为7的溶液中:Ag+、K+、SO42-、Cl-
NO3-在中性或碱性溶液中无强氧化性,而在酸性溶液中(相当于HNO3)具有强氧化性,在离子共存判断、物质推断及检验时,注意挖掘题目中的隐含信息。
A项酸性溶液中CO32-不能存在。
B项酸性溶液中Fe2+、NO3-不能存在
D项常温下,在pH为7的溶液中:Ag+、SO42-不能共存
故选C.
易错解析
例10 在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3
A.只有①② B.只有②④ C.只有①②③ D.①②③④
解析:A、B项有+3铁离子生成,其与铜会发生反应。
C、D项含有H-和NO3-,相当于含有硝酸,可与铜反应。
故选D.
4)硝酸与金属反应的计算
(1)原子守恒:n(参加反应的HNO3)=n(硝酸盐中的NO3-)+n(还原产物中的N原子)=n(被氧化的硝酸)+2n(Cu2+)
金属与硝酸反应时,常用守恒法确定硝酸与金属量的关系
②电子得失守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属电子的物质的量。
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
③电荷守恒法
④利用离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3- 在H2SO4 提供H+的条件下能继续与金属反应,因此,此类题目应用离子方程式来计算。
先作过量判断,然后根据完全反应的金属或H+或 NO3- 进行相关计算,且溶液中要符合电荷守恒。
例11 1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为 ( )
A.2.4g B.3.2g
C. 6.4g D.9.6g
解析:n(H+)=0.1+0.8=0.9(mol)
n(NO3-)=0.1mol
3Cu + 8H+ + 2NO3-=3Cu2++2NO↑+4H2O
3mol 8mol 2mol
0.9mol 0.1mol
NO3-不足,溶解n(Cu)=0.15mol;m(Cu)=9.6(g)
B
例12 足量的铜和含有2.4×10-3 mol硝酸的某浓硝酸完全反应,共收集到标准状况下气体22.4 mL。参加反应的铜的质量是( )
A.38.4×10-3 g B.44.8×10-3 g
C.48.3×10-3 g D.57.6×10-3 g
解析:2n(Cu) ==2n(Cu2+)
n(被氧化的硝酸)
==n(参加反应的HNO3)--
== 2.4×10-3--1×10-3==1.4×10-3
m(Cu)==
1.4×10-3x64g/mol==44.8×10-3 g
故选B
专题 三
无机非金属材料
例13 元素化合物的知识在社会生产、生活、环境中都有很大的应用。A、B、C、D、E均为中学化学常见的纯净物,A是单质。它们之间有如下的转化关系:
(1)若B是一种碱性气体,D是一种红棕色气体,据此回答下列问题:
①C、D两种化合物能引起的环境问题是________。
A.光化学烟雾 B.能源短缺
C.酸雨 D.温室效应
②C是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用B把C还原为A和水,则该反应的化学方程式是_____________________。
每有10 mol A生成,转移电子的物质的量为________。
③实验室制取B的化学方程式是______________________________。
(2)若B是一种臭鸡蛋气味的气体,A是一种淡黄色的固体单质,E是工业生产中一种重要的化合物,据此回答下列问题:
①B和C可以发生反应生成A,写出该反应的化学方程式:_____________。
②金属铜投入E的稀溶液中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式:____________________。
2019人教版第二册
第五章化工生产中的重要非金属元素
章 末 复 习 提 升
1.了解硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。
2.了解氨气的实验室制法,进一步掌握气体制备的思路及其常见的实验装置。
3.理解喷泉实验,掌握喷泉实验实验的原理及实际应用。
4.了解无机非金属材料的性能及应用。
5.掌握硝酸与金属反应的相关计算原理和技巧。
重点难点
1. 硫、氮及其化合物的性质,理解其相互之间的转化关系,会写常见的化学方程式。
2.氨气的实验室制法及喷泉实验原理和应用。
学习目标
思维导图
知识梳理
专题一、硫及其化合物的性质、转化及应用
1.硫及其化合物之间的转化关系
2.硫及其重要化合物的性质
例1 下列变化可以说明SO2具有漂白性的是( )
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
1)二氧化硫的漂白性和还原性
3.硫及其重要化合物重点专题突破
专题突破
易错解析
SO2不能使酸碱指示剂褪色;SO2能使品红溶液褪色,是因为其具有漂白性;SO2使KMnO4溶液、溴水褪色,是因为发生了氧化还原反应;SO2能使滴有酚酞的NaOH溶液褪色,是因为其是酸性氧化物。故选C
例2 等物质的量的SO2、Cl2通入水中,所得的溶液( )
A.具有中性、漂白性 B.具有酸性、漂白性
C.只有漂白性 D.只有酸性
SO2和氯水都有漂白作用,但是将等物质的量的SO2和Cl2同时通入同一品红溶液中,会发生反应SO2+Cl2+2H2O====H2SO4+2HCl,失去漂白能力,品红溶液不褪色,所得溶液为酸性。故选D
归纳总结
易错解析
2)二氧化硫和二氧化碳的比较与鉴别
例3 下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
A.①⑤ B.③④⑤ C.②⑥ D.②③④⑥
(1)二氧化硫具有漂白性,若将二者分别通入品红溶液中,能使品红溶液褪色的是二氧化硫,不能褪色的是二氧化碳。
(2)二氧化硫具有强还原性,若将二者分别通入溴水中,能使溴水褪色的是二氧化硫,不能褪色的是二氧化碳。
(3)二者都能使澄清石灰水变浑浊,过量时溶液又变澄清,所以不能用澄清石灰水鉴别二氧化硫和二氧化碳。
(4)二者通入氯化钡溶液中没有明显变化。
(5)二氧化硫与硫化氢有淡黄色沉淀生产。
故选D
易错解析
二氧
化硫
和
二氧
化碳
的
鉴别
方法
易错解析
SO2和CO2都是酸性氧化物,既有共同的性质又有差异,鉴别要应用它们性质上差异来区分, SO2有不同于CO2 的一些特性;SO2能使品红溶液褪色,使KMnO4溶液、溴水褪色,故先检验SO2,且确保SO2完全除尽,再检验CO2,故采用下列试剂及装置进行。
例4 :如何检验某混合气体中含有SO2和CO2?
SO2、CO2
澄清
石灰水
品红溶液
KMnO4
溶液
品红溶液
NaOH溶液
褪色 褪色 不褪色
先浑浊
后澄清
1.氮及其化合物之间的转化关系
知识梳理
专题二、硫及其化合物的性质、转化及应用
2.氮及其重要化合物的性质
1)喷泉实验的原理与判断
例5 如图是喷泉实验装置图,下列说法正确的是()
A.烧瓶中的溶液呈红色,则原气体一定是SO2
B.形成喷泉的原因是烧瓶内压强大于外界大气压
C.烧瓶中的溶液呈蓝色,则原气体一定属于碱性气体
D.若将石蕊溶液改成氢氧化钠溶液,则CO、CO2均能
形成喷泉
专题突破
3.氮及其重要化合物重点专题突破
(1)喷泉实验的原理
烧瓶内外形成较大的压强差。少量水可快速溶解大量的气体使烧瓶内压强迅速减小,外界大气压将烧杯中的水压入上面的烧瓶内,形成美丽的喷泉。
易错解析
(2)能形成喷泉的气体
①易溶于水的气体(如NH3、HCl、HBr等)均可用来做喷泉实验。
②在碱液中溶解度较大的气体(如CO2、H2S、Cl2等)也可以用来做喷泉实验。
故选C
例6 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管,下列与实验事实不相符的是( )
A.CO2(浓NaOH溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.SO2(浓NaOH溶液)/红色喷泉
D.HCl(AgNO3溶液)/白色喷泉
解析:易溶于水的气体或在碱液、酸液中溶解度较大的气体都可以形成喷泉,由于反应生成不同物质或加不同的指示剂,而形成不同颜色的喷泉,C向形成无色喷泉,故选C
2)“三酸变稀”对其反应的影响
例7 用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.50 mL 18.4 mol·L-1的浓硫酸与足量的铜在加热条件下反应,生成SO2分子的数目为0.46NA
B.3.2 g Cu与足量浓硝酸反应生成的气体为0.1 mol
C.在标准状况下,含4 mol HCl的浓盐酸与足量的MnO2反应可生成22.4 L氯气
D.1 mol Cu在加热条件下与足量浓硫酸反应产生1 mol SO2
典型的“三酸变稀”问题是指浓盐酸与二氧化锰反应、浓硫酸与铜、锌等反应、浓硝酸与铜等反应,随着反应的进行,三种酸都变稀,从而使反应停止或产物发生变化。
A项浓硫酸量一定,随着反应的进行浓硫酸浓度变稀,反应会停止,生成二氧化硫的物质的量小于0.46 mol。
B项理论上3.2克铜与足量的浓硝酸反应可以生成0.1mol二氧化氮,氮因为可逆反应2NO2 N2O4存在,不可能生成纯净的二氧化氮。
C项含4 mol HCl的浓盐酸与足量的MnO2若完全反应可生成22.4 L氯气,但实际上随着反应的进行浓盐酸浓度变稀,反应会停止。
故选D
易错解析
例8 化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是( )
A.铁片与过量浓硝酸(常温) B.铜粉与过量浓硝酸(常温)
C.浓盐酸与过量二氧化锰(共热) D.浓硫酸与过量铜片(共热)
解析:A项常温下铁片与过量浓硝酸发生钝化,铁不可能完全反应。C项浓盐酸与足量的MnO2反应随着反应的进行浓盐酸浓度变稀,反应会停止.D项随着反应的进行浓硫酸浓度变稀,反应会停止。故选B.
3)NO3-在离子共存判断中的特殊性
例9 下列各组离子,在指定溶液中一定能大量共存的是( )
A.在酸性溶液中:Na+、Ba2+、NO3-、CO32-
B.在酸性溶液中:NH、Fe2+、SO42-、NO3-
C.在pH>7的溶液中:Na+、K+、NO3-、Cl-
D.常温下,在pH为7的溶液中:Ag+、K+、SO42-、Cl-
NO3-在中性或碱性溶液中无强氧化性,而在酸性溶液中(相当于HNO3)具有强氧化性,在离子共存判断、物质推断及检验时,注意挖掘题目中的隐含信息。
A项酸性溶液中CO32-不能存在。
B项酸性溶液中Fe2+、NO3-不能存在
D项常温下,在pH为7的溶液中:Ag+、SO42-不能共存
故选C.
易错解析
例10 在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3
A.只有①② B.只有②④ C.只有①②③ D.①②③④
解析:A、B项有+3铁离子生成,其与铜会发生反应。
C、D项含有H-和NO3-,相当于含有硝酸,可与铜反应。
故选D.
4)硝酸与金属反应的计算
(1)原子守恒:n(参加反应的HNO3)=n(硝酸盐中的NO3-)+n(还原产物中的N原子)=n(被氧化的硝酸)+2n(Cu2+)
金属与硝酸反应时,常用守恒法确定硝酸与金属量的关系
②电子得失守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属电子的物质的量。
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
③电荷守恒法
④利用离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3- 在H2SO4 提供H+的条件下能继续与金属反应,因此,此类题目应用离子方程式来计算。
先作过量判断,然后根据完全反应的金属或H+或 NO3- 进行相关计算,且溶液中要符合电荷守恒。
例11 1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为 ( )
A.2.4g B.3.2g
C. 6.4g D.9.6g
解析:n(H+)=0.1+0.8=0.9(mol)
n(NO3-)=0.1mol
3Cu + 8H+ + 2NO3-=3Cu2++2NO↑+4H2O
3mol 8mol 2mol
0.9mol 0.1mol
NO3-不足,溶解n(Cu)=0.15mol;m(Cu)=9.6(g)
B
例12 足量的铜和含有2.4×10-3 mol硝酸的某浓硝酸完全反应,共收集到标准状况下气体22.4 mL。参加反应的铜的质量是( )
A.38.4×10-3 g B.44.8×10-3 g
C.48.3×10-3 g D.57.6×10-3 g
解析:2n(Cu) ==2n(Cu2+)
n(被氧化的硝酸)
==n(参加反应的HNO3)--
== 2.4×10-3--1×10-3==1.4×10-3
m(Cu)==
1.4×10-3x64g/mol==44.8×10-3 g
故选B
专题 三
无机非金属材料
例13 元素化合物的知识在社会生产、生活、环境中都有很大的应用。A、B、C、D、E均为中学化学常见的纯净物,A是单质。它们之间有如下的转化关系:
(1)若B是一种碱性气体,D是一种红棕色气体,据此回答下列问题:
①C、D两种化合物能引起的环境问题是________。
A.光化学烟雾 B.能源短缺
C.酸雨 D.温室效应
②C是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用B把C还原为A和水,则该反应的化学方程式是_____________________。
每有10 mol A生成,转移电子的物质的量为________。
③实验室制取B的化学方程式是______________________________。
(2)若B是一种臭鸡蛋气味的气体,A是一种淡黄色的固体单质,E是工业生产中一种重要的化合物,据此回答下列问题:
①B和C可以发生反应生成A,写出该反应的化学方程式:_____________。
②金属铜投入E的稀溶液中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式:____________________。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
