内蒙古包头市2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 内蒙古包头市2022-2023学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 11:13:58 | ||
图片预览


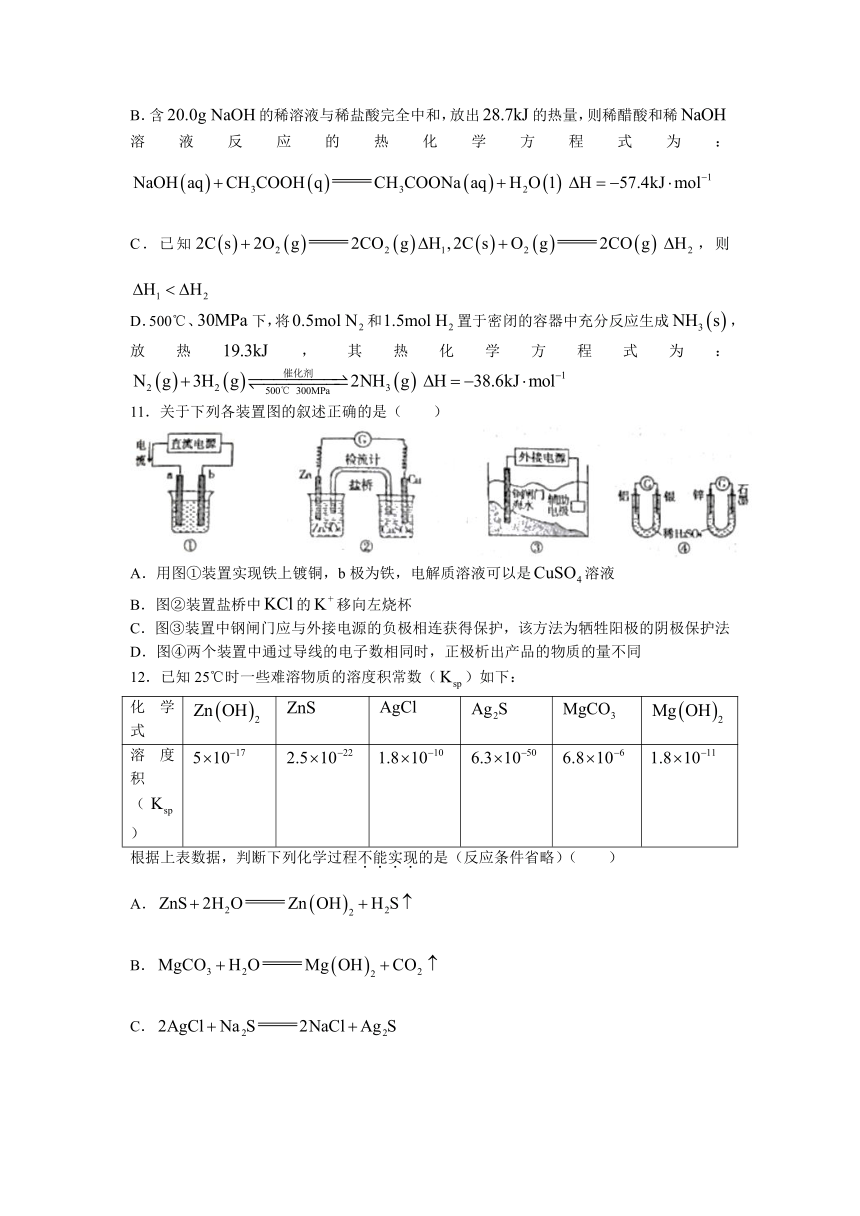


文档简介
绝密★启用前
包头市2022-2023学年高二上学期期末考试
化学
注意事项:
1.考生答卷的,务必将自己的姓名、座位号写在答题卡上.将条形码粘贴在规定区域本试卷满分100分,考试时间90分钟.
2.做选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选除其他答案标号.写在本试卷上无效.
3.回答非选择题时,将答案写在答题卡的规定区域内,写在本试卷上无效.
4.考试结束后,将答题卡交回.
可能用到的相对原子质量:H 1 C 12 Fe 56 Cu 64 Zn 65 Cr 52
一、选择题(本题共18小题,每小题3分,共54分.每小题只有一个项符合题目要求)
1.化学与社会生活密切相关.下列叙述中,不能用勒夏特列原理解释的是( )
A.食品包装中加抗氧化剂利于延长保质期 B.用排饱和食盐水法收集氯气
C.用浓氨水和氧化钙固体快速制取氨气 D.用热的纯碱溶液洗去油污效果更好
2.下列离子方程式属于盐类的水解,且书写正确的是( )
A. B.
C. D.
3.合成氯反应为:,其反应速率可以分别用表示,反应达平衡时,下列关系式正确的是( )
A. B.
C. D.
4.能促进水的电离平衡,并使溶液中的的操作是( )
A.将水加热煮沸 B.向水中通入
C.向水中滴加溶液 D.将固体溶于水
5.常温下,下列各组离子在指定条件下一定能大量共存的是( )
A.含有的溶液中:
B.能使甲基橙试剂变红的溶液中:
C.的溶液中:
D.水电离出的的溶液中:
6.下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.在常温下能自发进行,则该反应的
C.加热溶液,的水解程度和溶液的均增大(忽略的变化)
D.对于乙酸与乙醇的酯化反应(),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
7.下列用来表示物质变化的化学用语中,正确的是( )
A.析氢腐蚀和吸氧腐蚀,负极反应均是:
B.燃料电池,负极的电极反应式为
C.铅酸蓄电池放电时正极的反应式:
D.用惰性电极电解饱和食盐水时,阴极的电极反应式为:
8.常温下,下列事实不能说明是弱碱的是( )
A.溶液与等体积恰好完全反应
B.溶液中
C.将的溶液稀释10倍,测得
D.一定浓度的溶液中:
9.某同学设计如图所示实验,探究反应中的能量变化.
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铜质搅拌器,测定中和热数值偏低
D.实验(c)记录终止温度时,需等待温度计示数稳定后再读数
10.下列说法正确的是( )
A.的燃烧热,则
B.含的稀溶液与稀盐酸完全中和,放出的热量,则稀醋酸和稀溶液反应的热化学方程式为:
C.已知,则
D.500℃、下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:
11.关于下列各装置图的叙述正确的是( )
A.用图①装置实现铁上镀铜,b极为铁,电解质溶液可以是溶液
B.图②装置盐桥中的移向左烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护,该方法为牺牲阳极的阴极保护法
D.图④两个装置中通过导线的电子数相同时,正极析出产品的物质的量不同
12.已知25℃时一些难溶物质的溶度积常数()如下:
化学式
溶度积()
根据上表数据,判断下列化学过程不能实现的是(反应条件省略)( )
A.
B.
C.
D.
13.与的反应分两步完成,其能量曲线如图所示.反应①:,反应②:,下列有关说法错( )
A.反应①决定该反应的反应速率
B.为该反应的催化剂
C.
D.温度升高,活化分子百分数增大,有效碰撞概率增大,反应速率加快
14.温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:;,容器中A、B、D的物质的量浓度随时间的变化如图所示.
下列说法正确的是( )
A.反应在前的平均反应速率
B.该反应的平衡常数表达式
C.若平衡时保持温度不变,压缩容器体积平衡逆向移动
D.反应至时,改变的条件是降低湿度
15.在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响.下列有关说法正确的是( )
A.草酸的电离方程式为
B.草酸溶液中:
C.常温下,将草酸溶液加水稀释,溶液中所有离子的浓度均减小
D.已知溶液显酸性,则
16.将溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
A.液滴中的由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:
C.装滴下的因发生还原反应而被腐蚀,生成的由a区向b区迁移,与b区的形成,进一步氧化,脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加溶液,则负极发生的电极反应为
17.环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶,塑料等生产,在储存时容易发生聚合生成二聚体:不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法错误的是( )
A.,该反应的 B.平衡常数,
C.a点的正反应速率大于b点的逆反应速率 D.b点时环戊二烯的转化率为40%
18.常温下,用溶液分别滴定浓度均为的溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解).下列叙述正确的是( )
A.的数量级等于
B.n点表示的不饱和溶液
C.向的混合液中滴入溶液时,先生成沉淀
D.的平衡常数为
二、填空题(共46分)
19.酸、碱、盐都是电解质,常温下,有以下电解质溶液:
① ② ③ ④ ⑤ ⑥ ⑦
已知:的电离常数
(1)用化学用语解释④呈酸性的原因:__________________________
(2)的溶液①中由水电离出的为_____________________________
(3)浓度均为的上述7种溶液, 由大到小为______________________________
(4)在⑥溶液中下列关系成立的是______________________________
A.
B.
C.
D.
(5)若某浓度的⑥和⑦的混合溶液中,该溶液的______________
(6)将的①溶液与的③溶液混合,若所得混合溶液的,则①和②溶液的体积比为____________
20.酸碱中和滴定是一种重要的实验方法,用溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.检查滴定管是否酯水
B.用蒸馏水洗干净滴定管
C._________________________
D.用酸式滴定管取稀盐酸,往人锥形瓶中,加入酚酞溶液
E.取下碱式滴定管,用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0”刻度以下,记下滴定管液面所在刻度
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作2~3次
完成以下填空:
(1)C操作为________________
(2)如图是第一次滴定时的滴定管中的液面,其读数为_______________.
(3)根据下表数据计算待测盐酸的浓度:____________.
滴定次数 待测盐酸体积() 标准溶液体积()
滴定前读数 滴定后读数
第一次 20.00 0.60 X
第二次 20.00 2.00 24.10
第三次 20.00 4.00 24.00
(4)在上述实验过程中,出现了以下操作(其他操作均正确),其中会造成测定结果(待测液浓度值)偏高的有________(填标号).
A.锥形瓶水洗后直接装待测液
B.碱式滴定管水洗后未用标准溶液液润洗
C.滴定到达终点时,俯视液面读数
D.滴定结束后,碱式滴定管尖嘴处挂有半滴标准液
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后消失
(5)利用反应可以定量测定市售硫代硫酸钠()的纯度,现在称取硫代硫酸钠固体样品,配成溶液,取置于锥形瓶中,加入几滴淀粉溶液做指示剂,用含碘的碘水滴定,消耗碘水,则:
①判定滴定终点的现象为__________________________
②样品中硫代硫酸钠纯度为___________________________________
21.氢的化合物种类繁多,性质也各不相同.请回答下列问题:
(1)已知:
①
②
则的___________
(2)作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的进行吸附,并发生反应:.在恒压密闭容器中加入足量活性炭和一定量气体,反应相同时间时,测得的转化率随温度的变化如图所示:
①图中a和c两点中,达到平衡的点是__________.
②温度为时,以下可作为判定上述反应到达平衡的依据是_________(填标号)
A.
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中活性炭的质量不再变化
E.体系的压强不再变化
③温度为1100K时,的平衡体积分数为__________________.
(3)现代技术用氮气将汽车尾气中的还原为和,反应原理是
①实际生产中的反应温度不宜过高的原因是_____________
②500℃时,在2L恒容密闭容器中充入和,此时体系压强为.时反应达到平衡,此时体系压强为,则内用表示的平均反应速率_______,500℃时该反应的平衡常数__________.
22.格及其化合物在工业上用途广泛,回答下列问题:
(1)铁铬液流电池是一种酸性介质中,正、负极活性物质均为液体的化学电池,放电时电池的总反应为:,电池结构原理如图所示,a和b代表电极.电池放电时a级的电势________b级电势(填“高于”“低于”或“等于”),电池充电时阴极的电极反应为________________.
(2)含的废水毒性较大,某工厂废水中含的.为了使废水的排放达标;进行如下处理:
若处理后的废水中,则废水中_________.
;)
(3)以铬酸钠()为原料,用电化学法可制备重铬酸钠(),实验装置如图所示
①阳极的电极反应式为_________________
②电解一段时间后,测得阳极区溶液中物质的量由变为,则生成重铬酸钠的物质的量为________.
包头市2022-2023学年高二上学期期末考试
化学参考答案
一、选择题(共54分)
题号 1 2 3 4 5 6 7 8 9
答案 A D C D B C A A C
题号 10 11 12 13 14 15 16 17 18
答案 C A A B D B B D D
二、填空题:(共46分)
19.(11分)
(1) (1分)
(2) (2分)
(3)①⑦⑥⑤④②③(2分)
(4)D(2分) (5)10(2分) (6)1:9(2分)
20.(12分)
(1)用待测定的溶液润洗酸式滴定管(2分) (2)20.60(2分)
(3)0.1000(2分) (4)BDE(2分)
(5)①当加入最后一滴碘水时,溶液变为蓝色且半分钟内蓝色不褪去(2分)
②64%(2分)
21.(14分)
(1) (2分)
(2)①c(2分) ②BCD(2分) ③20%(2分)
(3)①该反应是放热反应,升高温度,平衡逆向移动,不利于反应物的转化,故反应温度不宜过高(2分)
②(2分);27(2分)
22.(9分)
(1)高于(1分): (2分)
(2) (2分)
(3)①(或)(2分)
②(2分)
包头市2022-2023学年高二上学期期末考试
化学
注意事项:
1.考生答卷的,务必将自己的姓名、座位号写在答题卡上.将条形码粘贴在规定区域本试卷满分100分,考试时间90分钟.
2.做选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选除其他答案标号.写在本试卷上无效.
3.回答非选择题时,将答案写在答题卡的规定区域内,写在本试卷上无效.
4.考试结束后,将答题卡交回.
可能用到的相对原子质量:H 1 C 12 Fe 56 Cu 64 Zn 65 Cr 52
一、选择题(本题共18小题,每小题3分,共54分.每小题只有一个项符合题目要求)
1.化学与社会生活密切相关.下列叙述中,不能用勒夏特列原理解释的是( )
A.食品包装中加抗氧化剂利于延长保质期 B.用排饱和食盐水法收集氯气
C.用浓氨水和氧化钙固体快速制取氨气 D.用热的纯碱溶液洗去油污效果更好
2.下列离子方程式属于盐类的水解,且书写正确的是( )
A. B.
C. D.
3.合成氯反应为:,其反应速率可以分别用表示,反应达平衡时,下列关系式正确的是( )
A. B.
C. D.
4.能促进水的电离平衡,并使溶液中的的操作是( )
A.将水加热煮沸 B.向水中通入
C.向水中滴加溶液 D.将固体溶于水
5.常温下,下列各组离子在指定条件下一定能大量共存的是( )
A.含有的溶液中:
B.能使甲基橙试剂变红的溶液中:
C.的溶液中:
D.水电离出的的溶液中:
6.下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.在常温下能自发进行,则该反应的
C.加热溶液,的水解程度和溶液的均增大(忽略的变化)
D.对于乙酸与乙醇的酯化反应(),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
7.下列用来表示物质变化的化学用语中,正确的是( )
A.析氢腐蚀和吸氧腐蚀,负极反应均是:
B.燃料电池,负极的电极反应式为
C.铅酸蓄电池放电时正极的反应式:
D.用惰性电极电解饱和食盐水时,阴极的电极反应式为:
8.常温下,下列事实不能说明是弱碱的是( )
A.溶液与等体积恰好完全反应
B.溶液中
C.将的溶液稀释10倍,测得
D.一定浓度的溶液中:
9.某同学设计如图所示实验,探究反应中的能量变化.
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铜质搅拌器,测定中和热数值偏低
D.实验(c)记录终止温度时,需等待温度计示数稳定后再读数
10.下列说法正确的是( )
A.的燃烧热,则
B.含的稀溶液与稀盐酸完全中和,放出的热量,则稀醋酸和稀溶液反应的热化学方程式为:
C.已知,则
D.500℃、下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:
11.关于下列各装置图的叙述正确的是( )
A.用图①装置实现铁上镀铜,b极为铁,电解质溶液可以是溶液
B.图②装置盐桥中的移向左烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护,该方法为牺牲阳极的阴极保护法
D.图④两个装置中通过导线的电子数相同时,正极析出产品的物质的量不同
12.已知25℃时一些难溶物质的溶度积常数()如下:
化学式
溶度积()
根据上表数据,判断下列化学过程不能实现的是(反应条件省略)( )
A.
B.
C.
D.
13.与的反应分两步完成,其能量曲线如图所示.反应①:,反应②:,下列有关说法错( )
A.反应①决定该反应的反应速率
B.为该反应的催化剂
C.
D.温度升高,活化分子百分数增大,有效碰撞概率增大,反应速率加快
14.温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:;,容器中A、B、D的物质的量浓度随时间的变化如图所示.
下列说法正确的是( )
A.反应在前的平均反应速率
B.该反应的平衡常数表达式
C.若平衡时保持温度不变,压缩容器体积平衡逆向移动
D.反应至时,改变的条件是降低湿度
15.在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响.下列有关说法正确的是( )
A.草酸的电离方程式为
B.草酸溶液中:
C.常温下,将草酸溶液加水稀释,溶液中所有离子的浓度均减小
D.已知溶液显酸性,则
16.将溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
A.液滴中的由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:
C.装滴下的因发生还原反应而被腐蚀,生成的由a区向b区迁移,与b区的形成,进一步氧化,脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加溶液,则负极发生的电极反应为
17.环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶,塑料等生产,在储存时容易发生聚合生成二聚体:不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法错误的是( )
A.,该反应的 B.平衡常数,
C.a点的正反应速率大于b点的逆反应速率 D.b点时环戊二烯的转化率为40%
18.常温下,用溶液分别滴定浓度均为的溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解).下列叙述正确的是( )
A.的数量级等于
B.n点表示的不饱和溶液
C.向的混合液中滴入溶液时,先生成沉淀
D.的平衡常数为
二、填空题(共46分)
19.酸、碱、盐都是电解质,常温下,有以下电解质溶液:
① ② ③ ④ ⑤ ⑥ ⑦
已知:的电离常数
(1)用化学用语解释④呈酸性的原因:__________________________
(2)的溶液①中由水电离出的为_____________________________
(3)浓度均为的上述7种溶液, 由大到小为______________________________
(4)在⑥溶液中下列关系成立的是______________________________
A.
B.
C.
D.
(5)若某浓度的⑥和⑦的混合溶液中,该溶液的______________
(6)将的①溶液与的③溶液混合,若所得混合溶液的,则①和②溶液的体积比为____________
20.酸碱中和滴定是一种重要的实验方法,用溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.检查滴定管是否酯水
B.用蒸馏水洗干净滴定管
C._________________________
D.用酸式滴定管取稀盐酸,往人锥形瓶中,加入酚酞溶液
E.取下碱式滴定管,用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0”刻度以下,记下滴定管液面所在刻度
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作2~3次
完成以下填空:
(1)C操作为________________
(2)如图是第一次滴定时的滴定管中的液面,其读数为_______________.
(3)根据下表数据计算待测盐酸的浓度:____________.
滴定次数 待测盐酸体积() 标准溶液体积()
滴定前读数 滴定后读数
第一次 20.00 0.60 X
第二次 20.00 2.00 24.10
第三次 20.00 4.00 24.00
(4)在上述实验过程中,出现了以下操作(其他操作均正确),其中会造成测定结果(待测液浓度值)偏高的有________(填标号).
A.锥形瓶水洗后直接装待测液
B.碱式滴定管水洗后未用标准溶液液润洗
C.滴定到达终点时,俯视液面读数
D.滴定结束后,碱式滴定管尖嘴处挂有半滴标准液
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后消失
(5)利用反应可以定量测定市售硫代硫酸钠()的纯度,现在称取硫代硫酸钠固体样品,配成溶液,取置于锥形瓶中,加入几滴淀粉溶液做指示剂,用含碘的碘水滴定,消耗碘水,则:
①判定滴定终点的现象为__________________________
②样品中硫代硫酸钠纯度为___________________________________
21.氢的化合物种类繁多,性质也各不相同.请回答下列问题:
(1)已知:
①
②
则的___________
(2)作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的进行吸附,并发生反应:.在恒压密闭容器中加入足量活性炭和一定量气体,反应相同时间时,测得的转化率随温度的变化如图所示:
①图中a和c两点中,达到平衡的点是__________.
②温度为时,以下可作为判定上述反应到达平衡的依据是_________(填标号)
A.
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中活性炭的质量不再变化
E.体系的压强不再变化
③温度为1100K时,的平衡体积分数为__________________.
(3)现代技术用氮气将汽车尾气中的还原为和,反应原理是
①实际生产中的反应温度不宜过高的原因是_____________
②500℃时,在2L恒容密闭容器中充入和,此时体系压强为.时反应达到平衡,此时体系压强为,则内用表示的平均反应速率_______,500℃时该反应的平衡常数__________.
22.格及其化合物在工业上用途广泛,回答下列问题:
(1)铁铬液流电池是一种酸性介质中,正、负极活性物质均为液体的化学电池,放电时电池的总反应为:,电池结构原理如图所示,a和b代表电极.电池放电时a级的电势________b级电势(填“高于”“低于”或“等于”),电池充电时阴极的电极反应为________________.
(2)含的废水毒性较大,某工厂废水中含的.为了使废水的排放达标;进行如下处理:
若处理后的废水中,则废水中_________.
;)
(3)以铬酸钠()为原料,用电化学法可制备重铬酸钠(),实验装置如图所示
①阳极的电极反应式为_________________
②电解一段时间后,测得阳极区溶液中物质的量由变为,则生成重铬酸钠的物质的量为________.
包头市2022-2023学年高二上学期期末考试
化学参考答案
一、选择题(共54分)
题号 1 2 3 4 5 6 7 8 9
答案 A D C D B C A A C
题号 10 11 12 13 14 15 16 17 18
答案 C A A B D B B D D
二、填空题:(共46分)
19.(11分)
(1) (1分)
(2) (2分)
(3)①⑦⑥⑤④②③(2分)
(4)D(2分) (5)10(2分) (6)1:9(2分)
20.(12分)
(1)用待测定的溶液润洗酸式滴定管(2分) (2)20.60(2分)
(3)0.1000(2分) (4)BDE(2分)
(5)①当加入最后一滴碘水时,溶液变为蓝色且半分钟内蓝色不褪去(2分)
②64%(2分)
21.(14分)
(1) (2分)
(2)①c(2分) ②BCD(2分) ③20%(2分)
(3)①该反应是放热反应,升高温度,平衡逆向移动,不利于反应物的转化,故反应温度不宜过高(2分)
②(2分);27(2分)
22.(9分)
(1)高于(1分): (2分)
(2) (2分)
(3)①(或)(2分)
②(2分)
同课章节目录
