6.1.1 化学反应与热能(共26张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.1 化学反应与热能(共26张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 09:59:55 | ||
图片预览








文档简介
(共26张PPT)
化学反应与热能 第一课时
生活中能量的变化
思考:
1.为什么会有能量变化?
2.这些例子都释放能量,有没有吸收能量的呢?
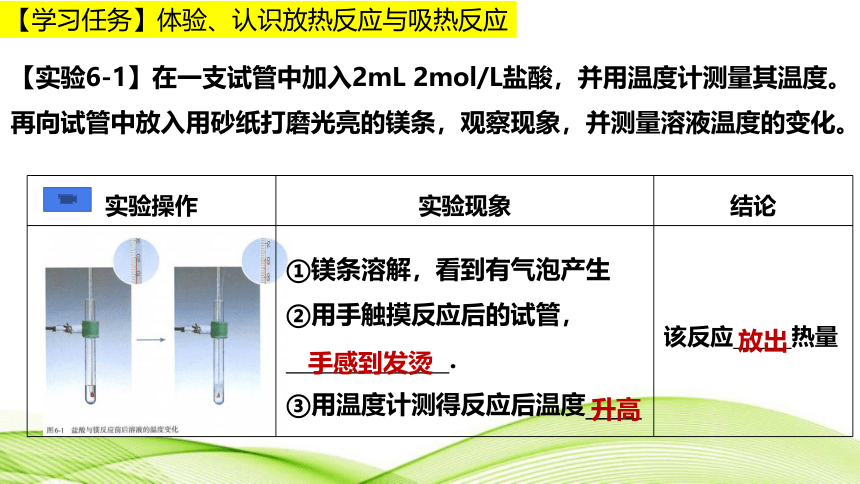
【实验6-1】在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验操作 实验现象 结论
①镁条溶解,看到有气泡产生 ②用手触摸反应后的试管, . ③用温度计测得反应后温度_____ 该反应 热量
手感到发烫
升高
放出
【学习任务】体验、认识放热反应与吸热反应
【实验6-2】将20g Ba(OH)2·8H2O晶体研细后与10g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气体后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
①闻到 气味 ②烧杯壁_____,试着用手拿起杯,________________ ③混合物呈 状 该反应 热量。
变凉
吸收
【学习任务】体验、认识放热反应与吸热反应
刺激性
糊
玻璃片黏在烧杯上
结论:化学反应过程中伴有热量的释放和吸收
一、放热反应与吸热反应
释放热量的化学反应
吸收热量的化学反应
吸热反应
放热反应
注意:任何反应都有热量变化
常见的放热反应和吸热反应
放热反应
吸热反应
所有燃烧
中和反应
溶液里的置换
一般的化合反应
特殊的分解(硝酸铵 )
强碱与铵盐反应
一般的分解
特殊的化合C+CO2== CO
需要持续加热、高温或通电才能进行的反应
C+H2O(g)===CO+H2 (水煤气)
高温
缓慢氧化还原反应(食物腐败、铁的生锈、葡萄糖体内氧化)
高温
巩固练习:
1. 下列物质加入水中显著放热的是:
A.生石灰 B.酒精
C.固体NaCl D.固体NaOH
2. 下列反应中既属于氧化还原反应同时又是吸热反应的是:
A.Ba(OH)2 · 8H2O与NH4Cl反应
B.镁与稀盐酸 C.灼热的炭与CO2
D.甲烷与O2反应
巩固练习:
3. 下列反应属于放热反应的是:
A. KOH与HNO3反应 B. C和CO2共热
C. 碳酸钙的分解 D. 制备水煤气的反应
化学反应的本质
是反应物中旧化学键的_______
和生成物中新化学键的_______
断裂
形成
吸收能量
放出能量
二、 化学反应能量变化的原因本质——微观角度
吸679kJ
放862kJ
放183kJ
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
吸热反应:E吸 > E放
放热反应:E吸 < E放
已知:形成2molH-Cl 键释放能量为862kJ
所以: H-Cl 键的键能是 kJ/mol
断开1mol H-Cl吸收 kJ能量
形成1mol H-Cl 放出 kJ能量
键能:断开或形成1mol化学键吸收或放出的能量。
单位:kJ/mol
通常,键能愈大,键愈牢固,由该键构成的分子也愈稳定
431
431
431
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放热反应
吸热反应
二、 化学反应能量变化的原因——宏观角度
释放
化学能 热能
热能 化学能
贮存
结论:化学反应中的能量变化取决于反应物总能量与生成物总能量的相对大小。
图示:
吸热反应
放热反应
各种物质都储存有化学能。不同的物质不仅组成不同,结构不同,所包含的化学能也不同。
物质的稳定性与能量的关系
1、化学反应的本质:
2、能量变化的主要原因(微观角度)
3、能量变化的决定因素(宏观角度):
放热反应:反应物总能量>生成物总能量
吸热反应:反应物总能量<生成物总能量
旧化学键断裂和新化学键形成
化学键的断裂(吸收能量)和形成(放出能量)
吸热反应:E吸 > E放
放热反应:E吸 < E放
【归纳小结】
1.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
A
2.已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是 ( )
A.O2的能量一定高于SO2的能量
B.2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
B
【解析】因反应2SO2+O2 2SO3为放热反应,所以2 mol SO2和1 mol O2的能量和一定高于2 mol SO3的能量,A错误,B正确,C错误;化学反应的实质是旧键的断裂和新键的形成,而断键过程需要吸收能量,故放热反应有些也需要一定条件,该反应是放热的,但需要加热才能发生,D错误。
3. 下列各图中,表示吸热反应的图是 ( )
【解析】反应物的总能量小于生成物的总能量则为吸热反应。
A
4.关于吸热反应的说法正确的是 ( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
【解析】反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程一定是吸热反应,D正确。
D
1人类对能源利用的三个阶段
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
2.化石燃料利用过程面临的问题
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。
如果你是社会不同人群,你的想法是什么?你会怎么做?
大力发展新能源,如太阳能、风能、水能等清洁能源。
例如:
节约能源逐步减少煤、汽油、柴油等燃料的使用。
3.能源可持续发展的措施
提高燃料的燃烧效率
提高能源的利用率
开发使用新能源
2.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列能达到新能源标准的是( )
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A.②⑤⑦⑧ B.①④⑤⑦⑧
C.④⑤⑦⑧ D.②③⑥⑦⑧
B
化学反应与热能 第一课时
生活中能量的变化
思考:
1.为什么会有能量变化?
2.这些例子都释放能量,有没有吸收能量的呢?
【实验6-1】在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验操作 实验现象 结论
①镁条溶解,看到有气泡产生 ②用手触摸反应后的试管, . ③用温度计测得反应后温度_____ 该反应 热量
手感到发烫
升高
放出
【学习任务】体验、认识放热反应与吸热反应
【实验6-2】将20g Ba(OH)2·8H2O晶体研细后与10g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气体后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
①闻到 气味 ②烧杯壁_____,试着用手拿起杯,________________ ③混合物呈 状 该反应 热量。
变凉
吸收
【学习任务】体验、认识放热反应与吸热反应
刺激性
糊
玻璃片黏在烧杯上
结论:化学反应过程中伴有热量的释放和吸收
一、放热反应与吸热反应
释放热量的化学反应
吸收热量的化学反应
吸热反应
放热反应
注意:任何反应都有热量变化
常见的放热反应和吸热反应
放热反应
吸热反应
所有燃烧
中和反应
溶液里的置换
一般的化合反应
特殊的分解(硝酸铵 )
强碱与铵盐反应
一般的分解
特殊的化合C+CO2== CO
需要持续加热、高温或通电才能进行的反应
C+H2O(g)===CO+H2 (水煤气)
高温
缓慢氧化还原反应(食物腐败、铁的生锈、葡萄糖体内氧化)
高温
巩固练习:
1. 下列物质加入水中显著放热的是:
A.生石灰 B.酒精
C.固体NaCl D.固体NaOH
2. 下列反应中既属于氧化还原反应同时又是吸热反应的是:
A.Ba(OH)2 · 8H2O与NH4Cl反应
B.镁与稀盐酸 C.灼热的炭与CO2
D.甲烷与O2反应
巩固练习:
3. 下列反应属于放热反应的是:
A. KOH与HNO3反应 B. C和CO2共热
C. 碳酸钙的分解 D. 制备水煤气的反应
化学反应的本质
是反应物中旧化学键的_______
和生成物中新化学键的_______
断裂
形成
吸收能量
放出能量
二、 化学反应能量变化的原因本质——微观角度
吸679kJ
放862kJ
放183kJ
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
吸热反应:E吸 > E放
放热反应:E吸 < E放
已知:形成2molH-Cl 键释放能量为862kJ
所以: H-Cl 键的键能是 kJ/mol
断开1mol H-Cl吸收 kJ能量
形成1mol H-Cl 放出 kJ能量
键能:断开或形成1mol化学键吸收或放出的能量。
单位:kJ/mol
通常,键能愈大,键愈牢固,由该键构成的分子也愈稳定
431
431
431
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放热反应
吸热反应
二、 化学反应能量变化的原因——宏观角度
释放
化学能 热能
热能 化学能
贮存
结论:化学反应中的能量变化取决于反应物总能量与生成物总能量的相对大小。
图示:
吸热反应
放热反应
各种物质都储存有化学能。不同的物质不仅组成不同,结构不同,所包含的化学能也不同。
物质的稳定性与能量的关系
1、化学反应的本质:
2、能量变化的主要原因(微观角度)
3、能量变化的决定因素(宏观角度):
放热反应:反应物总能量>生成物总能量
吸热反应:反应物总能量<生成物总能量
旧化学键断裂和新化学键形成
化学键的断裂(吸收能量)和形成(放出能量)
吸热反应:E吸 > E放
放热反应:E吸 < E放
【归纳小结】
1.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
A
2.已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是 ( )
A.O2的能量一定高于SO2的能量
B.2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
B
【解析】因反应2SO2+O2 2SO3为放热反应,所以2 mol SO2和1 mol O2的能量和一定高于2 mol SO3的能量,A错误,B正确,C错误;化学反应的实质是旧键的断裂和新键的形成,而断键过程需要吸收能量,故放热反应有些也需要一定条件,该反应是放热的,但需要加热才能发生,D错误。
3. 下列各图中,表示吸热反应的图是 ( )
【解析】反应物的总能量小于生成物的总能量则为吸热反应。
A
4.关于吸热反应的说法正确的是 ( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
【解析】反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程一定是吸热反应,D正确。
D
1人类对能源利用的三个阶段
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
2.化石燃料利用过程面临的问题
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。
如果你是社会不同人群,你的想法是什么?你会怎么做?
大力发展新能源,如太阳能、风能、水能等清洁能源。
例如:
节约能源逐步减少煤、汽油、柴油等燃料的使用。
3.能源可持续发展的措施
提高燃料的燃烧效率
提高能源的利用率
开发使用新能源
2.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列能达到新能源标准的是( )
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A.②⑤⑦⑧ B.①④⑤⑦⑧
C.④⑤⑦⑧ D.②③⑥⑦⑧
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
