2022-2023学年鲁科版高中化学选择性必修1 1.4金属的腐蚀与防护 (共32张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学选择性必修1 1.4金属的腐蚀与防护 (共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 10:05:42 | ||
图片预览









文档简介
(共32张PPT)
金属的腐蚀
与防护
华丽蜕变的“辽宁号”
2012年我国第一艘航母“辽宁号”交付海军,标志着我国海军从近海走向远洋。它的前身“瓦良格号”由于苏联解体失去了强大国力支撑而被迫中断工程。于是历经一年零四个月的漫长旅途,“瓦良格号”抵达了综合国力强大的中国。历经风霜的瓦良格号在抵达我国时锈迹斑斑。我国科学家充分发挥化学等自然科学在国防科技中的作用,对其进行修复、改装、建造,并采用了多种防腐蚀方案进行保护——“辽宁号”才有了如今威风凛凛、霸气威武的模样!
“瓦良格号” 是如何被腐蚀的?
这些“锈”是什么物质?
“辽宁号”采用了哪些防腐蚀方案阻止船体生锈?
学习目标
1.通过对铁的腐蚀宏观现象的分析,能对铁腐蚀过程中的物质转化提出假设并设计实验进行探究;能根据实验现象分析推理得出铁腐蚀过程中构成了微小的原电池,并调用电化学认识模型分析解释金属腐蚀现象。
2.通过对酸性条件下金属腐蚀压强变化数据的分析,解释金属析氢腐蚀的原理,并能准确熟练地用化学方程式表示。
3.通过金属防护措施的探讨,能利用电化学认识模型,从阻断原电池、电解池形成的条件或者更换原电池、电解池的电极材料等多角度选择并设计防腐蚀措施。
4. 通过生产生活中金属腐蚀以及防护的实例分析,能够意识到金属防腐的重要性以及真实的防腐都是多种防腐方案综合使用,体会化学学科的价值。
任务一:探究吸氧腐蚀
制作“瓦良格”号船体的主要材料是碳钢合金,生成的铁锈的主要成分是Fe2O3﹒nH2O
知识支持
【情境还原】船体一直处在海水的浸泡或者潮湿的空气中,我们以生铁板上滴食盐水,模拟海水和潮湿空气中的瓦良格号。一段时间后可观察到铁板上的铁锈。
任务一:探究吸氧腐蚀
【提出假设】请你推测Fe→ Fe2O3﹒nH2O 的过程经历了怎样的转化路径?该过程中有哪些物质生成?你推理物质转化路径的思维角度是什么?如何设计实验验证你的推测是否正确?
【知识支持】 Fe2+遇到K3[Fe(CN)6]溶液产生蓝色沉淀,可用来检验Fe2+
【要求】独立思考后小组内相互交流
预期转化 转化路径 选取试剂 实验现象
Fe→ Fe2O3﹒nH2O
任务一:探究吸氧腐蚀
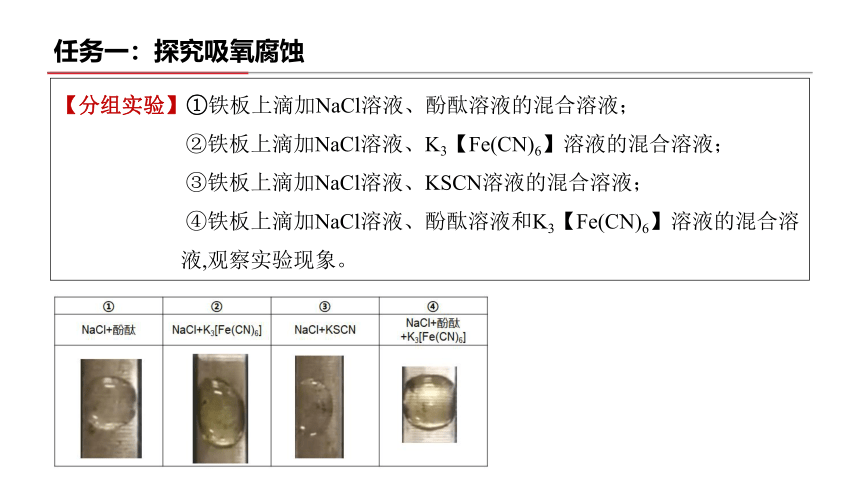
【分组实验】①铁板上滴加NaCl溶液、酚酞溶液的混合溶液;
②铁板上滴加NaCl溶液、K3【Fe(CN)6】溶液的混合溶液;
③铁板上滴加NaCl溶液、KSCN溶液的混合溶液;
④铁板上滴加NaCl溶液、酚酞溶液和K3【Fe(CN)6】溶液的混合溶
液,观察实验现象。
任务一:探究吸氧腐蚀
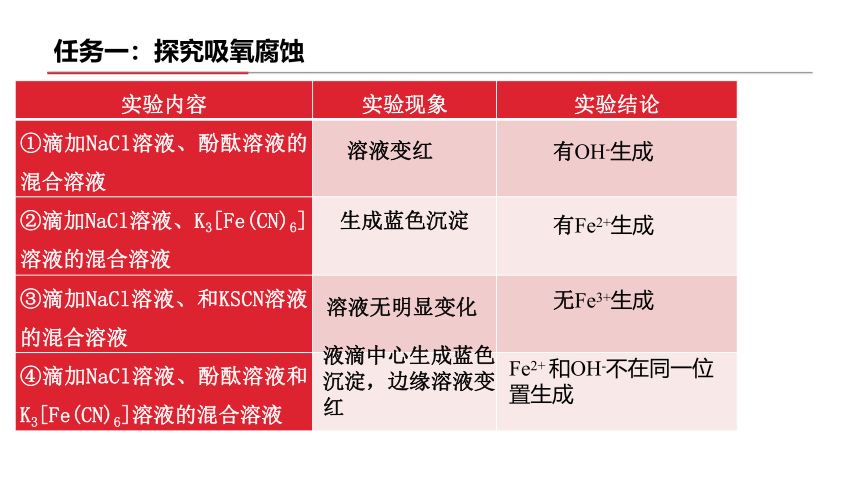
实验内容 实验现象 实验结论
①滴加NaCl溶液、酚酞溶液的混合溶液
②滴加NaCl溶液、K3[Fe(CN)6]溶液的混合溶液
③滴加NaCl溶液、和KSCN溶液的混合溶液
④滴加NaCl溶液、酚酞溶液和K3[Fe(CN)6]溶液的混合溶液
溶液变红
有OH-生成
生成蓝色沉淀
有Fe2+生成
溶液无明显变化
无Fe3+生成
液滴中心生成蓝色沉淀,边缘溶液变红
Fe2+ 和OH-不在同一位置生成
任务一:探究吸氧腐蚀
【得出结论】
转化路径 Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe2O3 ﹒nH2O
任务一:探究吸氧腐蚀
1.将Fe氧化成Fe2+的氧化剂是哪种物质?相应的还原产物是什么?
2.生成Fe2+和OH-的位置为什么不同?
观察思考
任务一:探究吸氧腐蚀
实验内容 数据变化 实验结论
1.两只试管中加入同体积等浓度的食盐水
2.确保体系的密闭性
3.长摁“清零”按钮5秒
5.点击“开始”,观察示数的变化。
O2做氧化剂,参与了化学反应
任务一:探究吸氧腐蚀
用数码显微镜继续观察铁板上滴了NaCl溶液、酚酞溶液和K3[Fe(CN)6]溶液的混合溶液。
数码显微镜
任务一:探究吸氧腐蚀
你看到了哪些实验现象?请你选择可作为证据的实验现象,分析推理你原来做出的所有假设。
观察思考
任务一:探究吸氧腐蚀
铁和碳与电解质溶液相互接触,形成了微小原电池,属于电化学腐蚀。这种腐蚀过程中,环境消耗的物质主要是O2,铁生成含氧化合物,也称为吸氧腐蚀。
得出结论
任务一:探究吸氧腐蚀
【符号表征】调用电化学统一认识模型,写出生成Fe2+、OH-、Fe(OH)2 、Fe(OH)3、Fe2O3 ﹒nH2O过程所有的化学方程式。
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
K3[Fe(CN)6]溶液产生蓝色沉淀
酚酞溶液变红
任务二:认识析氢腐蚀
观察思考
这一类电化学腐蚀称之为析氢腐蚀。
得出结论
把传感器实验中的电解质溶液更换成稀硫酸,测得压强传感器的数据变化如图,分析解释压强变化的原因。
任务二:认识析氢腐蚀
【应用实践】脱硫塔是位于船舶烟囱中的敏感设备.所处环境为酸性,温度较高。观察脱硫塔被腐蚀的图片,并对比发生吸氧腐蚀生成铁锈的图片,思考:脱硫塔腐蚀的原理和船体腐蚀的原理完全相同吗?请你做出推理,并写出相应的反应方程式。
发生吸氧腐蚀生成的铁锈
负极:Fe-2e- =Fe2+
正极:2H++2e- =H2
电池反应:Fe+2H+ = Fe2++H2
任务二:认识析氢腐蚀
【深度思考】海水中除溶有O2外也存在H2O电离出的H+,为什么不发生析氢腐蚀?由此你得到了什么启示
【得出结论】电化学腐蚀中O2和H+竞争做氧化剂,环境的改变会导致氧化剂发生改变,强酸性环境中H+做氧化剂,弱酸性、中性、碱性环境中O2做氧化剂。我们应该辨证地分析问题,没有一成不变的结论.
任务二:认识析氢腐蚀
吸氧腐蚀和析氢腐蚀都属于电化学腐蚀。当金属与潮湿空气或电解质溶液接触时,主要发生电化学腐蚀。当周围环境改变,例如在干燥高温的环境中,金属也可以被氧气直接氧化,称之为化学腐蚀。电化学腐蚀和化学腐蚀统称为金属腐蚀,其实质都是金属失电子被氧化的过程。
任务三:为辽宁号设计防腐蚀方案
【情境导入】 我们研究金属腐蚀的价值和意义是为了“反其道而用之”,去阻断金属发生腐蚀的路径,更好地保护金属。请你运用所学的知识尽可能多角度、多途径、多种类地为辽宁号航母设计防腐蚀方案,并分析该方案的防腐蚀原理。
任务三:为辽宁号设计防腐蚀方案
设计的方案 该方案的防腐原理
【要求】1.独立思考后小组内相互交流,将想到的方案写在卡片上
2.小组间合作交流。每2个小组,划为一个大组,将想到的方法归类摆放、相互交流补充。
【追根寻源】你是怎么想到这些方案的 依据是什么
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
思路1:破坏原电池装置的闭合回路
方式
将电极材料与氧化剂或电解质溶液隔离
金属表面加上保护层
措施
(涂油漆、油脂、搪瓷、陶瓷、沥青、塑料、橡胶、电镀、热镀、喷镀等)
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
思路2:改变失e-场所
方式
牺牲阳极的阴极保护法
外加更活泼的金属做原电池的负极,要保护金属做正极
措施
锌等金属
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
思路3:阻断失e-场所
方式
外加电流阴极保护法
将保护的金属与电源的负极相连,形成电解池装置
措施
任务三:为辽宁号设计防腐蚀方案
【精讲点拨】结合电化学腐蚀的认识模型,从阻断腐蚀路径的角度设计防腐措施。
1.破坏原电池装置的闭合回路:将电极材料与氧化剂或电解质液隔离
金属表面加保护层(涂油漆、油脂、搪瓷、陶瓷、沥青、塑料、橡胶、电镀、热镀、喷镀等)
4.运用电化学方法使金属表面钝化:将被保护金属与外加电源的正极相连使其成为阳极,并使电压维持在可使该金属发生钝化作用的范围内,就能防止其腐蚀 。
2.改变失e-场所:将失e-场所换成比Fe更易失e-活泼金属。
牺牲阳极的阴极保护法
3.阻断失e-场所:将保护的金属与电源负极相连,形成电解池。
外加电流阴极保护法
任务三:为辽宁号设计防腐蚀方案
辽宁号采用的防护措施如下:
①刷特制油漆防船体腐蚀
揭秘真相
任务三:为辽宁号设计防腐蚀方案
辽宁号采用的防护措施如下:
①刷特制油漆防船体腐蚀
②牺牲阳极的阴极保护法
揭秘真相
任务三:为辽宁号设计防腐蚀方案
辽宁号采用的防护措施如下:
①刷特制油漆防船体腐蚀
②牺牲阳极的阴极保护法
③外加电流的阴极电保护法
揭秘真相
任务三:为辽宁号设计防腐蚀方案
金属的防护是一个重大课题。没有一种方法是一劳永逸的,需要多种防腐蚀方案一起综合应用。研制耐腐蚀的新型材料取代现有的钢铁等常用金属材料将是解决此问题的重要途径之一。不仅是航母、轮船这些大国重器需要防腐蚀,生活中的金属也需要防腐蚀。这些图片都是生活中防腐蚀的例子。
任务三:为辽宁号设计防腐蚀方案
金属腐蚀现象非常普遍,与人们的生产生活密切相关,研究并推广防止金属腐蚀的新方法和新技术是我们化学人的责任和使命。化学是一门实践性和应用性非常强的学科,来源于生活又服务于生产生活,并且在人类追求高品质的现代化生活中起着越来越重要的作用。
任务三:为辽宁号设计防腐蚀方案
中国航母劈波斩浪,中国海军向海图强!化学必将为祖国建设留下浓墨重彩的一笔!学好化学,强国有我!
谢谢大家!
金属的腐蚀
与防护
华丽蜕变的“辽宁号”
2012年我国第一艘航母“辽宁号”交付海军,标志着我国海军从近海走向远洋。它的前身“瓦良格号”由于苏联解体失去了强大国力支撑而被迫中断工程。于是历经一年零四个月的漫长旅途,“瓦良格号”抵达了综合国力强大的中国。历经风霜的瓦良格号在抵达我国时锈迹斑斑。我国科学家充分发挥化学等自然科学在国防科技中的作用,对其进行修复、改装、建造,并采用了多种防腐蚀方案进行保护——“辽宁号”才有了如今威风凛凛、霸气威武的模样!
“瓦良格号” 是如何被腐蚀的?
这些“锈”是什么物质?
“辽宁号”采用了哪些防腐蚀方案阻止船体生锈?
学习目标
1.通过对铁的腐蚀宏观现象的分析,能对铁腐蚀过程中的物质转化提出假设并设计实验进行探究;能根据实验现象分析推理得出铁腐蚀过程中构成了微小的原电池,并调用电化学认识模型分析解释金属腐蚀现象。
2.通过对酸性条件下金属腐蚀压强变化数据的分析,解释金属析氢腐蚀的原理,并能准确熟练地用化学方程式表示。
3.通过金属防护措施的探讨,能利用电化学认识模型,从阻断原电池、电解池形成的条件或者更换原电池、电解池的电极材料等多角度选择并设计防腐蚀措施。
4. 通过生产生活中金属腐蚀以及防护的实例分析,能够意识到金属防腐的重要性以及真实的防腐都是多种防腐方案综合使用,体会化学学科的价值。
任务一:探究吸氧腐蚀
制作“瓦良格”号船体的主要材料是碳钢合金,生成的铁锈的主要成分是Fe2O3﹒nH2O
知识支持
【情境还原】船体一直处在海水的浸泡或者潮湿的空气中,我们以生铁板上滴食盐水,模拟海水和潮湿空气中的瓦良格号。一段时间后可观察到铁板上的铁锈。
任务一:探究吸氧腐蚀
【提出假设】请你推测Fe→ Fe2O3﹒nH2O 的过程经历了怎样的转化路径?该过程中有哪些物质生成?你推理物质转化路径的思维角度是什么?如何设计实验验证你的推测是否正确?
【知识支持】 Fe2+遇到K3[Fe(CN)6]溶液产生蓝色沉淀,可用来检验Fe2+
【要求】独立思考后小组内相互交流
预期转化 转化路径 选取试剂 实验现象
Fe→ Fe2O3﹒nH2O
任务一:探究吸氧腐蚀
【分组实验】①铁板上滴加NaCl溶液、酚酞溶液的混合溶液;
②铁板上滴加NaCl溶液、K3【Fe(CN)6】溶液的混合溶液;
③铁板上滴加NaCl溶液、KSCN溶液的混合溶液;
④铁板上滴加NaCl溶液、酚酞溶液和K3【Fe(CN)6】溶液的混合溶
液,观察实验现象。
任务一:探究吸氧腐蚀
实验内容 实验现象 实验结论
①滴加NaCl溶液、酚酞溶液的混合溶液
②滴加NaCl溶液、K3[Fe(CN)6]溶液的混合溶液
③滴加NaCl溶液、和KSCN溶液的混合溶液
④滴加NaCl溶液、酚酞溶液和K3[Fe(CN)6]溶液的混合溶液
溶液变红
有OH-生成
生成蓝色沉淀
有Fe2+生成
溶液无明显变化
无Fe3+生成
液滴中心生成蓝色沉淀,边缘溶液变红
Fe2+ 和OH-不在同一位置生成
任务一:探究吸氧腐蚀
【得出结论】
转化路径 Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe2O3 ﹒nH2O
任务一:探究吸氧腐蚀
1.将Fe氧化成Fe2+的氧化剂是哪种物质?相应的还原产物是什么?
2.生成Fe2+和OH-的位置为什么不同?
观察思考
任务一:探究吸氧腐蚀
实验内容 数据变化 实验结论
1.两只试管中加入同体积等浓度的食盐水
2.确保体系的密闭性
3.长摁“清零”按钮5秒
5.点击“开始”,观察示数的变化。
O2做氧化剂,参与了化学反应
任务一:探究吸氧腐蚀
用数码显微镜继续观察铁板上滴了NaCl溶液、酚酞溶液和K3[Fe(CN)6]溶液的混合溶液。
数码显微镜
任务一:探究吸氧腐蚀
你看到了哪些实验现象?请你选择可作为证据的实验现象,分析推理你原来做出的所有假设。
观察思考
任务一:探究吸氧腐蚀
铁和碳与电解质溶液相互接触,形成了微小原电池,属于电化学腐蚀。这种腐蚀过程中,环境消耗的物质主要是O2,铁生成含氧化合物,也称为吸氧腐蚀。
得出结论
任务一:探究吸氧腐蚀
【符号表征】调用电化学统一认识模型,写出生成Fe2+、OH-、Fe(OH)2 、Fe(OH)3、Fe2O3 ﹒nH2O过程所有的化学方程式。
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
K3[Fe(CN)6]溶液产生蓝色沉淀
酚酞溶液变红
任务二:认识析氢腐蚀
观察思考
这一类电化学腐蚀称之为析氢腐蚀。
得出结论
把传感器实验中的电解质溶液更换成稀硫酸,测得压强传感器的数据变化如图,分析解释压强变化的原因。
任务二:认识析氢腐蚀
【应用实践】脱硫塔是位于船舶烟囱中的敏感设备.所处环境为酸性,温度较高。观察脱硫塔被腐蚀的图片,并对比发生吸氧腐蚀生成铁锈的图片,思考:脱硫塔腐蚀的原理和船体腐蚀的原理完全相同吗?请你做出推理,并写出相应的反应方程式。
发生吸氧腐蚀生成的铁锈
负极:Fe-2e- =Fe2+
正极:2H++2e- =H2
电池反应:Fe+2H+ = Fe2++H2
任务二:认识析氢腐蚀
【深度思考】海水中除溶有O2外也存在H2O电离出的H+,为什么不发生析氢腐蚀?由此你得到了什么启示
【得出结论】电化学腐蚀中O2和H+竞争做氧化剂,环境的改变会导致氧化剂发生改变,强酸性环境中H+做氧化剂,弱酸性、中性、碱性环境中O2做氧化剂。我们应该辨证地分析问题,没有一成不变的结论.
任务二:认识析氢腐蚀
吸氧腐蚀和析氢腐蚀都属于电化学腐蚀。当金属与潮湿空气或电解质溶液接触时,主要发生电化学腐蚀。当周围环境改变,例如在干燥高温的环境中,金属也可以被氧气直接氧化,称之为化学腐蚀。电化学腐蚀和化学腐蚀统称为金属腐蚀,其实质都是金属失电子被氧化的过程。
任务三:为辽宁号设计防腐蚀方案
【情境导入】 我们研究金属腐蚀的价值和意义是为了“反其道而用之”,去阻断金属发生腐蚀的路径,更好地保护金属。请你运用所学的知识尽可能多角度、多途径、多种类地为辽宁号航母设计防腐蚀方案,并分析该方案的防腐蚀原理。
任务三:为辽宁号设计防腐蚀方案
设计的方案 该方案的防腐原理
【要求】1.独立思考后小组内相互交流,将想到的方案写在卡片上
2.小组间合作交流。每2个小组,划为一个大组,将想到的方法归类摆放、相互交流补充。
【追根寻源】你是怎么想到这些方案的 依据是什么
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
思路1:破坏原电池装置的闭合回路
方式
将电极材料与氧化剂或电解质溶液隔离
金属表面加上保护层
措施
(涂油漆、油脂、搪瓷、陶瓷、沥青、塑料、橡胶、电镀、热镀、喷镀等)
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
思路2:改变失e-场所
方式
牺牲阳极的阴极保护法
外加更活泼的金属做原电池的负极,要保护金属做正极
措施
锌等金属
宏观现象
微粒运动
电极产物
电极反应物
失e-场所
电子导体
离子导体
得e-场所
Fe2+
Fe
还原剂
失e-
OH-
O2
氧化剂
得e-
阳离子
阴离子
电子
思路3:阻断失e-场所
方式
外加电流阴极保护法
将保护的金属与电源的负极相连,形成电解池装置
措施
任务三:为辽宁号设计防腐蚀方案
【精讲点拨】结合电化学腐蚀的认识模型,从阻断腐蚀路径的角度设计防腐措施。
1.破坏原电池装置的闭合回路:将电极材料与氧化剂或电解质液隔离
金属表面加保护层(涂油漆、油脂、搪瓷、陶瓷、沥青、塑料、橡胶、电镀、热镀、喷镀等)
4.运用电化学方法使金属表面钝化:将被保护金属与外加电源的正极相连使其成为阳极,并使电压维持在可使该金属发生钝化作用的范围内,就能防止其腐蚀 。
2.改变失e-场所:将失e-场所换成比Fe更易失e-活泼金属。
牺牲阳极的阴极保护法
3.阻断失e-场所:将保护的金属与电源负极相连,形成电解池。
外加电流阴极保护法
任务三:为辽宁号设计防腐蚀方案
辽宁号采用的防护措施如下:
①刷特制油漆防船体腐蚀
揭秘真相
任务三:为辽宁号设计防腐蚀方案
辽宁号采用的防护措施如下:
①刷特制油漆防船体腐蚀
②牺牲阳极的阴极保护法
揭秘真相
任务三:为辽宁号设计防腐蚀方案
辽宁号采用的防护措施如下:
①刷特制油漆防船体腐蚀
②牺牲阳极的阴极保护法
③外加电流的阴极电保护法
揭秘真相
任务三:为辽宁号设计防腐蚀方案
金属的防护是一个重大课题。没有一种方法是一劳永逸的,需要多种防腐蚀方案一起综合应用。研制耐腐蚀的新型材料取代现有的钢铁等常用金属材料将是解决此问题的重要途径之一。不仅是航母、轮船这些大国重器需要防腐蚀,生活中的金属也需要防腐蚀。这些图片都是生活中防腐蚀的例子。
任务三:为辽宁号设计防腐蚀方案
金属腐蚀现象非常普遍,与人们的生产生活密切相关,研究并推广防止金属腐蚀的新方法和新技术是我们化学人的责任和使命。化学是一门实践性和应用性非常强的学科,来源于生活又服务于生产生活,并且在人类追求高品质的现代化生活中起着越来越重要的作用。
任务三:为辽宁号设计防腐蚀方案
中国航母劈波斩浪,中国海军向海图强!化学必将为祖国建设留下浓墨重彩的一笔!学好化学,强国有我!
谢谢大家!
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
