6.1.2 化学反应与电能(教学课件)(共17张PPT)——2022-2023学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.2 化学反应与电能(教学课件)(共17张PPT)——2022-2023学年高一化学人教版(2019)必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 10:16:25 | ||
图片预览

文档简介
(共17张PPT)
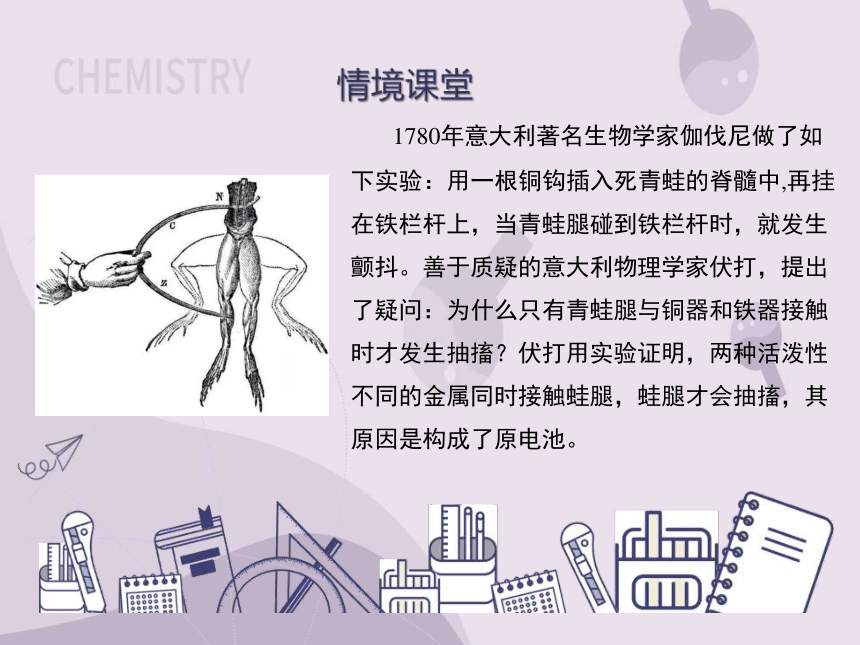
1780年意大利著名生物学家伽伐尼做了如下实验:用一根铜钩插入死青蛙的脊髓中,再挂在铁栏杆上,当青蛙腿碰到铁栏杆时,就发生颤抖。善于质疑的意大利物理学家伏打,提出了疑问:为什么只有青蛙腿与铜器和铁器接触时才发生抽搐?伏打用实验证明,两种活泼性不同的金属同时接触蛙腿,蛙腿才会抽搐,其原因是构成了原电池。
通过实验探究,认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。培养自主探索创新精神。
01
会判断原电池的正负极,能正确书写电极反应式。
02
了解常见的化学电源。树立绿色化学理念,培养科学发展观。
03
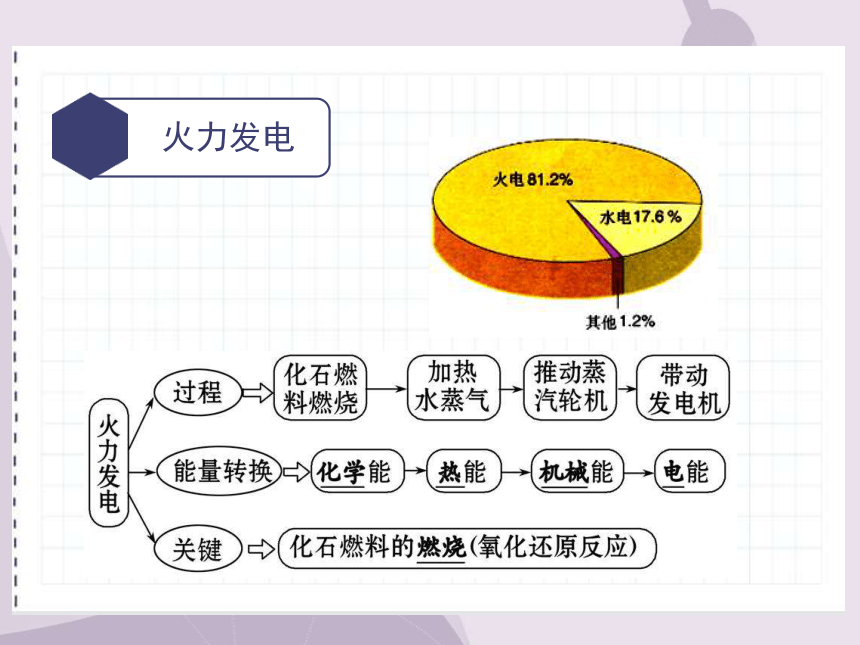
火力发电
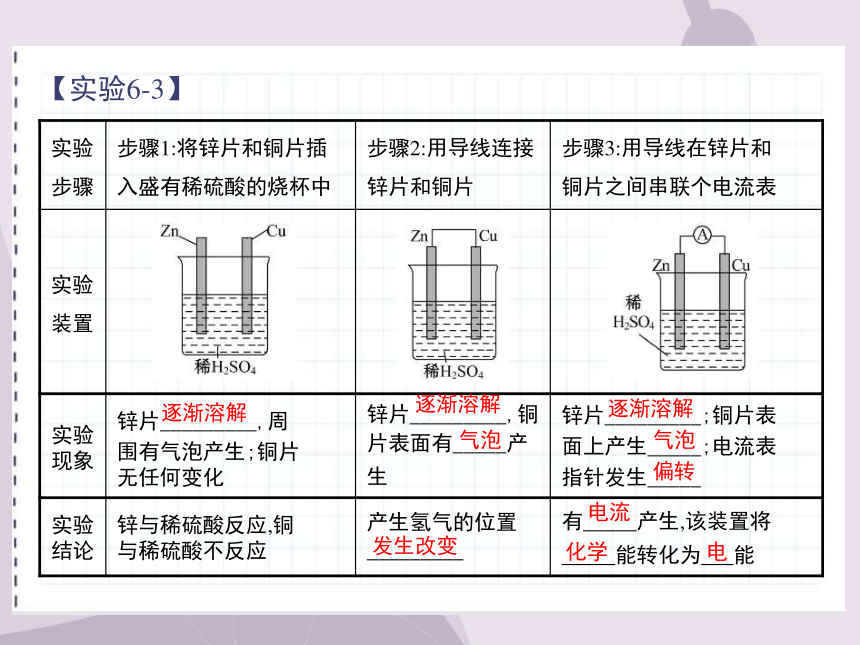
【实验6-3】
实验
步骤 步骤1:将锌片和铜片插入盛有稀硫酸的烧杯中 步骤2:用导线连接
锌片和铜片 步骤3:用导线在锌片和
铜片之间串联个电流表
实验
装置
实验
现象 锌片_________,周
围有气泡产生;铜片
无任何变化 锌片_________,铜
片表面有_____产生 锌片_________;铜片表
面上产生_____;电流表
指针发生_____
实验
结论 锌与稀硫酸反应,铜
与稀硫酸不反应 产生氢气的位置
_________ 有_____产生,该装置将
_____能转化为___能
逐渐溶解
逐渐溶解
气泡
逐渐溶解
气泡
偏转
发生改变
电流
化学
电
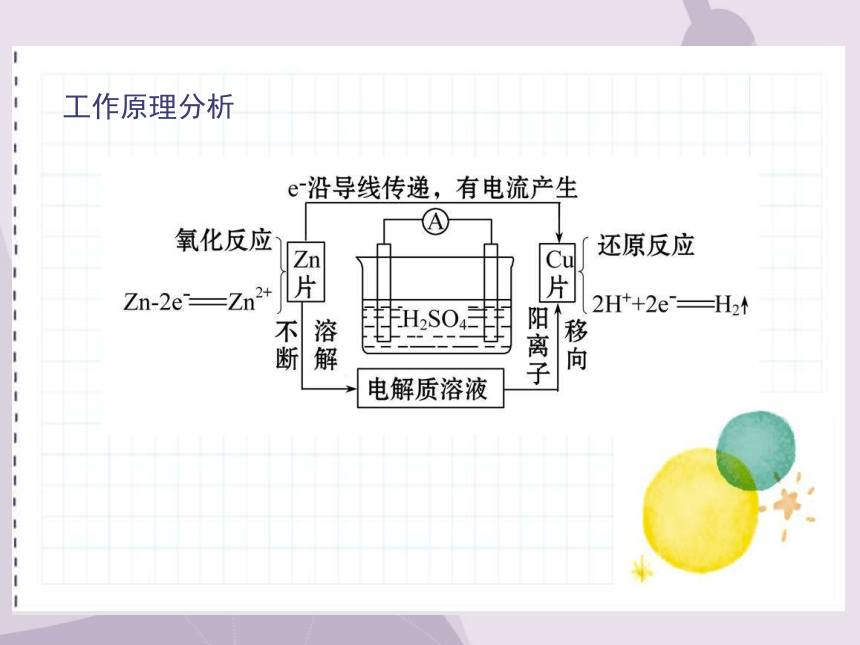
工作原理分析
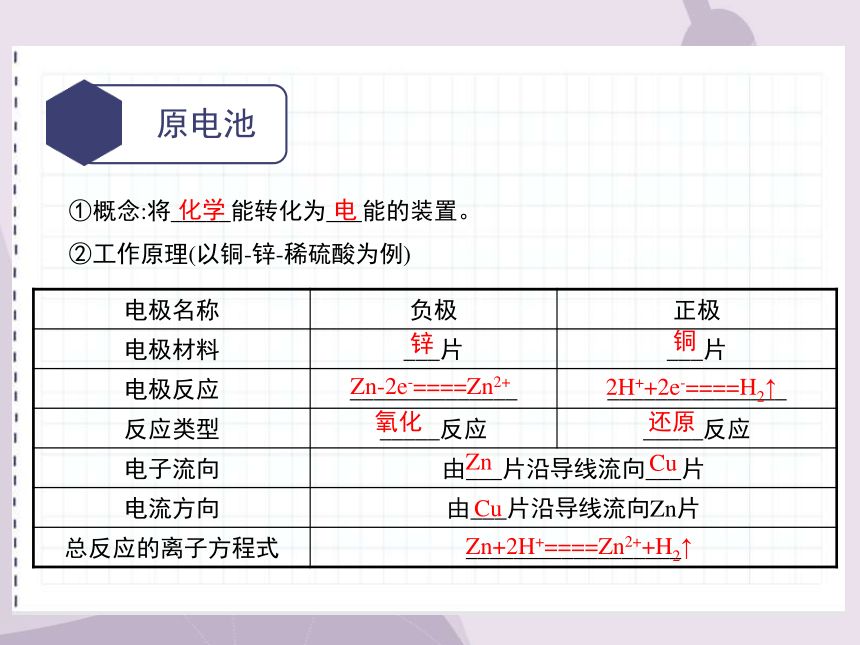
原电池
①概念:将_____能转化为___能的装置。
②工作原理(以铜-锌-稀硫酸为例)
电极名称 负极 正极
电极材料 ___片 ___片
电极反应 ______________ _______________
反应类型 _____反应 _____反应
电子流向 由___片沿导线流向___片
电流方向 由___片沿导线流向Zn片
总反应的离子方程式 __________________
化学
电
锌
铜
Zn-2e-====Zn2+
2H++2e-====H2↑
氧化
还原
Zn
Cu
Cu
Zn+2H+====Zn2++H2↑
通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些?
原电池构成条件
① 两种活泼性不同的金属作电极 (或其中一种为能导电的非金属,如“碳棒”)其中较活泼金属为负极;较不活泼金属(或非金属)为正极
② 电解质溶液
③ 形成闭合回路
④ 能自发进行氧化还原反应
原电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。
【实验】
(1)水果电池
(2)简易电池
锌锰干电池
(1)结构:锌锰干电池是以锌筒作__极,石墨棒作__极,氯化铵糊作__________。
(2)原理:锌锰干电池属于____电池,放电之后____充电(内部的氧化还原反应无法逆向进行)。负极发生的电极反应为___________________,正极发生的电极反应为2MnO2+2NH4++2e-===Mn2O3+2NH3↑+H2O。
负
正
电解质溶液
一次
不能
MnO2+H2O+e-====MnOOH+OH-。分析负极变化,写出负极电极反应式,总反应方程式减去负极反应式即得正极反应式。
二次电池
发展中的燃料电池
拓展深化——原电池正、负极的判断
谢谢观看
1780年意大利著名生物学家伽伐尼做了如下实验:用一根铜钩插入死青蛙的脊髓中,再挂在铁栏杆上,当青蛙腿碰到铁栏杆时,就发生颤抖。善于质疑的意大利物理学家伏打,提出了疑问:为什么只有青蛙腿与铜器和铁器接触时才发生抽搐?伏打用实验证明,两种活泼性不同的金属同时接触蛙腿,蛙腿才会抽搐,其原因是构成了原电池。
通过实验探究,认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。培养自主探索创新精神。
01
会判断原电池的正负极,能正确书写电极反应式。
02
了解常见的化学电源。树立绿色化学理念,培养科学发展观。
03
火力发电
【实验6-3】
实验
步骤 步骤1:将锌片和铜片插入盛有稀硫酸的烧杯中 步骤2:用导线连接
锌片和铜片 步骤3:用导线在锌片和
铜片之间串联个电流表
实验
装置
实验
现象 锌片_________,周
围有气泡产生;铜片
无任何变化 锌片_________,铜
片表面有_____产生 锌片_________;铜片表
面上产生_____;电流表
指针发生_____
实验
结论 锌与稀硫酸反应,铜
与稀硫酸不反应 产生氢气的位置
_________ 有_____产生,该装置将
_____能转化为___能
逐渐溶解
逐渐溶解
气泡
逐渐溶解
气泡
偏转
发生改变
电流
化学
电
工作原理分析
原电池
①概念:将_____能转化为___能的装置。
②工作原理(以铜-锌-稀硫酸为例)
电极名称 负极 正极
电极材料 ___片 ___片
电极反应 ______________ _______________
反应类型 _____反应 _____反应
电子流向 由___片沿导线流向___片
电流方向 由___片沿导线流向Zn片
总反应的离子方程式 __________________
化学
电
锌
铜
Zn-2e-====Zn2+
2H++2e-====H2↑
氧化
还原
Zn
Cu
Cu
Zn+2H+====Zn2++H2↑
通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些?
原电池构成条件
① 两种活泼性不同的金属作电极 (或其中一种为能导电的非金属,如“碳棒”)其中较活泼金属为负极;较不活泼金属(或非金属)为正极
② 电解质溶液
③ 形成闭合回路
④ 能自发进行氧化还原反应
原电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。
【实验】
(1)水果电池
(2)简易电池
锌锰干电池
(1)结构:锌锰干电池是以锌筒作__极,石墨棒作__极,氯化铵糊作__________。
(2)原理:锌锰干电池属于____电池,放电之后____充电(内部的氧化还原反应无法逆向进行)。负极发生的电极反应为___________________,正极发生的电极反应为2MnO2+2NH4++2e-===Mn2O3+2NH3↑+H2O。
负
正
电解质溶液
一次
不能
MnO2+H2O+e-====MnOOH+OH-。分析负极变化,写出负极电极反应式,总反应方程式减去负极反应式即得正极反应式。
二次电池
发展中的燃料电池
拓展深化——原电池正、负极的判断
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
