6.1.3 原电池 化学电源(教学课件)(共19张PPT)-2022-2023学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.3 原电池 化学电源(教学课件)(共19张PPT)-2022-2023学年高一化学人教版(2019)必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 11:15:39 | ||
图片预览






文档简介
(共19张PPT)
第3课时 发展中的化学电源
第一节 化学反应与能量变化
必修第二册 第六章 化学反应与能量
【课堂导入】
生活中用到各种各样的电池
电池
将化学能转换成电能的装置
将太阳能转换成电能的装置
将放射性同位素自然衰变时
产生的热能通过热能转换器
转变为电能的装置
化学电池
太阳能电池
原子能电池
常见的电池种类
化学电池
一次电池
二次电池
燃料电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池
铅蓄电池
锌银蓄电池
镍镉电池
锂离子电池
普通干电池
碱性锌锰电池
锌银纽扣电池
目前化学电池主要分哪几大类?
一、普通锌锰干电池(一次电池)
常见的锌锰干电池的构造如图所示。其中,石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2 +2MnO(OH)
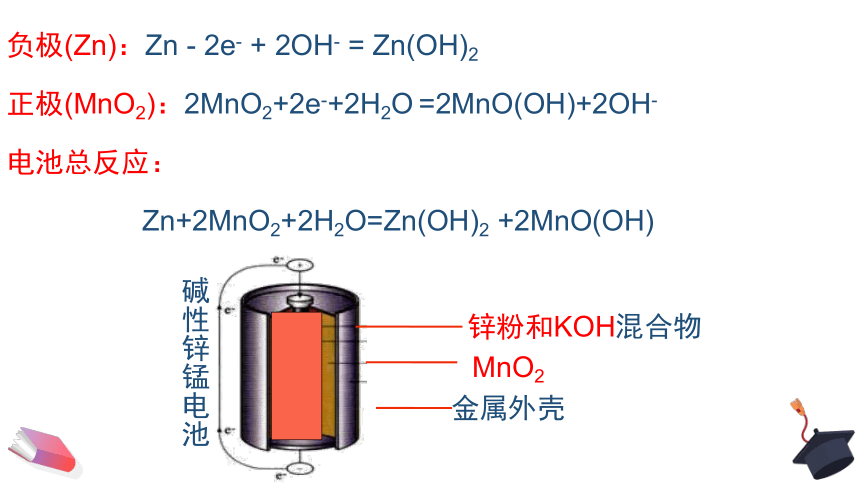
体积小、性能好的碱性锌-锰干电池应运而生。这类电池的重要特征是电解液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
碱性锌锰干电池
碱性锌锰电池
锌粉和KOH混合物
MnO2
金属外壳
负极(Zn):Zn - 2e- + 2OH- = Zn(OH)2
正极(MnO2):2MnO2+2e-+2H2O =2MnO(OH)+2OH-
电池总反应:
Zn+2MnO2+2H2O=Zn(OH)2 +2MnO(OH)
正极:Ag2O + H2O+ 2e- ==2Ag+2OH-
负极:Zn +2OH-2e- ==Zn(OH)2
总反应:Zn+Ag2O+H2O==Zn(OH)2+2Ag
锌银纽扣电池
既可充电又可放电。如:铅蓄电池、手机锂电池等。
二.二次电池
铅蓄电池
正极材料上涂有棕褐色的PbO2,负极材料是海绵状的金属铅,两极浸在H2SO4溶液中。
写出电极反应式。
正极:PbO2
负极:Pb
电解质:H2SO4溶液
铅蓄电池为可充电电池,其电极反应分为放电和充电两个过程。
放电过程总反应:
Pb+PbO2+2H2SO4==2PbSO4+2H2O
Pb+ SO42- -2e- ==PbSO4
正极:
PbO2+ 4H++SO42- +2e- ==2PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程
PbSO4 +2e- ==Pb + SO42-
阴极:
阳极:
2PbSO4 +2H2O -2e- == PbO2 + 4H+ + SO42-
充电过程总反应:
2PbSO4+2H2O==Pb+PbO2+2H2SO4
②充电过程
氧化反应
还原反应
接电源负极
接电源正极
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
Pb+PbO2+2H2SO4 2PbSO4+2H2O
充电
Pb+PbO2+2H2SO4 2PbSO4+2H2O
充电
三.燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
氢氧燃料电池
1.电池材料
正极室:通氧气
负极室:通氢气
电解质:H2SO4溶液
(氧化剂)
(燃料)
使用铂电极
2.工作原理
总反应:2H2 + O2 = 2H2O
负极:2H2 - 4e- = 2H+
正极:O2 + 4H+ +4e- = 2H2O
介质 电池反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
氢氧燃料电池
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
O2 + 2H2O + 4e-== 4OH-
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
1. 燃料电池的规律:
2. 燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
甲烷燃料电池(CH4、O2)
甲烷电池 H2SO4作电解质 KOH作电解质
负极
正极
总反应式
CH4+ 2H2O -8e- = CO2+ 8H+
2O2 + 8H+ + 8e- = 4H2O
2O2 + 8e- + 4H2O = 8OH-
CH4 + 2O2 = CO2 + 2H2O
CH4 + 10OH- -8e- = CO32-+ 7H2O
CH4 + 2O2 +2OH- = CO32- + 3H2O
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
四.电池的污染与回收
3.电池的回收
废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
防止重金属离子污染环境如Hg2+,Cd2+
回收利用
有色金属
节约资源
第3课时 发展中的化学电源
第一节 化学反应与能量变化
必修第二册 第六章 化学反应与能量
【课堂导入】
生活中用到各种各样的电池
电池
将化学能转换成电能的装置
将太阳能转换成电能的装置
将放射性同位素自然衰变时
产生的热能通过热能转换器
转变为电能的装置
化学电池
太阳能电池
原子能电池
常见的电池种类
化学电池
一次电池
二次电池
燃料电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池
铅蓄电池
锌银蓄电池
镍镉电池
锂离子电池
普通干电池
碱性锌锰电池
锌银纽扣电池
目前化学电池主要分哪几大类?
一、普通锌锰干电池(一次电池)
常见的锌锰干电池的构造如图所示。其中,石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2 +2MnO(OH)
体积小、性能好的碱性锌-锰干电池应运而生。这类电池的重要特征是电解液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
碱性锌锰干电池
碱性锌锰电池
锌粉和KOH混合物
MnO2
金属外壳
负极(Zn):Zn - 2e- + 2OH- = Zn(OH)2
正极(MnO2):2MnO2+2e-+2H2O =2MnO(OH)+2OH-
电池总反应:
Zn+2MnO2+2H2O=Zn(OH)2 +2MnO(OH)
正极:Ag2O + H2O+ 2e- ==2Ag+2OH-
负极:Zn +2OH-2e- ==Zn(OH)2
总反应:Zn+Ag2O+H2O==Zn(OH)2+2Ag
锌银纽扣电池
既可充电又可放电。如:铅蓄电池、手机锂电池等。
二.二次电池
铅蓄电池
正极材料上涂有棕褐色的PbO2,负极材料是海绵状的金属铅,两极浸在H2SO4溶液中。
写出电极反应式。
正极:PbO2
负极:Pb
电解质:H2SO4溶液
铅蓄电池为可充电电池,其电极反应分为放电和充电两个过程。
放电过程总反应:
Pb+PbO2+2H2SO4==2PbSO4+2H2O
Pb+ SO42- -2e- ==PbSO4
正极:
PbO2+ 4H++SO42- +2e- ==2PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程
PbSO4 +2e- ==Pb + SO42-
阴极:
阳极:
2PbSO4 +2H2O -2e- == PbO2 + 4H+ + SO42-
充电过程总反应:
2PbSO4+2H2O==Pb+PbO2+2H2SO4
②充电过程
氧化反应
还原反应
接电源负极
接电源正极
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
Pb+PbO2+2H2SO4 2PbSO4+2H2O
充电
Pb+PbO2+2H2SO4 2PbSO4+2H2O
充电
三.燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
氢氧燃料电池
1.电池材料
正极室:通氧气
负极室:通氢气
电解质:H2SO4溶液
(氧化剂)
(燃料)
使用铂电极
2.工作原理
总反应:2H2 + O2 = 2H2O
负极:2H2 - 4e- = 2H+
正极:O2 + 4H+ +4e- = 2H2O
介质 电池反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
氢氧燃料电池
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
O2 + 2H2O + 4e-== 4OH-
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
1. 燃料电池的规律:
2. 燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
甲烷燃料电池(CH4、O2)
甲烷电池 H2SO4作电解质 KOH作电解质
负极
正极
总反应式
CH4+ 2H2O -8e- = CO2+ 8H+
2O2 + 8H+ + 8e- = 4H2O
2O2 + 8e- + 4H2O = 8OH-
CH4 + 2O2 = CO2 + 2H2O
CH4 + 10OH- -8e- = CO32-+ 7H2O
CH4 + 2O2 +2OH- = CO32- + 3H2O
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
四.电池的污染与回收
3.电池的回收
废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
防止重金属离子污染环境如Hg2+,Cd2+
回收利用
有色金属
节约资源
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
