第六章实验活动6:化学能转化为电能(教学课件)(共48张PPT)-2022-2023学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章实验活动6:化学能转化为电能(教学课件)(共48张PPT)-2022-2023学年高一化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 17:59:36 | ||
图片预览











文档简介
(共48张PPT)
高一—人教版—化学—必修第二册—第六单元
第六章 化学反应与能量
实验活动6 化学能转化成电能
学习目标
1.通过实验感受化学能转化成电能的过程。
2.认识形成原电池的条件。
3.总结原电池构成要素,促进深度思维发展养成良好实验素养。
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
原电池的构成要素:
前境知识回顾
1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的
价值。
2.认识原电池的构成要素及其作用。
3.培养科学探究过程中“控制变量”的思想方法。
4.了解手持技术数字化实验在探究实验中的应用。
实验目的
实验用品
1.稀硫酸、烧杯、导线、电流表。
2.锌片、铜片、石墨棒。
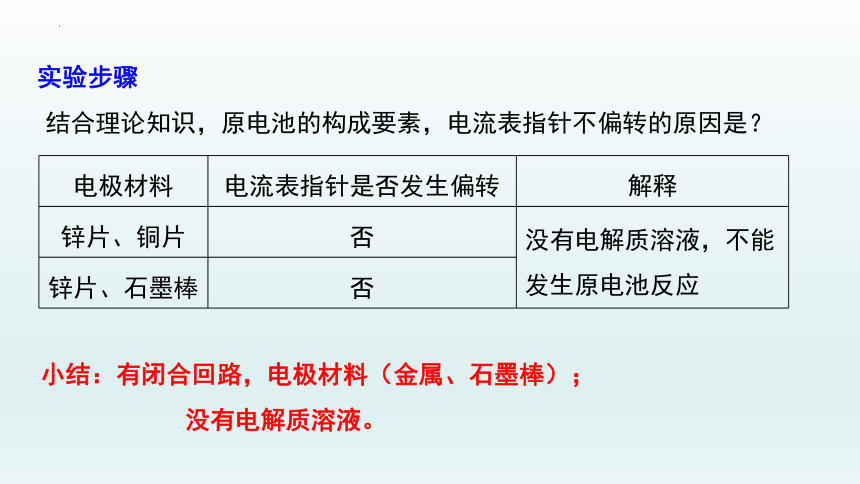
实验步骤
1.电极材料的实验
(1)用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。预测电流表指针是否发生偏转。
电极材料 预测电流表指针是否发生偏转
锌片、铜片
锌片、石墨棒
实验步骤
电极材料 电流表指针是否发生偏转 实验现象及结论
锌片、铜片 否
实验步骤
电极材料 电流表指针是否发生偏转 实验现象及结论
锌片、石墨棒 否
实验步骤
电极材料 电流表指针是否发生偏转 解释
锌片、铜片 否 没有电解质溶液,不能发生原电池反应
锌片、石墨棒 否
结合理论知识,原电池的构成要素,电流表指针不偏转的原因是?
小结:有闭合回路,电极材料(金属、石墨棒);
没有电解质溶液。
(2)将锌片插入稀硫酸的烧杯中,预测实验现象。
实验装置 实验现象
(2)将锌片插入稀硫酸的烧杯中,再插入铜片,预测实验现象。
实验装置 实验现象
(2)取出铜片,插入石墨棒,继续预测实验现象。
实验装置 实验现象
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
锌的还原性比H2强,溶液中的H+直接得到Zn失去的电子生成H2。
锌片溶解,表面产生无色气泡。
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
铜的还原性比H2弱,不能
置换出H2,H+在锌片表面被还原成H2。
①锌片溶解,表面产生无色气泡;
②铜片表面无明显现象
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
石墨为惰性材料,不能
置换出H2,H+在锌片表面被还原成H2。
①锌片溶解,表面产生无色气泡;
②石墨棒表面无明显现象。
(2)总结三个装置的实验现象,解释原因。
实验装置1 实验装置2 实验装置3
小结:有电解质溶液,自发进行的氧化还原反应,
电极材料(金属、石墨棒);没有闭合回路。
2.原电池实验
按如图所示进行实验装置连接,选择不同的
电极材料,进行三组实验探究,预测实验现象。
实验材料 实验现象
Zn、Cu、H2SO4
Zn、石墨、H2SO4
Cu、石墨、H2SO4
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
锌失去的电子通过导线转移至铜片表面产生电流,溶液中的H+在铜片表面获得电子生成H2。
①锌片溶解;
②铜片表面产生无色气泡;
③电流表指针偏转。
Zn Cu
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
锌失去的电子通过导线转移至石墨棒表面产生电流,溶液中的H+在石墨棒表面获得电子
生成H2。
①锌片溶解;
②石墨棒表面产生无色气泡;
③电流表指针偏转。
Zn 石墨
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
铜片的还原性比H2弱,不能发生自发氧化还原反应,没有电子转移,因而不能产生电流。
①铜片不溶解;
②电流表指针不偏转。
Cu 石墨
1.指出右图原电池实验中铜锌原电池的电极名称,并写出电极反应和电池总反应。
答案 Zn:负极,Zn-2e-===Zn2+;
Cu:正极,2H++2e-===H2↑;
电池总反应:Zn+2H+===Zn2++H2↑。
图片来源于网络
问题讨论
2.将原电池实验中锌-铜片原电池中的锌片换成铁片,能否形成电流?若能产生电流,写出电极反应和电池总反应。
答案 能产生电流。
负极:Fe-2e-===Fe2+;
正极:2H++2e-===H2↑;
电池总反应:Fe+2H+===Fe2++H2↑。
3.同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题] 影响自制电池效果的因素有哪些?
[查阅资源] 电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究] Ⅰ.按如图连接水果电池。
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
(1)实验①②③的目的是______________________________。对比实验①②③得出的结论是 _____ ____________ ____。
探究电极材料对电池效果的影响
在其他条件相同时,电极材料活泼性差别越大,
电池效果越好
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验____(填序号)。对比④⑤得出的结论是___________________________
____________________ _________。
①④
在其他条件相同时,电极间距
越小,电流越大,电池效果越好
思考与交流
影响原电池的电流大小的因素
1.电极材料活泼性差异
2.两电极之间的距离
3.水果的种类 (电解质溶液的类型)
4.电解质溶液的浓度
5.电极材料与电解质溶液接触的表面积
。。。。。。
实验目的:两电极之间距离对原电池电流大小的影响
自变量:两电极之间距离
因变量:原电池电流大小
实验观测量:电流的读数(最好动态的图像和曲线)
实验固定量:两电极的材料;电解质溶液的类型;
电解质溶液的浓度;电极材料与电解质溶液接触的表面积。
探究类实验设计思路
每一次实验探究过程中,自变量只能是单一的。
实验编号 两电极 间距离 电极材料 电解质溶液的类型 电解质溶液的浓度 电极与电解液接触面积 电流大小
① 不同 相同 相同 相同 相同 不同
② 不同 相同 相同 相同 相同 不同
③ 不同 相同 相同 相同 相同 不同
两电极之间距离对原电池电流大小的影响
实验目的
实验固定量
自变量
因变量
两电极之间距离对原电池电流大小的影响
实验目的
自变量
两电极间距离
因变量
电流大小
如何实现动态连续曲线的绘制呢?
我们可以采用手持技术数字化实验来实现这一目的。
什么是手持技术数字化实验?
随着科学技术的进步,中学化学实验也引进现代化的测试方法,
例如:手持数字化技术,又称为掌上实验,是由计算机和微电子技术
相结合的新型数字化实验手段,主要包括:数据采集器、传感器、
计算机及配套软件三个部分组成。
工作流程:
实验用品:计算机、原电池实验器、连接线、USB数据线、数据采集器、锌电极、铜电极、多量程电流传感器
探究1:两电极之间的距离对原电池电流大小的影响
探究1:两电极之间的距离对原电池电流大小的影响
探究2:电解质溶液的浓度对原电池电流大小的影响
探究2:电解质溶液的浓度对原电池电流大小的影响
探究3:电极反应的表面积对原电池电流大小的影响
探究3:电极反应的表面积对原电池电流大小的影响
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),使用手持技术数字化实验,测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。
O~t1时,原电池的负极是Al片,此时,正极的电极反应式是____________
___________________,溶液中的H+向______移动;t1时,原电池中电子流动方向发生改变,其原因是__________________________________
______________________。
+e-===NO2↑+H2O
正极
Al在浓硝酸中发生钝化,形成的氧化
膜阻止了Al进一步反应
解析 正极上 得电子发生还原反应,故电极反应式为2H++ +
e-===NO2↑+H2O;由图2可知t1时刻电流方向改变,说明原电池的正、负极发生变化,Al因为在浓硝酸中发生钝化不再进一步反应,则t1时刻后Cu片与浓HNO3反应,Cu片作负极,Al片作正极。
课堂小结
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
1.原电池的构成要素
实验探究的方式感受:
3.影响电流大小的因素 (手持技术数字化传感器)
2.科学探究过程中要有“控制变量”的思想方法
1.在如图所示的8个装置中,属于原电池的是( )
A.④⑦ B.③④⑤ C.②④⑧ D.①④⑥
解析:
①中只有一个电极,不能形成原电池;
②、⑥中两电极未相连,没有形成闭合回路,不能形成原电池;
③、⑧中电极相同,而且没有形成闭合回路,不能形成原电池;
⑤中酒精不是电解质溶液,没有形成闭合回路,不能形成原电池。
1.在如图所示的8个装置中,属于原电池的是( )
A
2.下列叙述中正确的是( )
A.原电池的负极得到电子,发生还原反应
B.原电池中较活泼的金属作正极
C.原电池中的电极一定是两种不同的金属
D.原电池中发生氧化反应的电极是负极
D
解析:
原电池的负极失去电子,发生氧化反应,故A错误,D正确;在原电池中,一般是较活泼的金属作负极,故B错误;
原电池的两个电极可以是两种不同的金属,也可以是金属和导电的非金属,故C错误。
C
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Zn Cu ZnCl2溶液
C Cu Zn CuSO4溶液
D Cu Zn ZnSO4溶液
3.一个原电池的总反应的离子方程式是 Zn+Cu2+===Zn2++Cu,
利用该反应设计成的原电池的正确组成是( )
4.下列有关锌锰干电池的说法正确的是( )
A.锌外壳是负极,石墨棒是正极材料
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
A
解析 A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;
B项,在外电路中电子从锌外壳流向石墨棒,故错误;
C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;
D项,电池内部,阳离子向正极(石墨棒)移动,故错误。
5.如图为发光二极管连接柠檬电池装置,下列说法正确的是
A.铁环作为柠檬电池的正极
B.电流由铁环经导线流向发光二极管
C.负极的电极反应为Fe-2e-===Fe2+
D.可将柠檬替换成盛装乙醇溶液的装置
1
2
3
4
5
解析 铜线、铁环插入柠檬,制成柠檬电池,由于活泼性:Fe>Cu,所以铜线是柠檬电池的正极,铁环是柠檬电池的负极,故A项错误;
电子由负极铁环经导线流向发光二极管,再由发光二极管流向铜线,故B项错误;
负极发生氧化反应,电极反应为Fe-2e-===Fe2+,故C项正确;
乙醇溶液为非电解质溶液,不能将柠檬替换成盛装乙醇溶液的装置,故D项错误。
高一—人教版—化学—必修第二册—第六单元
第六章 化学反应与能量
实验活动6 化学能转化成电能
学习目标
1.通过实验感受化学能转化成电能的过程。
2.认识形成原电池的条件。
3.总结原电池构成要素,促进深度思维发展养成良好实验素养。
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
原电池的构成要素:
前境知识回顾
1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的
价值。
2.认识原电池的构成要素及其作用。
3.培养科学探究过程中“控制变量”的思想方法。
4.了解手持技术数字化实验在探究实验中的应用。
实验目的
实验用品
1.稀硫酸、烧杯、导线、电流表。
2.锌片、铜片、石墨棒。
实验步骤
1.电极材料的实验
(1)用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。预测电流表指针是否发生偏转。
电极材料 预测电流表指针是否发生偏转
锌片、铜片
锌片、石墨棒
实验步骤
电极材料 电流表指针是否发生偏转 实验现象及结论
锌片、铜片 否
实验步骤
电极材料 电流表指针是否发生偏转 实验现象及结论
锌片、石墨棒 否
实验步骤
电极材料 电流表指针是否发生偏转 解释
锌片、铜片 否 没有电解质溶液,不能发生原电池反应
锌片、石墨棒 否
结合理论知识,原电池的构成要素,电流表指针不偏转的原因是?
小结:有闭合回路,电极材料(金属、石墨棒);
没有电解质溶液。
(2)将锌片插入稀硫酸的烧杯中,预测实验现象。
实验装置 实验现象
(2)将锌片插入稀硫酸的烧杯中,再插入铜片,预测实验现象。
实验装置 实验现象
(2)取出铜片,插入石墨棒,继续预测实验现象。
实验装置 实验现象
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
锌的还原性比H2强,溶液中的H+直接得到Zn失去的电子生成H2。
锌片溶解,表面产生无色气泡。
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
铜的还原性比H2弱,不能
置换出H2,H+在锌片表面被还原成H2。
①锌片溶解,表面产生无色气泡;
②铜片表面无明显现象
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
石墨为惰性材料,不能
置换出H2,H+在锌片表面被还原成H2。
①锌片溶解,表面产生无色气泡;
②石墨棒表面无明显现象。
(2)总结三个装置的实验现象,解释原因。
实验装置1 实验装置2 实验装置3
小结:有电解质溶液,自发进行的氧化还原反应,
电极材料(金属、石墨棒);没有闭合回路。
2.原电池实验
按如图所示进行实验装置连接,选择不同的
电极材料,进行三组实验探究,预测实验现象。
实验材料 实验现象
Zn、Cu、H2SO4
Zn、石墨、H2SO4
Cu、石墨、H2SO4
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
锌失去的电子通过导线转移至铜片表面产生电流,溶液中的H+在铜片表面获得电子生成H2。
①锌片溶解;
②铜片表面产生无色气泡;
③电流表指针偏转。
Zn Cu
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
锌失去的电子通过导线转移至石墨棒表面产生电流,溶液中的H+在石墨棒表面获得电子
生成H2。
①锌片溶解;
②石墨棒表面产生无色气泡;
③电流表指针偏转。
Zn 石墨
(2)按如图所示的装置实验,观察实验现象并解释原因。
实验装置 实验现象 解释
铜片的还原性比H2弱,不能发生自发氧化还原反应,没有电子转移,因而不能产生电流。
①铜片不溶解;
②电流表指针不偏转。
Cu 石墨
1.指出右图原电池实验中铜锌原电池的电极名称,并写出电极反应和电池总反应。
答案 Zn:负极,Zn-2e-===Zn2+;
Cu:正极,2H++2e-===H2↑;
电池总反应:Zn+2H+===Zn2++H2↑。
图片来源于网络
问题讨论
2.将原电池实验中锌-铜片原电池中的锌片换成铁片,能否形成电流?若能产生电流,写出电极反应和电池总反应。
答案 能产生电流。
负极:Fe-2e-===Fe2+;
正极:2H++2e-===H2↑;
电池总反应:Fe+2H+===Fe2++H2↑。
3.同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题] 影响自制电池效果的因素有哪些?
[查阅资源] 电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究] Ⅰ.按如图连接水果电池。
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
(1)实验①②③的目的是______________________________。对比实验①②③得出的结论是 _____ ____________ ____。
探究电极材料对电池效果的影响
在其他条件相同时,电极材料活泼性差别越大,
电池效果越好
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验____(填序号)。对比④⑤得出的结论是___________________________
____________________ _________。
①④
在其他条件相同时,电极间距
越小,电流越大,电池效果越好
思考与交流
影响原电池的电流大小的因素
1.电极材料活泼性差异
2.两电极之间的距离
3.水果的种类 (电解质溶液的类型)
4.电解质溶液的浓度
5.电极材料与电解质溶液接触的表面积
。。。。。。
实验目的:两电极之间距离对原电池电流大小的影响
自变量:两电极之间距离
因变量:原电池电流大小
实验观测量:电流的读数(最好动态的图像和曲线)
实验固定量:两电极的材料;电解质溶液的类型;
电解质溶液的浓度;电极材料与电解质溶液接触的表面积。
探究类实验设计思路
每一次实验探究过程中,自变量只能是单一的。
实验编号 两电极 间距离 电极材料 电解质溶液的类型 电解质溶液的浓度 电极与电解液接触面积 电流大小
① 不同 相同 相同 相同 相同 不同
② 不同 相同 相同 相同 相同 不同
③ 不同 相同 相同 相同 相同 不同
两电极之间距离对原电池电流大小的影响
实验目的
实验固定量
自变量
因变量
两电极之间距离对原电池电流大小的影响
实验目的
自变量
两电极间距离
因变量
电流大小
如何实现动态连续曲线的绘制呢?
我们可以采用手持技术数字化实验来实现这一目的。
什么是手持技术数字化实验?
随着科学技术的进步,中学化学实验也引进现代化的测试方法,
例如:手持数字化技术,又称为掌上实验,是由计算机和微电子技术
相结合的新型数字化实验手段,主要包括:数据采集器、传感器、
计算机及配套软件三个部分组成。
工作流程:
实验用品:计算机、原电池实验器、连接线、USB数据线、数据采集器、锌电极、铜电极、多量程电流传感器
探究1:两电极之间的距离对原电池电流大小的影响
探究1:两电极之间的距离对原电池电流大小的影响
探究2:电解质溶液的浓度对原电池电流大小的影响
探究2:电解质溶液的浓度对原电池电流大小的影响
探究3:电极反应的表面积对原电池电流大小的影响
探究3:电极反应的表面积对原电池电流大小的影响
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),使用手持技术数字化实验,测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。
O~t1时,原电池的负极是Al片,此时,正极的电极反应式是____________
___________________,溶液中的H+向______移动;t1时,原电池中电子流动方向发生改变,其原因是__________________________________
______________________。
+e-===NO2↑+H2O
正极
Al在浓硝酸中发生钝化,形成的氧化
膜阻止了Al进一步反应
解析 正极上 得电子发生还原反应,故电极反应式为2H++ +
e-===NO2↑+H2O;由图2可知t1时刻电流方向改变,说明原电池的正、负极发生变化,Al因为在浓硝酸中发生钝化不再进一步反应,则t1时刻后Cu片与浓HNO3反应,Cu片作负极,Al片作正极。
课堂小结
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
1.原电池的构成要素
实验探究的方式感受:
3.影响电流大小的因素 (手持技术数字化传感器)
2.科学探究过程中要有“控制变量”的思想方法
1.在如图所示的8个装置中,属于原电池的是( )
A.④⑦ B.③④⑤ C.②④⑧ D.①④⑥
解析:
①中只有一个电极,不能形成原电池;
②、⑥中两电极未相连,没有形成闭合回路,不能形成原电池;
③、⑧中电极相同,而且没有形成闭合回路,不能形成原电池;
⑤中酒精不是电解质溶液,没有形成闭合回路,不能形成原电池。
1.在如图所示的8个装置中,属于原电池的是( )
A
2.下列叙述中正确的是( )
A.原电池的负极得到电子,发生还原反应
B.原电池中较活泼的金属作正极
C.原电池中的电极一定是两种不同的金属
D.原电池中发生氧化反应的电极是负极
D
解析:
原电池的负极失去电子,发生氧化反应,故A错误,D正确;在原电池中,一般是较活泼的金属作负极,故B错误;
原电池的两个电极可以是两种不同的金属,也可以是金属和导电的非金属,故C错误。
C
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Zn Cu ZnCl2溶液
C Cu Zn CuSO4溶液
D Cu Zn ZnSO4溶液
3.一个原电池的总反应的离子方程式是 Zn+Cu2+===Zn2++Cu,
利用该反应设计成的原电池的正确组成是( )
4.下列有关锌锰干电池的说法正确的是( )
A.锌外壳是负极,石墨棒是正极材料
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
A
解析 A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;
B项,在外电路中电子从锌外壳流向石墨棒,故错误;
C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;
D项,电池内部,阳离子向正极(石墨棒)移动,故错误。
5.如图为发光二极管连接柠檬电池装置,下列说法正确的是
A.铁环作为柠檬电池的正极
B.电流由铁环经导线流向发光二极管
C.负极的电极反应为Fe-2e-===Fe2+
D.可将柠檬替换成盛装乙醇溶液的装置
1
2
3
4
5
解析 铜线、铁环插入柠檬,制成柠檬电池,由于活泼性:Fe>Cu,所以铜线是柠檬电池的正极,铁环是柠檬电池的负极,故A项错误;
电子由负极铁环经导线流向发光二极管,再由发光二极管流向铜线,故B项错误;
负极发生氧化反应,电极反应为Fe-2e-===Fe2+,故C项正确;
乙醇溶液为非电解质溶液,不能将柠檬替换成盛装乙醇溶液的装置,故D项错误。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
