5.1.1 硫和二氧化硫(教学课件)(共20张PPT)——2022-2023学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.1 硫和二氧化硫(教学课件)(共20张PPT)——2022-2023学年高一化学人教版(2019)必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 18:01:42 | ||
图片预览




文档简介
(共20张PPT)
葡萄酒是我们常见的酒品之一,在配料表中我们会发现有二氧化硫,为什么它会出现在葡萄酒中呢?它的作用是什么呢?
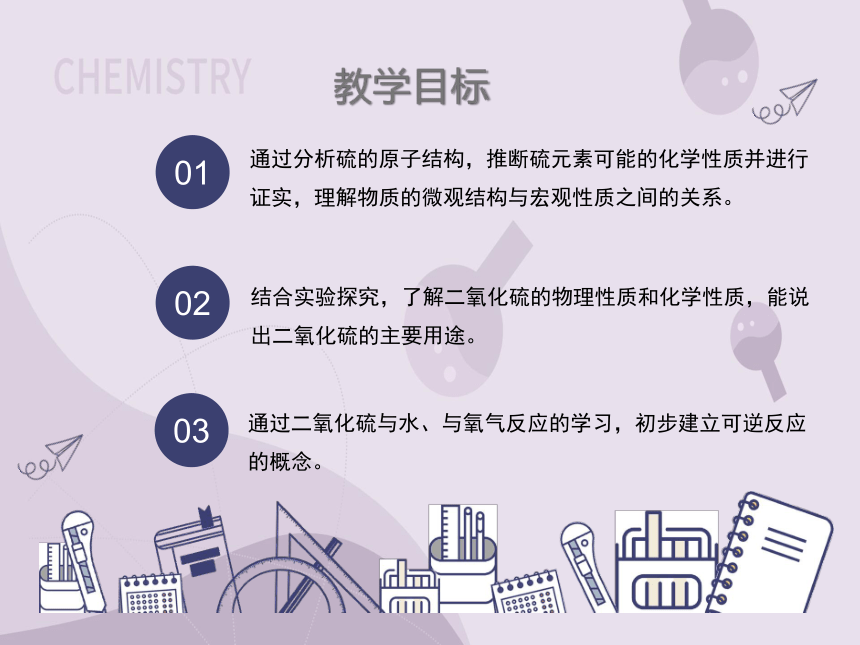
通过分析硫的原子结构,推断硫元素可能的化学性质并进行证实,理解物质的微观结构与宏观性质之间的关系。
01
结合实验探究,了解二氧化硫的物理性质和化学性质,能说出二氧化硫的主要用途。
02
通过二氧化硫与水、与氧气反应的学习,初步建立可逆反应的概念。
03
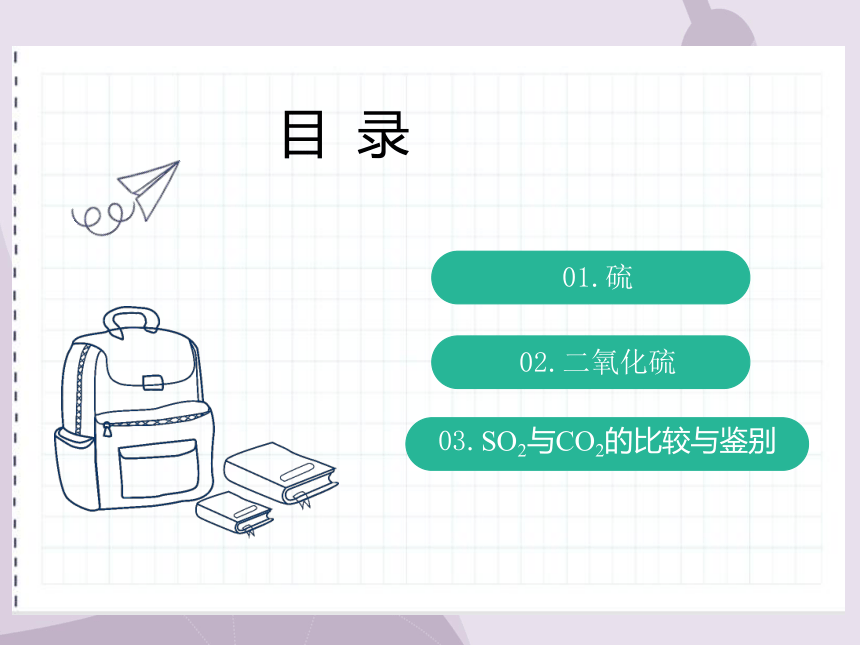
目 录
01.硫
02.二氧化硫
03.SO2与CO2的比较与鉴别
硫
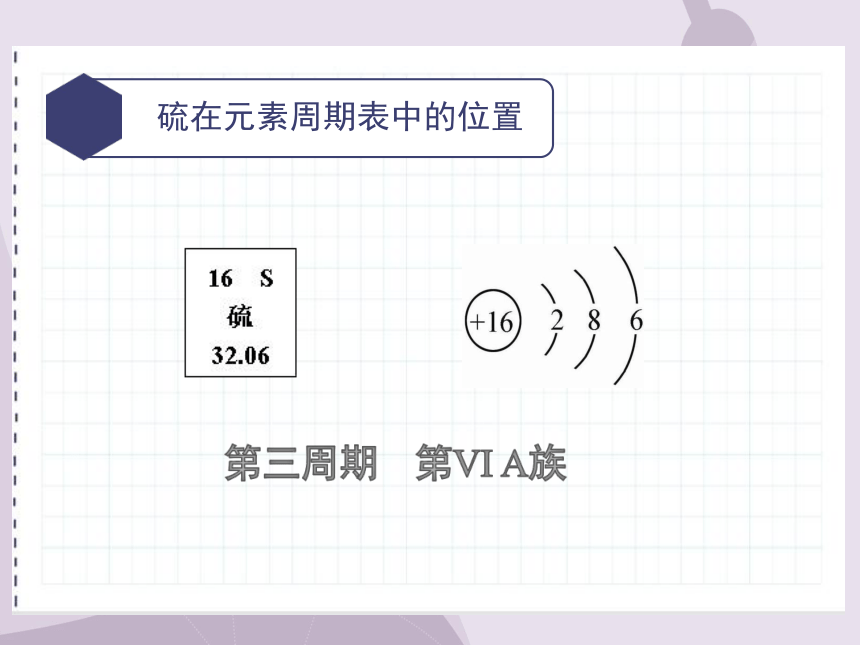
硫在元素周期表中的位置
硫的物理性质
颜色 状态 密度 熔点 沸点 溶解度
黄色 固体,质脆 2.06 g·cm-3 113 ℃ 445 ℃ 难溶于水
微溶于酒精
易溶于CS2
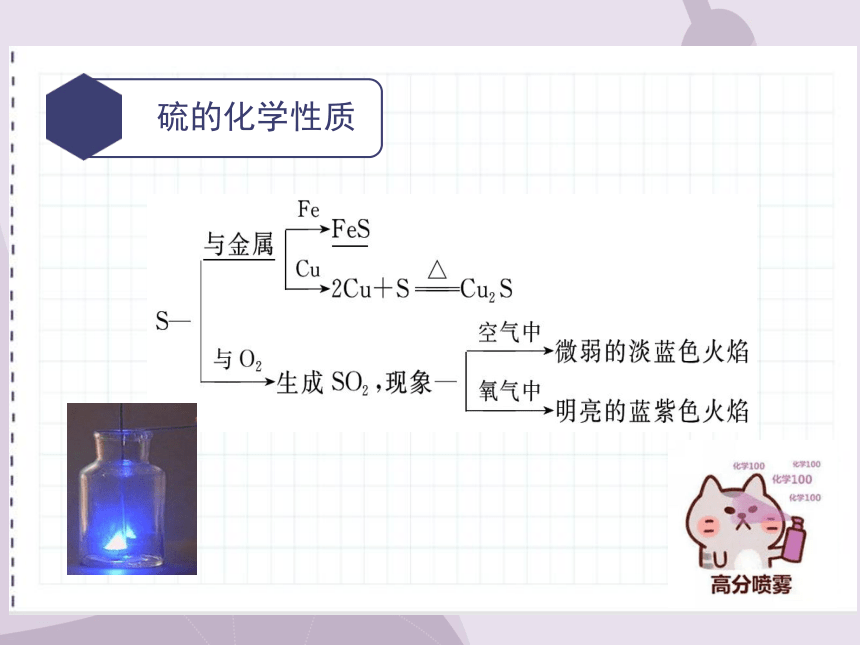
硫的化学性质
二氧化硫
二氧化硫的物理性质
状 态:气体
颜 色:无色
气 味:有刺激性
沸 点:-10 ℃
毒 性:有毒
密 度:比空气大
溶解度:易溶于水,在常温、常压下,1体积水大约能溶解40体积的SO2
二氧化硫的化学性质
2. 与氧化物反应:SO2+Ca(OH)2=CaSO3↓+H2O
CaSO3+SO2+H2O=Ca(HSO3)2
3. 与NaOH反应: SO2+2NaOH==Na2SO3+H2O
SO2+NaOH==NaHSO3
4. 还原性:
5SO2+2KMnO4+2H2O==K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O==H2SO4+2HBr
5. 氧化性:SO2+2H2S====3S↓+2H2O
类型 漂白原理 漂白特点 变化类型 举例
氧化型 漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色 褪色后不会恢复原色 化学变化 HClO、Na2O2、O3、H2O2等
化合型 漂白剂与某些有色物质发生化合反应而使其褪色 一定条件下发生分解,又恢复原色 化学变化 SO2
吸附型 某些固体物质具有疏松多孔的结构,能吸附有色物质 —— 物理变化 活性炭等
二氧化硫的主要用途
1.
2.漂白纸浆、毛、丝、草帽等
3.杀菌消毒
二氧化硫的危害
SO2与CO2的比较与鉴别
SO2与CO2的性质比较
SO2 CO2
相同点 常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2===CaSO3↓+H2O
CaSO3+SO2+H2O===Ca(HSO3)2 Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O===Ca(HCO3)2
不同点 有刺激性气味,有毒 无味,无毒
易溶于水 可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化 无还原性
具有漂白性,能使品红溶液褪色 没有漂白性
酸性:H2SO3>H2CO3
常见的CO2、SO2的鉴别方法
试剂 现象及结论
品红溶液 使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸 出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液 使紫色退去的是SO2,无明显现象的是CO2
溴水 使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉) 使蓝色退去的是SO2,无明显现象的是CO2
谢谢观看
葡萄酒是我们常见的酒品之一,在配料表中我们会发现有二氧化硫,为什么它会出现在葡萄酒中呢?它的作用是什么呢?
通过分析硫的原子结构,推断硫元素可能的化学性质并进行证实,理解物质的微观结构与宏观性质之间的关系。
01
结合实验探究,了解二氧化硫的物理性质和化学性质,能说出二氧化硫的主要用途。
02
通过二氧化硫与水、与氧气反应的学习,初步建立可逆反应的概念。
03
目 录
01.硫
02.二氧化硫
03.SO2与CO2的比较与鉴别
硫
硫在元素周期表中的位置
硫的物理性质
颜色 状态 密度 熔点 沸点 溶解度
黄色 固体,质脆 2.06 g·cm-3 113 ℃ 445 ℃ 难溶于水
微溶于酒精
易溶于CS2
硫的化学性质
二氧化硫
二氧化硫的物理性质
状 态:气体
颜 色:无色
气 味:有刺激性
沸 点:-10 ℃
毒 性:有毒
密 度:比空气大
溶解度:易溶于水,在常温、常压下,1体积水大约能溶解40体积的SO2
二氧化硫的化学性质
2. 与氧化物反应:SO2+Ca(OH)2=CaSO3↓+H2O
CaSO3+SO2+H2O=Ca(HSO3)2
3. 与NaOH反应: SO2+2NaOH==Na2SO3+H2O
SO2+NaOH==NaHSO3
4. 还原性:
5SO2+2KMnO4+2H2O==K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O==H2SO4+2HBr
5. 氧化性:SO2+2H2S====3S↓+2H2O
类型 漂白原理 漂白特点 变化类型 举例
氧化型 漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色 褪色后不会恢复原色 化学变化 HClO、Na2O2、O3、H2O2等
化合型 漂白剂与某些有色物质发生化合反应而使其褪色 一定条件下发生分解,又恢复原色 化学变化 SO2
吸附型 某些固体物质具有疏松多孔的结构,能吸附有色物质 —— 物理变化 活性炭等
二氧化硫的主要用途
1.
2.漂白纸浆、毛、丝、草帽等
3.杀菌消毒
二氧化硫的危害
SO2与CO2的比较与鉴别
SO2与CO2的性质比较
SO2 CO2
相同点 常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2===CaSO3↓+H2O
CaSO3+SO2+H2O===Ca(HSO3)2 Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O===Ca(HCO3)2
不同点 有刺激性气味,有毒 无味,无毒
易溶于水 可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化 无还原性
具有漂白性,能使品红溶液褪色 没有漂白性
酸性:H2SO3>H2CO3
常见的CO2、SO2的鉴别方法
试剂 现象及结论
品红溶液 使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸 出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液 使紫色退去的是SO2,无明显现象的是CO2
溴水 使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉) 使蓝色退去的是SO2,无明显现象的是CO2
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
