5.3无机非金属材料(教学课件)(共28张PPT)-2022-2023学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.3无机非金属材料(教学课件)(共28张PPT)-2022-2023学年高一化学人教版(2019)必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 18:02:52 | ||
图片预览




文档简介
(共28张PPT)
组织建设
第三节 无机非金属材料
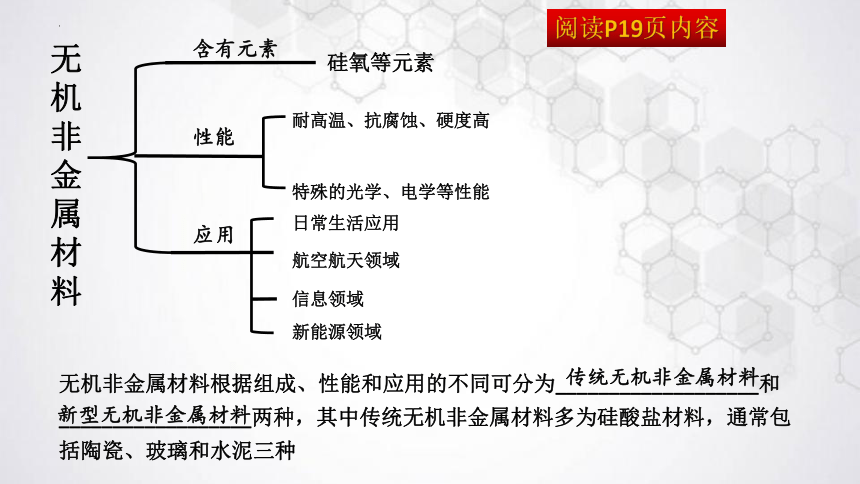
无机非金属材料
硅氧等元素
耐高温、抗腐蚀、硬度高
特殊的光学、电学等性能
日常生活应用
航空航天领域
信息领域
新能源领域
无机非金属材料根据组成、性能和应用的不同可分为___________________和__________________两种,其中传统无机非金属材料多为硅酸盐材料,通常包括陶瓷、玻璃和水泥三种
传统无机非金属材料
新型无机非金属材料
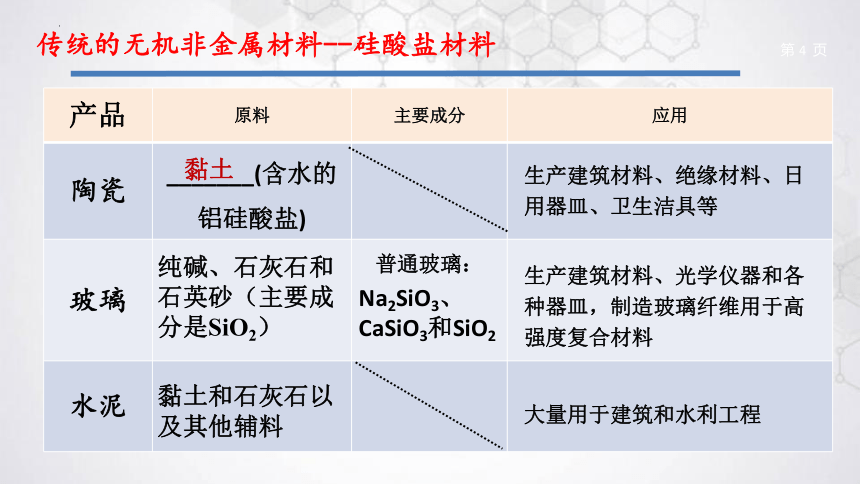
传统的无机非金属材料--硅酸盐材料
传统的无机非金属材料--硅酸盐材料
产品 原料 主要成分 应用
陶瓷 _______(含水的铝硅酸盐)
玻璃 普通玻璃:
水泥
生产建筑材料、绝缘材料、日用器皿、卫生洁具等
纯碱、石灰石和石英砂(主要成分是SiO2)
Na2SiO3、CaSiO3和SiO2
生产建筑材料、光学仪器和各种器皿,制造玻璃纤维用于高强度复合材料
黏土和石灰石以及其他辅料
大量用于建筑和水利工程
为什么硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点?
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点
新型无机非金属材料
一、硅和二氧化硅
二、新型陶瓷
三、碳纳米材料
新型无机非金属材料
一、硅和二氧化硅
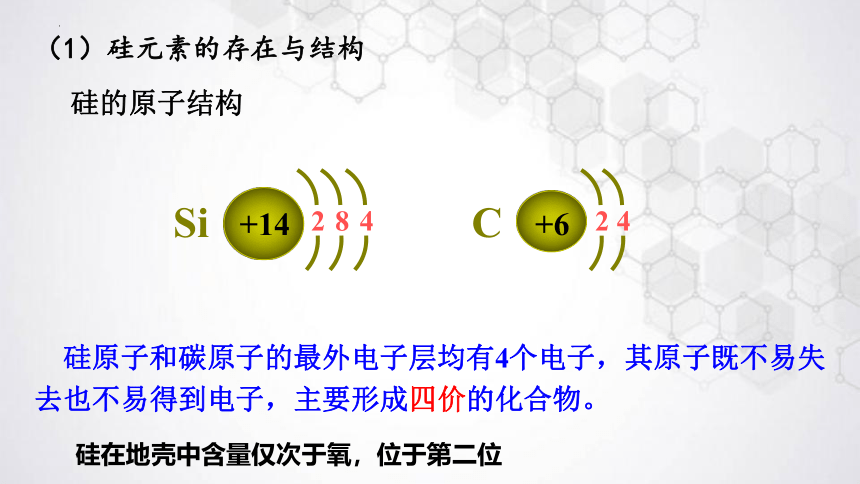
(1)硅元素的存在与结构
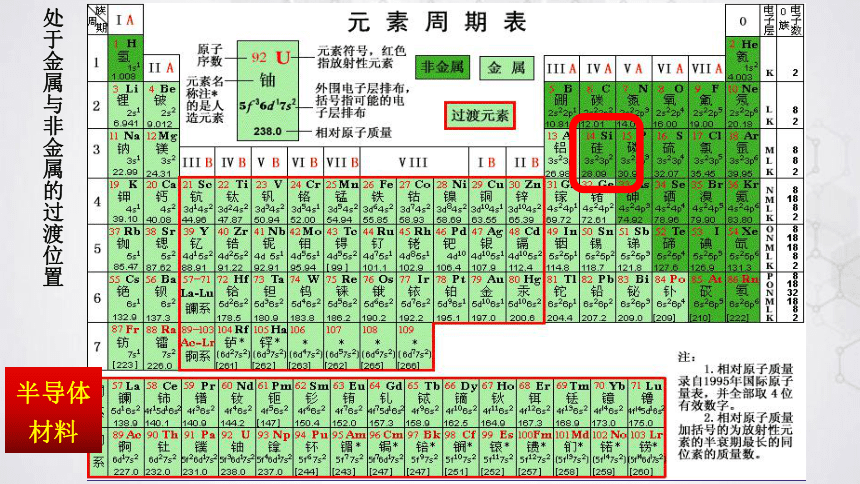
翻看元素周期表,找出硅元素的位置,画出其原子结构示意图,并与碳原子比较。
处于金属与非金属的过渡位置
半导体材料
硅的原子结构
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成四价的化合物。
Si
+14
8
4
2
+6
4
2
C
(1)硅元素的存在与结构
硅在地壳中含量仅次于氧,位于第二位
通过下列图片总结归纳出硅元素在自然界中的存在形式吗?
思考交流
硅的存在形式
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
碳—统治有机界:碳是构成有机物的主要元素。
硅—统治无机矿物界:硅是构成岩石与许多矿物的基本元素。
硅的制备
⑴SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
⑵Si+3HCl == SiHCl3+H2
高温
⑶SiHCl3+H2 == Si+3HCl (高纯硅)
高温
若C过量: SiO2+3C == SiC + 2CO ↑
高温
碳化硅(俗名:金刚砂)
工业上用焦炭还原石英砂可知制得含有少量杂质的粗硅
提纯
如何制备高纯度的硅?
硅的制备
SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
知识点补充
晶体硅的用途
集成电路
晶体管
Si导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
硅太阳能电池
电脑中央处理器(CPU)
价值5元的沙子
SiO2
Si
价值5000元的芯片
点沙 成金
从沙滩到用户
晶体硅的用途
SiO2的晶体结构
晶体Si的结构
硅和SiO2都是正四面体结构性质很稳定
二氧化硅
二氧化硅( SiO2)的晶体结构
物理性质:
难溶于水,熔点高,硬度大。
化学稳定性:
化学性质很稳定,不活泼。
二氧化硅( SiO2)存在形式
结晶形(石英晶体)
无定形——硅藻土
水晶
玛瑙
二氧化硅的存在
内容解读
二氧化硅的用途
SiO2的网状结构决定了它具有优良的物理和化学性质,加上SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。
光导纤维(通信)
石英坩埚
玻璃仪器
精美瓷器
P 22
拓展
雕刻玻璃,你会吗?
SiO2+4HF=SiF4↑+2H2O
实验室不用玻璃瓶盛装氢氟酸!!
1、实验室盛NaOH溶液的试剂瓶为什么用橡胶塞不用玻璃塞?
某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物是否正确
不正确。
因为二氧化硅跟氢氟酸反应产物不是盐和水,所以不属于两性氧化物,但是属于酸性氧化物。
思考交流
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,硅酸钠水溶液有粘性,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O
①酸性氧化物
与碱性氧化物反应生成盐
SiO2 + CaO == CaSiO3
化学性质:
高温
与强碱反应生成盐和水
SiO2 + 2NaOH == Na2SiO3 +H2O
③与HF的反应( SiO2的特性)
SiO2 + 4HF = SiF4↑+ 2H2O
②不与水反应
与某些盐的反应
SiO2 + Na2CO3 == Na2SiO3 + CO2↑
高温
新型无机非金属材料
一、硅和二氧化硅
二、新型陶瓷
三、碳纳米材料
二、新型陶瓷
新型陶瓷
组成
特性和功能
不再限于传统的硅酸盐体系
在光学、热学、电学、磁学等方面具有很多新的特性和功能
实例
SiC
俗称
金刚石
具有类似金刚石的结构,硬度很大,可用作砂纸和砂轮的磨料
具有优异的高温抗氧化性能,使用温度可达1600℃,可用作耐高温结构材料、耐高温半导体材料
阅读P23新型陶瓷
新型无机非金属材料
一、硅和二氧化硅
二、新型陶瓷
三、碳纳米材料
三、碳纳米材料
碳纳米材料
富勒烯
碳纳米管
由碳原子构成的一系列笼形分子的总称,代表物C60
开启了碳纳米材料研究和应用的新时代
是由石墨片层卷成的管状物
有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
石墨烯
只有一个碳原子直径厚度的单层石墨
电阻率低,热导率高,具有很高的强度。应用于光电器件、超级电容器、电池和复合材料等方面
当堂巩固
1、地壳中含量第一和第二的两种元素所形成的化合物不具有的性质
是( )
A.熔点很高 B.与水反应生成对应的酸
C.可与烧碱反应生成盐 D.坚硬
2、要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
A.纯碱溶液 B.盐酸 C.硫酸 D.苛性钠溶液
B
B
3、下列关于无机非金属材料的说法中正确的是 ( )
A.传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料
B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差
C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
【解析】选C。A项中,光导纤维是新型无机非金属材料;B项中,强度比较差是错误的;D项中新型无机非金属材料中的光导纤维、单晶硅等其成分都不是硅酸盐。
4、硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是________。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2和CO2都属于酸性氧化物,性质相似,SiO2与氢氧化钠溶液反应的化学方程式为________,工艺师常用________________ (填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作________。
(4)工业上常利用反应2C+SiO2 Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是______(填化学式,下同),氧化剂是________________。
【解析】(1)生石灰是CaO,为碱性氧化物且不含硅元素,不属于硅酸盐。(2)SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O。由于SiO2能溶于氢氟酸,因此工艺师常用氢氟酸来雕刻玻璃。(3)Na2SiO3水溶液又称“水玻璃”,具有阻燃的功能,因此可用作防火剂。(4)题给反应中C(碳)被氧化,SiO2中+4价的硅被还原,因此SiO2作氧化剂。
组织建设
第三节 无机非金属材料
无机非金属材料
硅氧等元素
耐高温、抗腐蚀、硬度高
特殊的光学、电学等性能
日常生活应用
航空航天领域
信息领域
新能源领域
无机非金属材料根据组成、性能和应用的不同可分为___________________和__________________两种,其中传统无机非金属材料多为硅酸盐材料,通常包括陶瓷、玻璃和水泥三种
传统无机非金属材料
新型无机非金属材料
传统的无机非金属材料--硅酸盐材料
传统的无机非金属材料--硅酸盐材料
产品 原料 主要成分 应用
陶瓷 _______(含水的铝硅酸盐)
玻璃 普通玻璃:
水泥
生产建筑材料、绝缘材料、日用器皿、卫生洁具等
纯碱、石灰石和石英砂(主要成分是SiO2)
Na2SiO3、CaSiO3和SiO2
生产建筑材料、光学仪器和各种器皿,制造玻璃纤维用于高强度复合材料
黏土和石灰石以及其他辅料
大量用于建筑和水利工程
为什么硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点?
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点
新型无机非金属材料
一、硅和二氧化硅
二、新型陶瓷
三、碳纳米材料
新型无机非金属材料
一、硅和二氧化硅
(1)硅元素的存在与结构
翻看元素周期表,找出硅元素的位置,画出其原子结构示意图,并与碳原子比较。
处于金属与非金属的过渡位置
半导体材料
硅的原子结构
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成四价的化合物。
Si
+14
8
4
2
+6
4
2
C
(1)硅元素的存在与结构
硅在地壳中含量仅次于氧,位于第二位
通过下列图片总结归纳出硅元素在自然界中的存在形式吗?
思考交流
硅的存在形式
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
碳—统治有机界:碳是构成有机物的主要元素。
硅—统治无机矿物界:硅是构成岩石与许多矿物的基本元素。
硅的制备
⑴SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
⑵Si+3HCl == SiHCl3+H2
高温
⑶SiHCl3+H2 == Si+3HCl (高纯硅)
高温
若C过量: SiO2+3C == SiC + 2CO ↑
高温
碳化硅(俗名:金刚砂)
工业上用焦炭还原石英砂可知制得含有少量杂质的粗硅
提纯
如何制备高纯度的硅?
硅的制备
SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
知识点补充
晶体硅的用途
集成电路
晶体管
Si导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
硅太阳能电池
电脑中央处理器(CPU)
价值5元的沙子
SiO2
Si
价值5000元的芯片
点沙 成金
从沙滩到用户
晶体硅的用途
SiO2的晶体结构
晶体Si的结构
硅和SiO2都是正四面体结构性质很稳定
二氧化硅
二氧化硅( SiO2)的晶体结构
物理性质:
难溶于水,熔点高,硬度大。
化学稳定性:
化学性质很稳定,不活泼。
二氧化硅( SiO2)存在形式
结晶形(石英晶体)
无定形——硅藻土
水晶
玛瑙
二氧化硅的存在
内容解读
二氧化硅的用途
SiO2的网状结构决定了它具有优良的物理和化学性质,加上SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。
光导纤维(通信)
石英坩埚
玻璃仪器
精美瓷器
P 22
拓展
雕刻玻璃,你会吗?
SiO2+4HF=SiF4↑+2H2O
实验室不用玻璃瓶盛装氢氟酸!!
1、实验室盛NaOH溶液的试剂瓶为什么用橡胶塞不用玻璃塞?
某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物是否正确
不正确。
因为二氧化硅跟氢氟酸反应产物不是盐和水,所以不属于两性氧化物,但是属于酸性氧化物。
思考交流
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,硅酸钠水溶液有粘性,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O
①酸性氧化物
与碱性氧化物反应生成盐
SiO2 + CaO == CaSiO3
化学性质:
高温
与强碱反应生成盐和水
SiO2 + 2NaOH == Na2SiO3 +H2O
③与HF的反应( SiO2的特性)
SiO2 + 4HF = SiF4↑+ 2H2O
②不与水反应
与某些盐的反应
SiO2 + Na2CO3 == Na2SiO3 + CO2↑
高温
新型无机非金属材料
一、硅和二氧化硅
二、新型陶瓷
三、碳纳米材料
二、新型陶瓷
新型陶瓷
组成
特性和功能
不再限于传统的硅酸盐体系
在光学、热学、电学、磁学等方面具有很多新的特性和功能
实例
SiC
俗称
金刚石
具有类似金刚石的结构,硬度很大,可用作砂纸和砂轮的磨料
具有优异的高温抗氧化性能,使用温度可达1600℃,可用作耐高温结构材料、耐高温半导体材料
阅读P23新型陶瓷
新型无机非金属材料
一、硅和二氧化硅
二、新型陶瓷
三、碳纳米材料
三、碳纳米材料
碳纳米材料
富勒烯
碳纳米管
由碳原子构成的一系列笼形分子的总称,代表物C60
开启了碳纳米材料研究和应用的新时代
是由石墨片层卷成的管状物
有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
石墨烯
只有一个碳原子直径厚度的单层石墨
电阻率低,热导率高,具有很高的强度。应用于光电器件、超级电容器、电池和复合材料等方面
当堂巩固
1、地壳中含量第一和第二的两种元素所形成的化合物不具有的性质
是( )
A.熔点很高 B.与水反应生成对应的酸
C.可与烧碱反应生成盐 D.坚硬
2、要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
A.纯碱溶液 B.盐酸 C.硫酸 D.苛性钠溶液
B
B
3、下列关于无机非金属材料的说法中正确的是 ( )
A.传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料
B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差
C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
【解析】选C。A项中,光导纤维是新型无机非金属材料;B项中,强度比较差是错误的;D项中新型无机非金属材料中的光导纤维、单晶硅等其成分都不是硅酸盐。
4、硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是________。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2和CO2都属于酸性氧化物,性质相似,SiO2与氢氧化钠溶液反应的化学方程式为________,工艺师常用________________ (填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作________。
(4)工业上常利用反应2C+SiO2 Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是______(填化学式,下同),氧化剂是________________。
【解析】(1)生石灰是CaO,为碱性氧化物且不含硅元素,不属于硅酸盐。(2)SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O。由于SiO2能溶于氢氟酸,因此工艺师常用氢氟酸来雕刻玻璃。(3)Na2SiO3水溶液又称“水玻璃”,具有阻燃的功能,因此可用作防火剂。(4)题给反应中C(碳)被氧化,SiO2中+4价的硅被还原,因此SiO2作氧化剂。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
