6.1 金属材料的物理特性 同步练习(含答案) 2022-2023学年科粤版九年级下册化学
文档属性
| 名称 | 6.1 金属材料的物理特性 同步练习(含答案) 2022-2023学年科粤版九年级下册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 147.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 00:00:00 | ||
图片预览



文档简介
6.1 金属材料的物理特性 同步练习
一、单选题
1.用小刀切去一小块钠,把放入水中,观察到金属钠浮在水面上,并在水面上迅速游动,熔成一个银白色小球,最后完全消失.根据以上内容不能推知的是( )
A.钠的密度比水小 B.钠在水中能燃烧
C.钠的熔点比较低 D.钠是银白色的固体
2.鉴别下列各组物质所用的试剂或方法,错误的是( )
A.硝酸铵和氯化钠 —— 水
B.硬水和软水 —— 肥皂水
C.纯铝和硬铝 —— 互相刻划
D.氢氧化钠和碳酸钠 —— 酚酞溶液
3.下列有关日常生活、生产中的问题,说法正确的是( )
A.金刚石、石墨和C60都是由碳原子直接构成的物质
B.不锈钢的防锈原理与铁管表面喷油漆的防锈原理相同
C.水能灭火是因为水可以降低可燃物的着火点
D.平时应多吃水果和蔬菜补充人体必需的维生素
4.铁锅可用作炒菜的炊具,主要是利用了铁的( )
A.导热性 B.导电性
C.延展性 D.密度大
5.下列叙述正确的是( )
A.铁是具有黑色光泽的金属
B.铁能导电,电线都是铁制成的
C.用钢铁来制造轮船是因为铁的密度小
D.铁有良好的延展性
6.下列推理正确的是()
A.石蜡在氧气中燃烧生成水和二氧化碳,所以石蜡中一定含有碳元素和氢元素
B.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
C.在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数
D.利用红磷燃烧可测定空气中氧气的含量,铁丝能燃烧,也可测定空气中氧气的含量
7.下列实验现象描述不正确的是( )
A.纯羊毛制品点燃后有烧焦羽毛气味产生
B.黄铜片与铜片互相刻画,黄铜片可以在铜片上画出痕迹
C.硫在空气中燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体
D.将少量熟石灰粉末与硝酸铵固体混合、研磨,能嗅到强烈的刺激性气味
8.下列有关金属及其腐蚀的叙述,正确的是()
A.铝比铁的抗腐蚀性好,是因为其表面易形成致密的氧化物保护膜
B.锌比银活泼,故锌能置换出氯化银中的银
C.生铁是混合物,钢是纯净物
D.铜的化学性质不活泼,故铜器放置在潮湿的空气中不会被腐蚀
9.金属材料在生产、生活中使用广泛。下列金属相关知识正确的是( )
A.铜的导电性最好,常用制导线
B.铝是年产量最大的金属
C.铁生锈的条件是与水和氧气同时接触
D.合金中一定只含金属元素
10.要使飞艇安全飞行,最适合填充的气体是( )
A.氢气 B.氦气 C.氮气 D.氧气
11.下列说法中错误的是( )
A.生铁能完全地溶解在稀硫酸中
B.使燃料充分燃烧通常考虑两点:即有足够的空气和燃料与空气有足够大的接触面积
C.二氧化碳用来灭火的用途,即与其物理性质有关,又与其化学性质有关
D.做一氧化碳还原氧化铁的实验时要进行尾气处理
12.物质的性质决定物质的用途.下列说法错误的是( )
A.干冰升华需吸收大量的热,可用于人工降雨
B.Ca(OH)2能与酸反应,可用于改良酸性土壤
C.甲醛能使蛋白质变性,可用于食用水产品防腐
D.小苏打能与胃液中的盐酸发生反应,可用于治疗胃酸过多
二、填空题
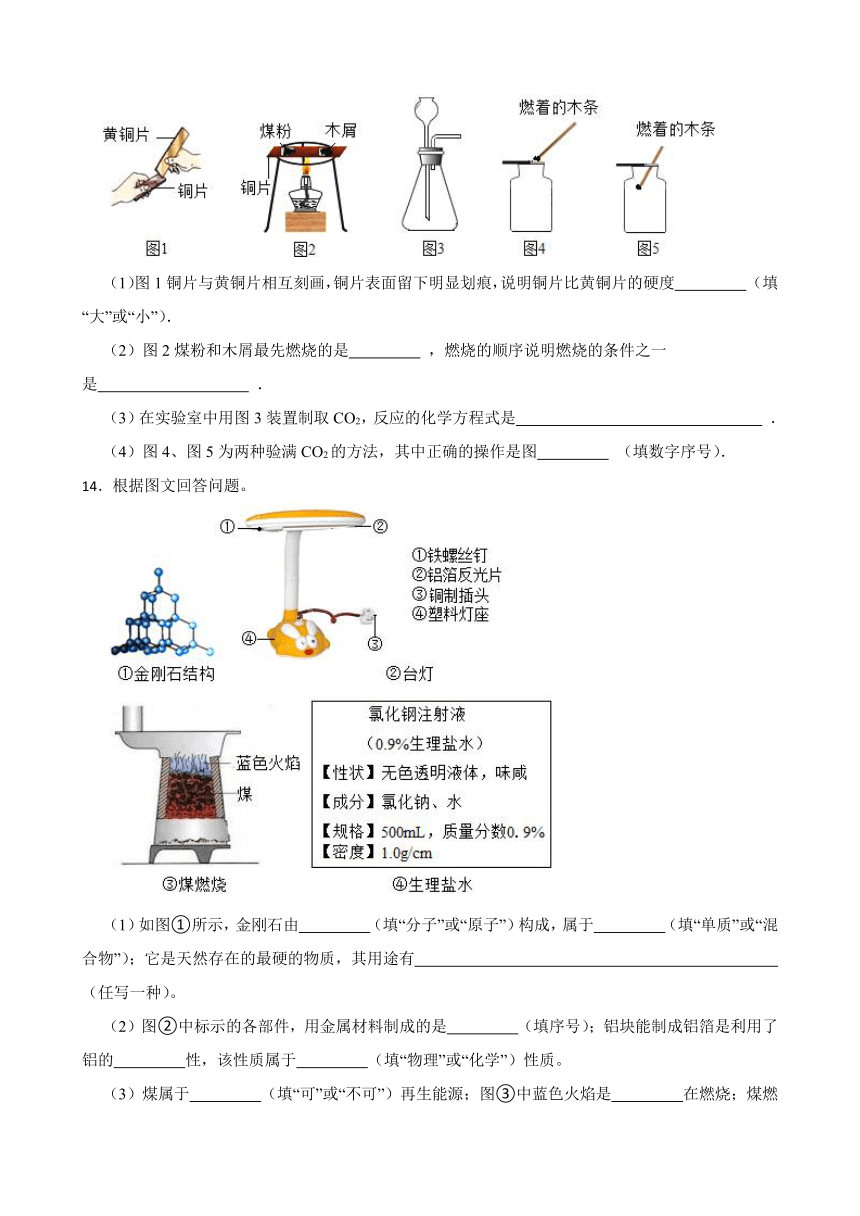
13.根据下列实验示意图,回答问题.
(1)图1铜片与黄铜片相互刻画,铜片表面留下明显划痕,说明铜片比黄铜片的硬度 (填“大”或“小”).
(2)图2煤粉和木屑最先燃烧的是 ,燃烧的顺序说明燃烧的条件之一是 .
(3)在实验室中用图3装置制取CO2,反应的化学方程式是 .
(4)图4、图5为两种验满CO2的方法,其中正确的操作是图 (填数字序号).
14.根据图文回答问题。
(1)如图①所示,金刚石由 (填“分子”或“原子”)构成,属于 (填“单质”或“混合物”);它是天然存在的最硬的物质,其用途有 (任写一种)。
(2)图②中标示的各部件,用金属材料制成的是 (填序号);铝块能制成铝箔是利用了铝的 性,该性质属于 (填“物理”或“化学”)性质。
(3)煤属于 (填“可”或“不可”)再生能源;图③中蓝色火焰是 在燃烧;煤燃烧产生的 等污染物排放到空气中,会形成酸雨。
(4)生理盐水中含有的阴离子主要是 (填粒子符号);如图④,配制该生理盐水需要氯化钠和水的质量分别为 g、 g。
15.厨房中蕴含许多化学知识,请根据下列要求回答问题.
(1)我市人们都很喜欢吃烤肉,其主要食材牛肉中富含的营养物质是 ;
(2)生活中降低水的硬度常用的方法是 ;
(3)现在铁锅越来越受到人们的青睐,用铁锅炒菜主要是利用铁具有良好的 性,同时还可补充人体所需的铁元素,如果铁元素摄入量过少会引起 ;
(4)油锅中的油不慎着火,可用锅盖盖灭,其灭火原理是 ;
(5)餐具上的油污可用洗洁精洗掉,这是利用洗洁精的 (填“溶解”或“乳化”)作用.
16.铬(Cr)是一种重要的金属元素,铬的单质及其化合物应用广泛。
(1)铬桶可以盛装AlCl3溶液,不能盛装稀硫酸,则金属活动性,Cr Al(填“>、<”)。
(2)根据上述信息,能证明Zn和Cr的活动性强弱的试剂组是__________。
A.Zn、Cr和Al2(SO4)3
B.Cr、ZnSO4溶液
C.Cu、ZnSO4溶液、Cr2(SO4)3溶液
(3)Cr2(SO4)3为有毒的重金属盐,可用KOH溶液将铬转化为沉淀而除去,该反应为复分解反应,则反应的化学方程式为 。
17.小李同学在学习了有关维生素的知识后,自制了一张《维生素C》知识小卡片,但不完整,请你帮他填写表中空格的内容.
《维生素C》知识小卡片
分子结构 化学式
相对分子质量
Vc的性质 能溶于水,在加热或碱性环境中易被氧化而破坏
Vc的存在 绿色蔬菜(如黄瓜、生菜)/水果(如柑橘)
食用黄瓜是注意
18.铝在工业和生活中应用广泛.
(1)铝是地壳中含量最高的 (填“金属”或“非金属”)元素,其年产量已跃居第二位.
(2)铝可制成电线,主要是利用其有良好的延展性和 性.
(3)铝制品具有很好的抗腐蚀性能,其原因是 .
三、综合题
19.某实用纯碱中含有少量的氯化钠,为测定该纯碱中碳酸钠( )的含量,现取6g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,消耗稀盐酸39.8g测得反应后溶液总质量为43.6g。
计算:
(1)反应中产生 的质量
(2)纯碱样品中 的质量分数。
20.许多民间手工艺列入国家级非物质遗产。
(1)伏里土陶是枣庄市珍稀民间土陶艺术。陶瓷与玻璃一样都属于 材料。用于绘画的陶瓷板主要成分是氧化锆(ZrO2),请用正确的化学用语表示氧化锆中锆元素的化合价 。
(2)茶俗文化:制作某茶要用到茶叶、花生米、芝麻、糯米等,其中富含糖类的是 。
21.自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容。
项目 标准
感官指标 无异味、异臭等
化学指标 pH6.5~8.5,铜<1.0mg/L,铁<0.3 mg/L,氟化物<1.0mg/L,游离氯 0.3 mg/L等
(1)感官指标表现的是自来水的 性质(填“物理”或“化学”);
(2)自来水属于 (填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是 。
(3)生活中对井水通过 的方法既可以消毒杀菌,也可以降低水的硬度
22.为了从硝酸亚铁和硝酸银的混合溶液中,提取并回收银,小燕设计了如下的实验方案:
(1)若溶液乙为无色溶液,则固体甲一定含有的物质是 ,可能含有的物质是 ,写出一个在步骤①中肯定发生的反应的化学方程式 。
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是 或 (填物质的名称或化学式)。
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】D
4.【答案】A
5.【答案】D
6.【答案】A
7.【答案】C
8.【答案】A
9.【答案】C
10.【答案】B
11.【答案】A
12.【答案】C
13.【答案】小;木屑;温度达到着火点;CaCO3+2HCl=CaCl2+H2O+CO2↑;4
14.【答案】(1)原子;单质;裁玻璃、加工坚硬的金属等(任一合理答案均可)
(2)①②③;延展;物理
(3)不可;CO;SO2、NO2(任写一种均可)
(4)Cl ;4.5;495.5
15.【答案】蛋白质;加热煮沸;导热;缺铁性贫血;隔绝氧气;乳化
16.【答案】(1)<
(2)B
(3)
17.【答案】C6H8O6;176;最好生食或在酸性条件下使用
18.【答案】金属;导电;铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜
19.【答案】(1)解:反应中产生CO2的质量为6g+39.8g 43.6g=2.2g
答:反应中产生CO2的质量为2.2g
(2)解:设纯碱样品中碳酸钠的质量分数为x
Na2CO3+ 2HCl= 2NaCl+H2O+ CO2↑
106 44
6gx 2.2g
106:44=6gx:2.2g
x≈88.3%
答:纯碱样品中碳酸钠的质量分数为88.3%
20.【答案】(1)无机非金属;
(2)糯米
21.【答案】(1)物理
(2)混合物;Cl-
(3)煮沸
22.【答案】(1)铁、银;锌;Zn+Fe(NO3)2═Zn(NO3)2+Fe(或Zn+2AgNO3═Zn(NO3)2+2Ag)
(2)Zn(NO3)2、Fe(NO3)2;Zn(NO3)2、Fe(NO3)2、AgNO3
一、单选题
1.用小刀切去一小块钠,把放入水中,观察到金属钠浮在水面上,并在水面上迅速游动,熔成一个银白色小球,最后完全消失.根据以上内容不能推知的是( )
A.钠的密度比水小 B.钠在水中能燃烧
C.钠的熔点比较低 D.钠是银白色的固体
2.鉴别下列各组物质所用的试剂或方法,错误的是( )
A.硝酸铵和氯化钠 —— 水
B.硬水和软水 —— 肥皂水
C.纯铝和硬铝 —— 互相刻划
D.氢氧化钠和碳酸钠 —— 酚酞溶液
3.下列有关日常生活、生产中的问题,说法正确的是( )
A.金刚石、石墨和C60都是由碳原子直接构成的物质
B.不锈钢的防锈原理与铁管表面喷油漆的防锈原理相同
C.水能灭火是因为水可以降低可燃物的着火点
D.平时应多吃水果和蔬菜补充人体必需的维生素
4.铁锅可用作炒菜的炊具,主要是利用了铁的( )
A.导热性 B.导电性
C.延展性 D.密度大
5.下列叙述正确的是( )
A.铁是具有黑色光泽的金属
B.铁能导电,电线都是铁制成的
C.用钢铁来制造轮船是因为铁的密度小
D.铁有良好的延展性
6.下列推理正确的是()
A.石蜡在氧气中燃烧生成水和二氧化碳,所以石蜡中一定含有碳元素和氢元素
B.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
C.在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数
D.利用红磷燃烧可测定空气中氧气的含量,铁丝能燃烧,也可测定空气中氧气的含量
7.下列实验现象描述不正确的是( )
A.纯羊毛制品点燃后有烧焦羽毛气味产生
B.黄铜片与铜片互相刻画,黄铜片可以在铜片上画出痕迹
C.硫在空气中燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体
D.将少量熟石灰粉末与硝酸铵固体混合、研磨,能嗅到强烈的刺激性气味
8.下列有关金属及其腐蚀的叙述,正确的是()
A.铝比铁的抗腐蚀性好,是因为其表面易形成致密的氧化物保护膜
B.锌比银活泼,故锌能置换出氯化银中的银
C.生铁是混合物,钢是纯净物
D.铜的化学性质不活泼,故铜器放置在潮湿的空气中不会被腐蚀
9.金属材料在生产、生活中使用广泛。下列金属相关知识正确的是( )
A.铜的导电性最好,常用制导线
B.铝是年产量最大的金属
C.铁生锈的条件是与水和氧气同时接触
D.合金中一定只含金属元素
10.要使飞艇安全飞行,最适合填充的气体是( )
A.氢气 B.氦气 C.氮气 D.氧气
11.下列说法中错误的是( )
A.生铁能完全地溶解在稀硫酸中
B.使燃料充分燃烧通常考虑两点:即有足够的空气和燃料与空气有足够大的接触面积
C.二氧化碳用来灭火的用途,即与其物理性质有关,又与其化学性质有关
D.做一氧化碳还原氧化铁的实验时要进行尾气处理
12.物质的性质决定物质的用途.下列说法错误的是( )
A.干冰升华需吸收大量的热,可用于人工降雨
B.Ca(OH)2能与酸反应,可用于改良酸性土壤
C.甲醛能使蛋白质变性,可用于食用水产品防腐
D.小苏打能与胃液中的盐酸发生反应,可用于治疗胃酸过多
二、填空题
13.根据下列实验示意图,回答问题.
(1)图1铜片与黄铜片相互刻画,铜片表面留下明显划痕,说明铜片比黄铜片的硬度 (填“大”或“小”).
(2)图2煤粉和木屑最先燃烧的是 ,燃烧的顺序说明燃烧的条件之一是 .
(3)在实验室中用图3装置制取CO2,反应的化学方程式是 .
(4)图4、图5为两种验满CO2的方法,其中正确的操作是图 (填数字序号).
14.根据图文回答问题。
(1)如图①所示,金刚石由 (填“分子”或“原子”)构成,属于 (填“单质”或“混合物”);它是天然存在的最硬的物质,其用途有 (任写一种)。
(2)图②中标示的各部件,用金属材料制成的是 (填序号);铝块能制成铝箔是利用了铝的 性,该性质属于 (填“物理”或“化学”)性质。
(3)煤属于 (填“可”或“不可”)再生能源;图③中蓝色火焰是 在燃烧;煤燃烧产生的 等污染物排放到空气中,会形成酸雨。
(4)生理盐水中含有的阴离子主要是 (填粒子符号);如图④,配制该生理盐水需要氯化钠和水的质量分别为 g、 g。
15.厨房中蕴含许多化学知识,请根据下列要求回答问题.
(1)我市人们都很喜欢吃烤肉,其主要食材牛肉中富含的营养物质是 ;
(2)生活中降低水的硬度常用的方法是 ;
(3)现在铁锅越来越受到人们的青睐,用铁锅炒菜主要是利用铁具有良好的 性,同时还可补充人体所需的铁元素,如果铁元素摄入量过少会引起 ;
(4)油锅中的油不慎着火,可用锅盖盖灭,其灭火原理是 ;
(5)餐具上的油污可用洗洁精洗掉,这是利用洗洁精的 (填“溶解”或“乳化”)作用.
16.铬(Cr)是一种重要的金属元素,铬的单质及其化合物应用广泛。
(1)铬桶可以盛装AlCl3溶液,不能盛装稀硫酸,则金属活动性,Cr Al(填“>、<”)。
(2)根据上述信息,能证明Zn和Cr的活动性强弱的试剂组是__________。
A.Zn、Cr和Al2(SO4)3
B.Cr、ZnSO4溶液
C.Cu、ZnSO4溶液、Cr2(SO4)3溶液
(3)Cr2(SO4)3为有毒的重金属盐,可用KOH溶液将铬转化为沉淀而除去,该反应为复分解反应,则反应的化学方程式为 。
17.小李同学在学习了有关维生素的知识后,自制了一张《维生素C》知识小卡片,但不完整,请你帮他填写表中空格的内容.
《维生素C》知识小卡片
分子结构 化学式
相对分子质量
Vc的性质 能溶于水,在加热或碱性环境中易被氧化而破坏
Vc的存在 绿色蔬菜(如黄瓜、生菜)/水果(如柑橘)
食用黄瓜是注意
18.铝在工业和生活中应用广泛.
(1)铝是地壳中含量最高的 (填“金属”或“非金属”)元素,其年产量已跃居第二位.
(2)铝可制成电线,主要是利用其有良好的延展性和 性.
(3)铝制品具有很好的抗腐蚀性能,其原因是 .
三、综合题
19.某实用纯碱中含有少量的氯化钠,为测定该纯碱中碳酸钠( )的含量,现取6g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,消耗稀盐酸39.8g测得反应后溶液总质量为43.6g。
计算:
(1)反应中产生 的质量
(2)纯碱样品中 的质量分数。
20.许多民间手工艺列入国家级非物质遗产。
(1)伏里土陶是枣庄市珍稀民间土陶艺术。陶瓷与玻璃一样都属于 材料。用于绘画的陶瓷板主要成分是氧化锆(ZrO2),请用正确的化学用语表示氧化锆中锆元素的化合价 。
(2)茶俗文化:制作某茶要用到茶叶、花生米、芝麻、糯米等,其中富含糖类的是 。
21.自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容。
项目 标准
感官指标 无异味、异臭等
化学指标 pH6.5~8.5,铜<1.0mg/L,铁<0.3 mg/L,氟化物<1.0mg/L,游离氯 0.3 mg/L等
(1)感官指标表现的是自来水的 性质(填“物理”或“化学”);
(2)自来水属于 (填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是 。
(3)生活中对井水通过 的方法既可以消毒杀菌,也可以降低水的硬度
22.为了从硝酸亚铁和硝酸银的混合溶液中,提取并回收银,小燕设计了如下的实验方案:
(1)若溶液乙为无色溶液,则固体甲一定含有的物质是 ,可能含有的物质是 ,写出一个在步骤①中肯定发生的反应的化学方程式 。
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是 或 (填物质的名称或化学式)。
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】D
4.【答案】A
5.【答案】D
6.【答案】A
7.【答案】C
8.【答案】A
9.【答案】C
10.【答案】B
11.【答案】A
12.【答案】C
13.【答案】小;木屑;温度达到着火点;CaCO3+2HCl=CaCl2+H2O+CO2↑;4
14.【答案】(1)原子;单质;裁玻璃、加工坚硬的金属等(任一合理答案均可)
(2)①②③;延展;物理
(3)不可;CO;SO2、NO2(任写一种均可)
(4)Cl ;4.5;495.5
15.【答案】蛋白质;加热煮沸;导热;缺铁性贫血;隔绝氧气;乳化
16.【答案】(1)<
(2)B
(3)
17.【答案】C6H8O6;176;最好生食或在酸性条件下使用
18.【答案】金属;导电;铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜
19.【答案】(1)解:反应中产生CO2的质量为6g+39.8g 43.6g=2.2g
答:反应中产生CO2的质量为2.2g
(2)解:设纯碱样品中碳酸钠的质量分数为x
Na2CO3+ 2HCl= 2NaCl+H2O+ CO2↑
106 44
6gx 2.2g
106:44=6gx:2.2g
x≈88.3%
答:纯碱样品中碳酸钠的质量分数为88.3%
20.【答案】(1)无机非金属;
(2)糯米
21.【答案】(1)物理
(2)混合物;Cl-
(3)煮沸
22.【答案】(1)铁、银;锌;Zn+Fe(NO3)2═Zn(NO3)2+Fe(或Zn+2AgNO3═Zn(NO3)2+2Ag)
(2)Zn(NO3)2、Fe(NO3)2;Zn(NO3)2、Fe(NO3)2、AgNO3
