2.1 酸及其性质 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学
文档属性
| 名称 | 2.1 酸及其性质 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 96.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 09:53:13 | ||
图片预览

文档简介
2.1 酸及其性质 同步练习
一、单选题
1.下列说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质的质量质量分数变大
C.长期露置于空气中的固体氢氧化钠,其成分不会发生变化
D.打开盛浓盐酸的试剂瓶,瓶口会产生白雾
2.生活、生产中处处离不开化学知识,下列说法中,不正确的是( )
A.炒菜时,油锅不慎着火迅速用锅盖盖灭
B.熟石灰可以改良酸性土壤,但不能和硫酸铵混合使用
C.闻到家中煤气泄漏,立即打开排气扇通风
D.启用闲置的地窖前先进行灯火试验
3.“生命至上、安全第一”,为及时发现天然气泄漏,某燃气公司常在天然气中加入少量具有特殊气味的乙硫醇(C2H5SH)。乙硫醇在空气中也能燃烧,反应的化学方程式为: 。下列说法不正确的是( )
A.X的化学式为SO2
B.乙硫醇中硫元素的质量分数最大
C.乙硫醇是混合物
D.乙硫醇分子中碳、氢、硫原子的个数比为2:6: 1
4.分类法是学习化学的一种方法。下列分类方法正确的是( )
A.直接加热的仪器:试管、燃烧匙、蒸发皿
B.大气污染物:NO2、SO2、CO2
C.可燃性气体:H2、O2、CO
D.分子构成的物质:N2、NaCl、H2O
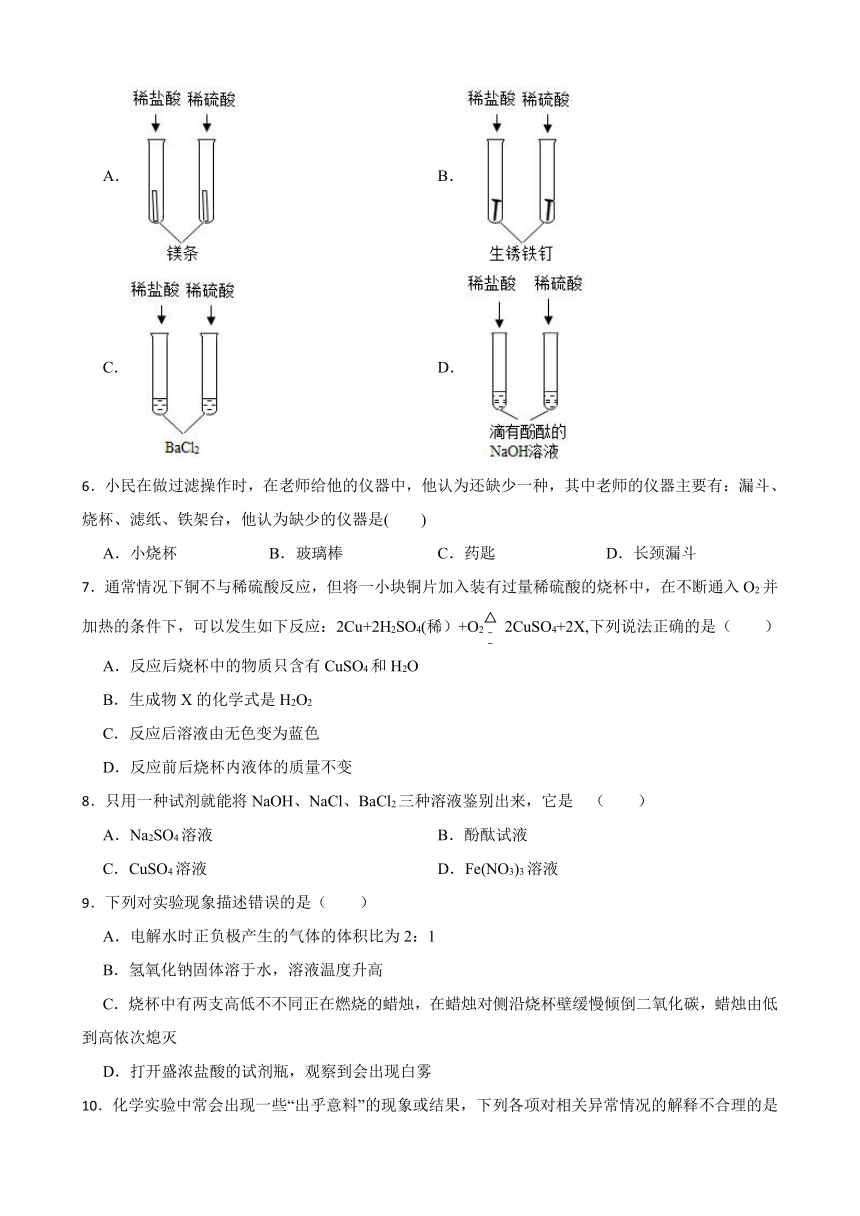
5.下列四组实验中,不能体现酸的通性的是( )
A. B.
C. D.
6.小民在做过滤操作时,在老师给他的仪器中,他认为还缺少一种,其中老师的仪器主要有:漏斗、烧杯、滤纸、铁架台,他认为缺少的仪器是( )
A.小烧杯 B.玻璃棒 C.药匙 D.长颈漏斗
7.通常情况下铜不与稀硫酸反应,但将一小块铜片加入装有过量稀硫酸的烧杯中,在不断通入O2并加热的条件下,可以发生如下反应:2Cu+2H2SO4(稀)+O2 2CuSO4+2X,下列说法正确的是( )
A.反应后烧杯中的物质只含有CuSO4和H2O
B.生成物X的化学式是H2O2
C.反应后溶液由无色变为蓝色
D.反应前后烧杯内液体的质量不变
8.只用一种试剂就能将NaOH、NaCl、BaCl2三种溶液鉴别出来,它是 ( )
A.Na2SO4溶液 B.酚酞试液
C.CuSO4溶液 D.Fe(NO3)3溶液
9.下列对实验现象描述错误的是( )
A.电解水时正负极产生的气体的体积比为2:1
B.氢氧化钠固体溶于水,溶液温度升高
C.烧杯中有两支高低不不同正在燃烧的蜡烛,在蜡烛对侧沿烧杯壁缓慢倾倒二氧化碳,蜡烛由低到高依次熄灭
D.打开盛浓盐酸的试剂瓶,观察到会出现白雾
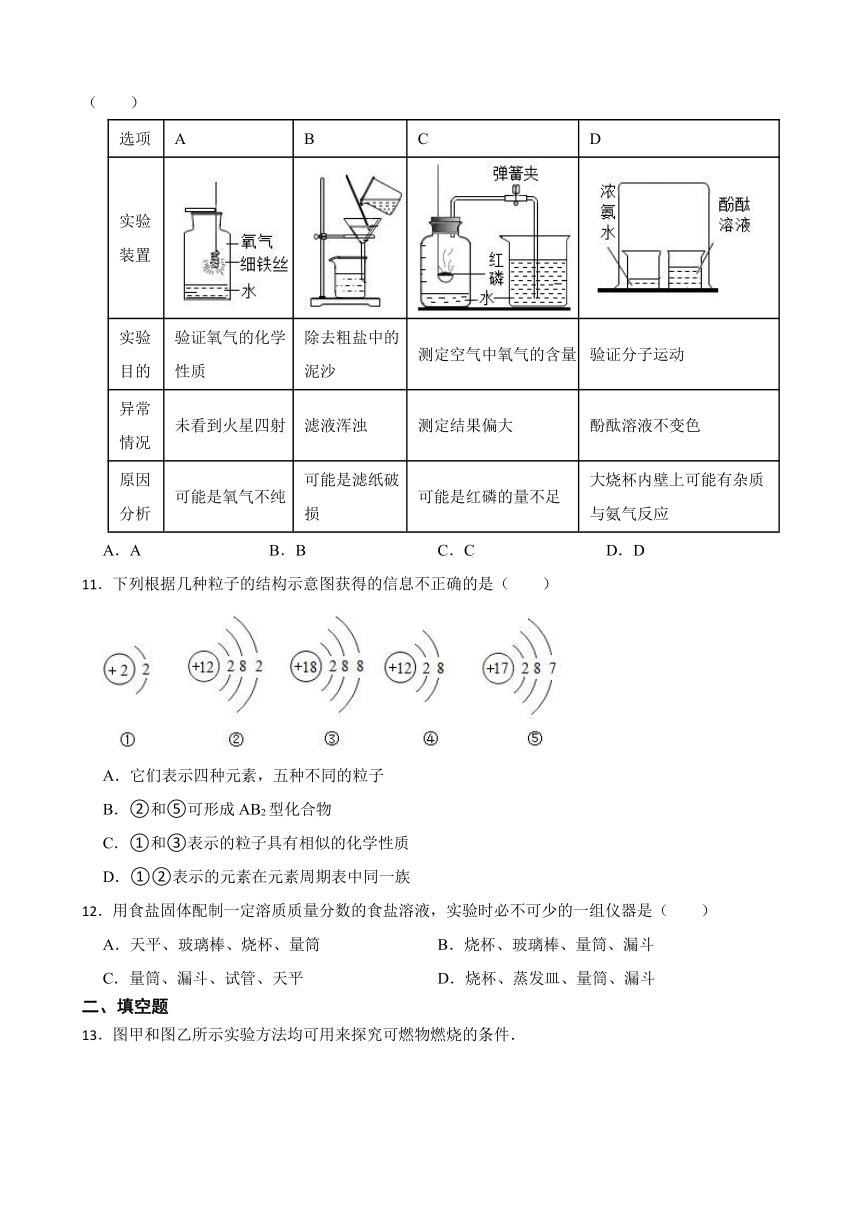
10.化学实验中常会出现一些“出乎意料”的现象或结果,下列各项对相关异常情况的解释不合理的是( )
选项 A B C D
实验装置
实验目的 验证氧气的化学性质 除去粗盐中的泥沙 测定空气中氧气的含量 验证分子运动
异常情况 未看到火星四射 滤液浑浊 测定结果偏大 酚酞溶液不变色
原因分析 可能是氧气不纯 可能是滤纸破损 可能是红磷的量不足 大烧杯内壁上可能有杂质与氨气反应
A.A B.B C.C D.D
11.下列根据几种粒子的结构示意图获得的信息不正确的是( )
A.它们表示四种元素,五种不同的粒子
B.②和⑤可形成AB2型化合物
C.①和③表示的粒子具有相似的化学性质
D.①②表示的元素在元素周期表中同一族
12.用食盐固体配制一定溶质质量分数的食盐溶液,实验时必不可少的一组仪器是( )
A.天平、玻璃棒、烧杯、量筒 B.烧杯、玻璃棒、量筒、漏斗
C.量筒、漏斗、试管、天平 D.烧杯、蒸发皿、量筒、漏斗
二、填空题
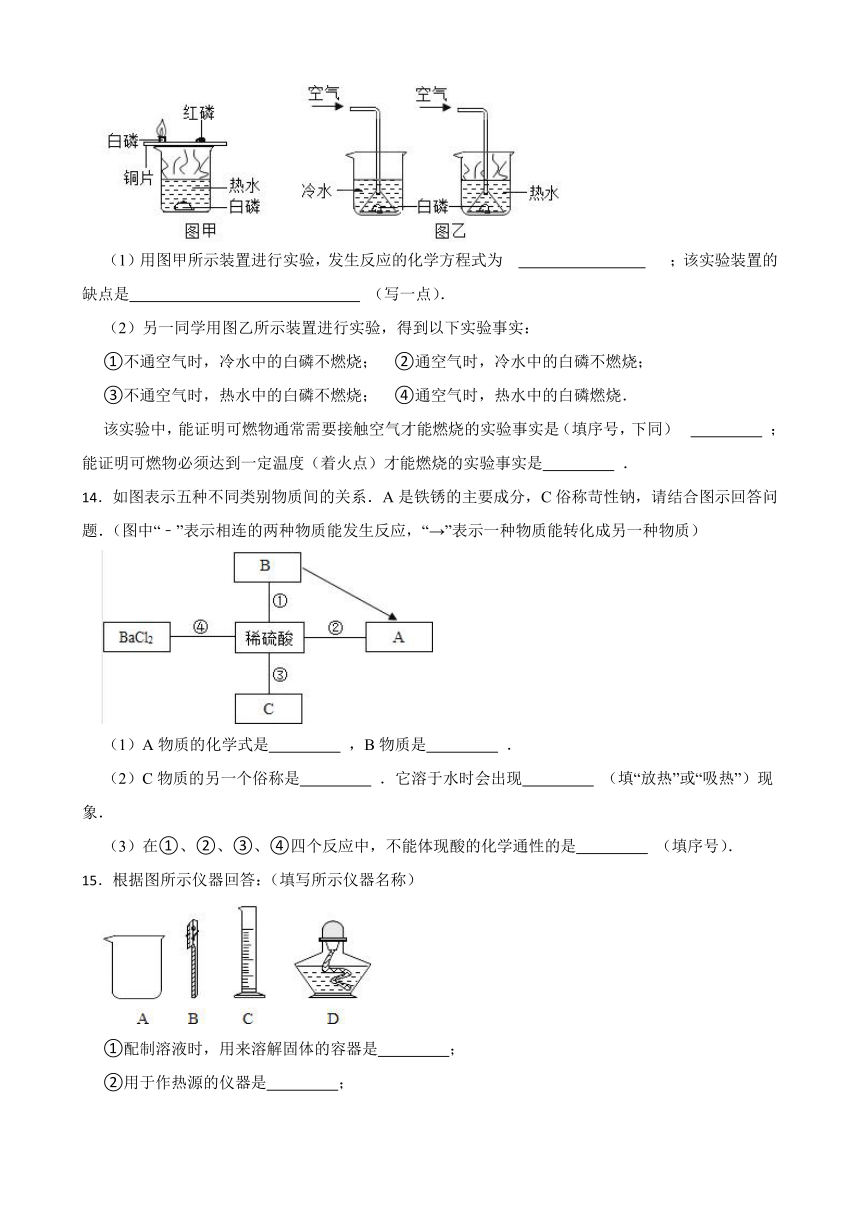
13.图甲和图乙所示实验方法均可用来探究可燃物燃烧的条件.
(1)用图甲所示装置进行实验,发生反应的化学方程式为 ;该实验装置的缺点是 (写一点).
(2)另一同学用图乙所示装置进行实验,得到以下实验事实:
①不通空气时,冷水中的白磷不燃烧; ②通空气时,冷水中的白磷不燃烧;
③不通空气时,热水中的白磷不燃烧; ④通空气时,热水中的白磷燃烧.
该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是(填序号,下同) ;能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是 .
14.如图表示五种不同类别物质间的关系.A是铁锈的主要成分,C俗称苛性钠,请结合图示回答问题.(图中“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质)
(1)A物质的化学式是 ,B物质是 .
(2)C物质的另一个俗称是 .它溶于水时会出现 (填“放热”或“吸热”)现象.
(3)在①、②、③、④四个反应中,不能体现酸的化学通性的是 (填序号).
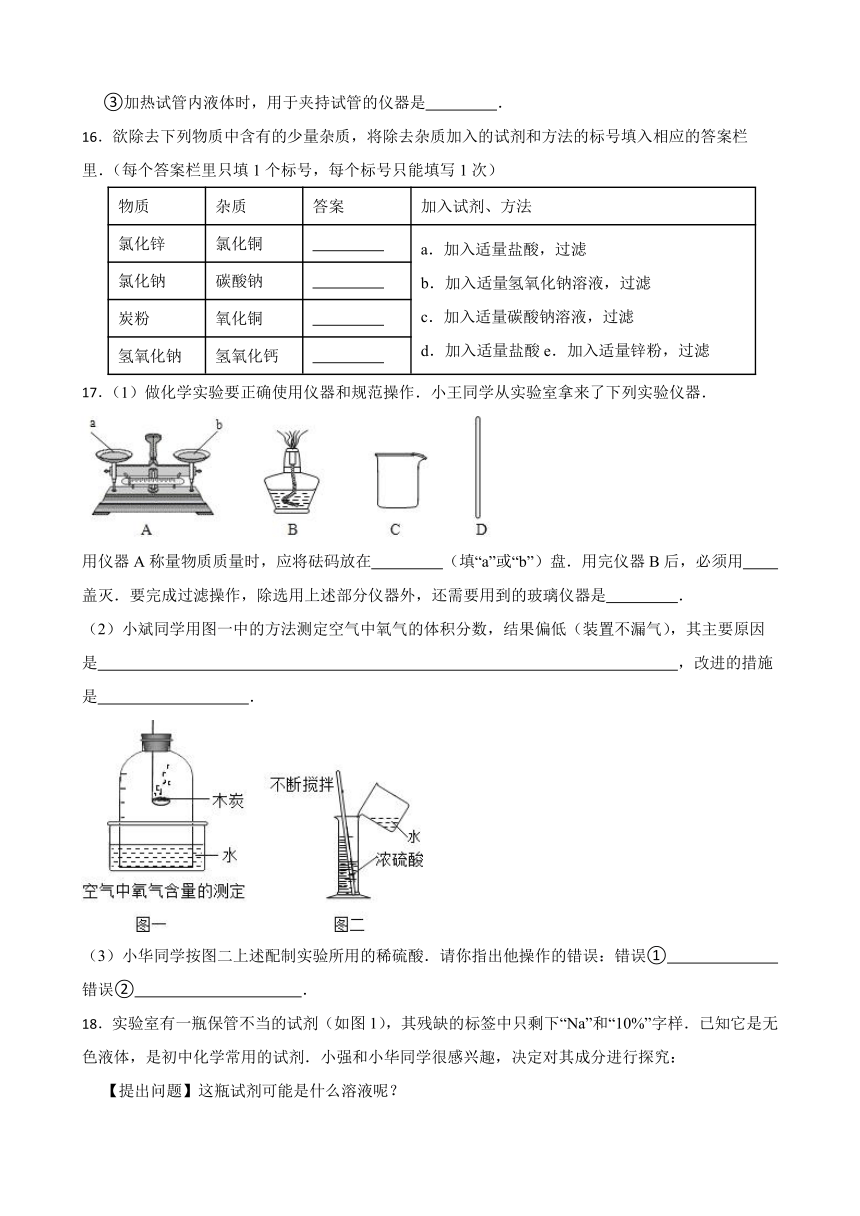
15.根据图所示仪器回答:(填写所示仪器名称)
①配制溶液时,用来溶解固体的容器是 ;
②用于作热源的仪器是 ;
③加热试管内液体时,用于夹持试管的仪器是 .
16.欲除去下列物质中含有的少量杂质,将除去杂质加入的试剂和方法的标号填入相应的答案栏里.(每个答案栏里只填1个标号,每个标号只能填写1次)
物质 杂质 答案 加入试剂、方法
氯化锌 氯化铜 a.加入适量盐酸,过滤 b.加入适量氢氧化钠溶液,过滤 c.加入适量碳酸钠溶液,过滤 d.加入适量盐酸e.加入适量锌粉,过滤
氯化钠 碳酸钠
炭粉 氧化铜
氢氧化钠 氢氧化钙
17.(1)做化学实验要正确使用仪器和规范操作.小王同学从实验室拿来了下列实验仪器.
用仪器A称量物质质量时,应将砝码放在 (填“a”或“b”)盘.用完仪器B后,必须用 盖灭.要完成过滤操作,除选用上述部分仪器外,还需要用到的玻璃仪器是 .
(2)小斌同学用图一中的方法测定空气中氧气的体积分数,结果偏低(装置不漏气),其主要原因是 ,改进的措施是 .
(3)小华同学按图二上述配制实验所用的稀硫酸.请你指出他操作的错误:错误① 错误② .
18.实验室有一瓶保管不当的试剂(如图1),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ.Na2CO3、NaHCO3溶液都呈碱性.
Ⅲ.室温(20℃)时,四种物质的溶解度的数据如下:
物质 NaCl NaOH Na2CO3 NaHCO3
溶解度g 36 109 215 9.6
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 .
【作出猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl.
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,则猜想 错误.
(2)小强为了确定该溶液的成分,他又进行了如下实验:
操作步骤 实验现象 结论及化学方程式
取样于试管中,滴加足量的 (填试剂的名称) 产生大量的气泡 猜想②正确
老师指出该结论不严密.理由是氢氧化钠溶液在空气中敞口放置会发生变质,变质后也能产生上述现象.请写出氢氧化钠在空气中变质的化学方程式 .
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ;静置后,取上层清液,滴入无色酚酞试液,溶液呈红色.
【实验结论】这瓶溶液原来是 .
【探究启示】做实验时取完药品后应 .
(3)探究这瓶NaOH溶液的变质程度
【研究方案】取10g原溶液,向其中逐滴加入质量分数为7.3%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.
【解决问题】实验测得加入稀盐酸与产生CO2气体的质量关系如图2所示.
请回答:①A点溶液中所含的溶质 (填化学式).
②10g原溶液中含碳酸钠的质量 .(写出计算过程,此题2分)
③10g原溶液中未变质的氢氧化钠的质量 .(不需要写出计算过程)
三、综合题
19.有一天,某学习小组进行野炊活动.所带的物品如下表:
食物 大米、猪排骨、猪肝、鸡肉、鸡蛋、豆腐
调料 食盐、碱面、蔗糖、食醋、味精、酱油、食用油
用品 铁锅、锅铲、碗、筷子、肥皂
(1)在讨论中餐食谱时,他们发现所带食物不符合平衡膳食的要求,因为食物中缺少了
(2)到了目的地同学们发现忘了给装食盐和碱面(主要成分是碳酸钠)的瓶子做标记.可用所带物品 来鉴别.
(3)野炊活动中,有一同学被蜜蜂意外蛰伤,蜜蜂毒液呈酸性,其他同学马上利用肥皂水为其涂抹于患处,结果症状大大减轻,这是因为肥皂水呈 性.
(4)野炊回来后,小科从资料中获悉:某品牌酱油每100mL中铁营养剂的标准添加量是0.2g.铁营养几中铁元素质量分数为12.5%.由此可计算一瓶448mL该品牌酱油中所含的铁元素相当于多少克硫酸亚铁中所含的铁元素质量?如果这些硫酸亚铁是通过铁和稀硫酸反应制得,则需要9.8%的稀硫酸质量多少?
20.酸类中有一种酸叫做醋酸,化学名称是乙酸,它是食用醋的主要成分,在16.6℃以上纯净的醋酸是一种有强烈刺激性气味的无色液体,溶于水和酒精,醋酸分子中含有的原子团CH3COO称为醋酸根(为﹣1价原子团),醋酸与稀硫酸、盐酸一样,也能与活泼金属发生反应产生氢气,所以家用铝制器皿不宜用来盛放醋酸,以免被腐蚀.
(1)上文中提到醋酸的物理性质有(至少写2条) ;
(2)若醋酸在空气中燃烧产物与乙醇在空气中燃烧产物相同,请写出醋酸燃烧的化学方程式 ;
(3)醋酸和锌反应的化学方程式为 .
21.家用清洁产品中蕴含着丰富的化学知识。根据下表完成下面小题。
清洁产品 除垢净 去污粉 管道通
主要成分 盐酸 碳酸钠 氢氧化钠、铝粉
(1)去污粉与除垢净不能混合使用,其原因是 (用化学方程式表示)。
(2)管道通使用时不能接触皮肤,原因是 。
(3)管道通使用时利用Al与NaOH溶液反应放出大量的热,以加快NaOH与淤积物的作用,该反应的化学方程式为 2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑。该反应的涉及的物质中属于非金属单质的是 。
22.废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对锡的绿色回收,设计如下工艺流程:
已知:Sn+SnCl4=2SnCl2
(1)塑料属于 (填“有机物”或“无机物”)。
(2)SnCl2中锡元素的化合价是 。
(3)铜的金属活动性比锡的 (填“强”或“弱”);固体A中一定含有的金属元素是 。
(4)写出步骤②发生反应的化学方程式 ,其反应类型是 。
(5)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是 (回答一点)。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】C
4.【答案】A
5.【答案】C
6.【答案】B
7.【答案】C
8.【答案】C
9.【答案】A
10.【答案】C
11.【答案】D
12.【答案】A
13.【答案】4P+5O22P2O5;反应生成的白烟会污染空气;③、④;②、④
14.【答案】Fe2O3;铁;火碱;放热;④
15.【答案】A;D;B
16.【答案】e;d;a;c
17.【答案】b;灯帽;漏斗;木炭燃烧虽然消耗了氧气,但生成了二氧化碳,钟罩内气体压强基本保持不变;将木炭改为红磷;将水倒入浓硫酸中;在量筒中配制溶液
18.【答案】NaHCO3;③;稀盐酸;2NaOH+CO2=Na2CO3+H2O;白色沉淀;除尽碳酸钠;NaOH;立即盖上瓶塞,并放回原处;NaCl和Na2CO3;0.265g;0.8g
19.【答案】(1)水果、蔬菜
(2)食醋
(3)碱
(4)解:设448mL该品牌酱油中所含的铁元素相当于质量为X的硫酸亚铁中所含的铁元素质量,
0.2g添加剂中铁元素的质量为:0.2g×12.5%=0.025g,
448mL酱油中所含的铁元素的质量为:0.025g×=0.112g,
根据题意有:X××100%=0.112g,
X=0.304g,
答:448mL该品牌酱油中所含的铁元素相当于0.304g硫酸亚铁中所含的铁元素质量.
解:设需要硫酸的质量为Y,
Fe+H2SO4=FeSO4+H2↑
98 152
Y 0.304g
=
Y=0.196g,
设需要9.8%的稀硫酸的质量为Z,
则有:Z×9.8%=0.196g,
Z=2g,
答:需要9.8%的稀硫酸的质量为2g.
20.【答案】(1)有刺激性气味的无色液体,溶于水和酒精、熔点为16.6℃
(2)CH3COOH+2O2=2CO2+2H2O
(3)2CH3COOH+Zn=(CH3COO)2Zn+H2↑
21.【答案】(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)氢氧化钠有腐蚀性
(3)H2
22.【答案】(1)有机物
(2)+2价
(3)弱;铜
(4);分解反应
(5)减轻了环境污染,回收了金属资源等
一、单选题
1.下列说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质的质量质量分数变大
C.长期露置于空气中的固体氢氧化钠,其成分不会发生变化
D.打开盛浓盐酸的试剂瓶,瓶口会产生白雾
2.生活、生产中处处离不开化学知识,下列说法中,不正确的是( )
A.炒菜时,油锅不慎着火迅速用锅盖盖灭
B.熟石灰可以改良酸性土壤,但不能和硫酸铵混合使用
C.闻到家中煤气泄漏,立即打开排气扇通风
D.启用闲置的地窖前先进行灯火试验
3.“生命至上、安全第一”,为及时发现天然气泄漏,某燃气公司常在天然气中加入少量具有特殊气味的乙硫醇(C2H5SH)。乙硫醇在空气中也能燃烧,反应的化学方程式为: 。下列说法不正确的是( )
A.X的化学式为SO2
B.乙硫醇中硫元素的质量分数最大
C.乙硫醇是混合物
D.乙硫醇分子中碳、氢、硫原子的个数比为2:6: 1
4.分类法是学习化学的一种方法。下列分类方法正确的是( )
A.直接加热的仪器:试管、燃烧匙、蒸发皿
B.大气污染物:NO2、SO2、CO2
C.可燃性气体:H2、O2、CO
D.分子构成的物质:N2、NaCl、H2O
5.下列四组实验中,不能体现酸的通性的是( )
A. B.
C. D.
6.小民在做过滤操作时,在老师给他的仪器中,他认为还缺少一种,其中老师的仪器主要有:漏斗、烧杯、滤纸、铁架台,他认为缺少的仪器是( )
A.小烧杯 B.玻璃棒 C.药匙 D.长颈漏斗
7.通常情况下铜不与稀硫酸反应,但将一小块铜片加入装有过量稀硫酸的烧杯中,在不断通入O2并加热的条件下,可以发生如下反应:2Cu+2H2SO4(稀)+O2 2CuSO4+2X,下列说法正确的是( )
A.反应后烧杯中的物质只含有CuSO4和H2O
B.生成物X的化学式是H2O2
C.反应后溶液由无色变为蓝色
D.反应前后烧杯内液体的质量不变
8.只用一种试剂就能将NaOH、NaCl、BaCl2三种溶液鉴别出来,它是 ( )
A.Na2SO4溶液 B.酚酞试液
C.CuSO4溶液 D.Fe(NO3)3溶液
9.下列对实验现象描述错误的是( )
A.电解水时正负极产生的气体的体积比为2:1
B.氢氧化钠固体溶于水,溶液温度升高
C.烧杯中有两支高低不不同正在燃烧的蜡烛,在蜡烛对侧沿烧杯壁缓慢倾倒二氧化碳,蜡烛由低到高依次熄灭
D.打开盛浓盐酸的试剂瓶,观察到会出现白雾
10.化学实验中常会出现一些“出乎意料”的现象或结果,下列各项对相关异常情况的解释不合理的是( )
选项 A B C D
实验装置
实验目的 验证氧气的化学性质 除去粗盐中的泥沙 测定空气中氧气的含量 验证分子运动
异常情况 未看到火星四射 滤液浑浊 测定结果偏大 酚酞溶液不变色
原因分析 可能是氧气不纯 可能是滤纸破损 可能是红磷的量不足 大烧杯内壁上可能有杂质与氨气反应
A.A B.B C.C D.D
11.下列根据几种粒子的结构示意图获得的信息不正确的是( )
A.它们表示四种元素,五种不同的粒子
B.②和⑤可形成AB2型化合物
C.①和③表示的粒子具有相似的化学性质
D.①②表示的元素在元素周期表中同一族
12.用食盐固体配制一定溶质质量分数的食盐溶液,实验时必不可少的一组仪器是( )
A.天平、玻璃棒、烧杯、量筒 B.烧杯、玻璃棒、量筒、漏斗
C.量筒、漏斗、试管、天平 D.烧杯、蒸发皿、量筒、漏斗
二、填空题
13.图甲和图乙所示实验方法均可用来探究可燃物燃烧的条件.
(1)用图甲所示装置进行实验,发生反应的化学方程式为 ;该实验装置的缺点是 (写一点).
(2)另一同学用图乙所示装置进行实验,得到以下实验事实:
①不通空气时,冷水中的白磷不燃烧; ②通空气时,冷水中的白磷不燃烧;
③不通空气时,热水中的白磷不燃烧; ④通空气时,热水中的白磷燃烧.
该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是(填序号,下同) ;能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是 .
14.如图表示五种不同类别物质间的关系.A是铁锈的主要成分,C俗称苛性钠,请结合图示回答问题.(图中“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质)
(1)A物质的化学式是 ,B物质是 .
(2)C物质的另一个俗称是 .它溶于水时会出现 (填“放热”或“吸热”)现象.
(3)在①、②、③、④四个反应中,不能体现酸的化学通性的是 (填序号).
15.根据图所示仪器回答:(填写所示仪器名称)
①配制溶液时,用来溶解固体的容器是 ;
②用于作热源的仪器是 ;
③加热试管内液体时,用于夹持试管的仪器是 .
16.欲除去下列物质中含有的少量杂质,将除去杂质加入的试剂和方法的标号填入相应的答案栏里.(每个答案栏里只填1个标号,每个标号只能填写1次)
物质 杂质 答案 加入试剂、方法
氯化锌 氯化铜 a.加入适量盐酸,过滤 b.加入适量氢氧化钠溶液,过滤 c.加入适量碳酸钠溶液,过滤 d.加入适量盐酸e.加入适量锌粉,过滤
氯化钠 碳酸钠
炭粉 氧化铜
氢氧化钠 氢氧化钙
17.(1)做化学实验要正确使用仪器和规范操作.小王同学从实验室拿来了下列实验仪器.
用仪器A称量物质质量时,应将砝码放在 (填“a”或“b”)盘.用完仪器B后,必须用 盖灭.要完成过滤操作,除选用上述部分仪器外,还需要用到的玻璃仪器是 .
(2)小斌同学用图一中的方法测定空气中氧气的体积分数,结果偏低(装置不漏气),其主要原因是 ,改进的措施是 .
(3)小华同学按图二上述配制实验所用的稀硫酸.请你指出他操作的错误:错误① 错误② .
18.实验室有一瓶保管不当的试剂(如图1),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ.Na2CO3、NaHCO3溶液都呈碱性.
Ⅲ.室温(20℃)时,四种物质的溶解度的数据如下:
物质 NaCl NaOH Na2CO3 NaHCO3
溶解度g 36 109 215 9.6
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 .
【作出猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl.
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,则猜想 错误.
(2)小强为了确定该溶液的成分,他又进行了如下实验:
操作步骤 实验现象 结论及化学方程式
取样于试管中,滴加足量的 (填试剂的名称) 产生大量的气泡 猜想②正确
老师指出该结论不严密.理由是氢氧化钠溶液在空气中敞口放置会发生变质,变质后也能产生上述现象.请写出氢氧化钠在空气中变质的化学方程式 .
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ;静置后,取上层清液,滴入无色酚酞试液,溶液呈红色.
【实验结论】这瓶溶液原来是 .
【探究启示】做实验时取完药品后应 .
(3)探究这瓶NaOH溶液的变质程度
【研究方案】取10g原溶液,向其中逐滴加入质量分数为7.3%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.
【解决问题】实验测得加入稀盐酸与产生CO2气体的质量关系如图2所示.
请回答:①A点溶液中所含的溶质 (填化学式).
②10g原溶液中含碳酸钠的质量 .(写出计算过程,此题2分)
③10g原溶液中未变质的氢氧化钠的质量 .(不需要写出计算过程)
三、综合题
19.有一天,某学习小组进行野炊活动.所带的物品如下表:
食物 大米、猪排骨、猪肝、鸡肉、鸡蛋、豆腐
调料 食盐、碱面、蔗糖、食醋、味精、酱油、食用油
用品 铁锅、锅铲、碗、筷子、肥皂
(1)在讨论中餐食谱时,他们发现所带食物不符合平衡膳食的要求,因为食物中缺少了
(2)到了目的地同学们发现忘了给装食盐和碱面(主要成分是碳酸钠)的瓶子做标记.可用所带物品 来鉴别.
(3)野炊活动中,有一同学被蜜蜂意外蛰伤,蜜蜂毒液呈酸性,其他同学马上利用肥皂水为其涂抹于患处,结果症状大大减轻,这是因为肥皂水呈 性.
(4)野炊回来后,小科从资料中获悉:某品牌酱油每100mL中铁营养剂的标准添加量是0.2g.铁营养几中铁元素质量分数为12.5%.由此可计算一瓶448mL该品牌酱油中所含的铁元素相当于多少克硫酸亚铁中所含的铁元素质量?如果这些硫酸亚铁是通过铁和稀硫酸反应制得,则需要9.8%的稀硫酸质量多少?
20.酸类中有一种酸叫做醋酸,化学名称是乙酸,它是食用醋的主要成分,在16.6℃以上纯净的醋酸是一种有强烈刺激性气味的无色液体,溶于水和酒精,醋酸分子中含有的原子团CH3COO称为醋酸根(为﹣1价原子团),醋酸与稀硫酸、盐酸一样,也能与活泼金属发生反应产生氢气,所以家用铝制器皿不宜用来盛放醋酸,以免被腐蚀.
(1)上文中提到醋酸的物理性质有(至少写2条) ;
(2)若醋酸在空气中燃烧产物与乙醇在空气中燃烧产物相同,请写出醋酸燃烧的化学方程式 ;
(3)醋酸和锌反应的化学方程式为 .
21.家用清洁产品中蕴含着丰富的化学知识。根据下表完成下面小题。
清洁产品 除垢净 去污粉 管道通
主要成分 盐酸 碳酸钠 氢氧化钠、铝粉
(1)去污粉与除垢净不能混合使用,其原因是 (用化学方程式表示)。
(2)管道通使用时不能接触皮肤,原因是 。
(3)管道通使用时利用Al与NaOH溶液反应放出大量的热,以加快NaOH与淤积物的作用,该反应的化学方程式为 2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑。该反应的涉及的物质中属于非金属单质的是 。
22.废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对锡的绿色回收,设计如下工艺流程:
已知:Sn+SnCl4=2SnCl2
(1)塑料属于 (填“有机物”或“无机物”)。
(2)SnCl2中锡元素的化合价是 。
(3)铜的金属活动性比锡的 (填“强”或“弱”);固体A中一定含有的金属元素是 。
(4)写出步骤②发生反应的化学方程式 ,其反应类型是 。
(5)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是 (回答一点)。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】C
4.【答案】A
5.【答案】C
6.【答案】B
7.【答案】C
8.【答案】C
9.【答案】A
10.【答案】C
11.【答案】D
12.【答案】A
13.【答案】4P+5O22P2O5;反应生成的白烟会污染空气;③、④;②、④
14.【答案】Fe2O3;铁;火碱;放热;④
15.【答案】A;D;B
16.【答案】e;d;a;c
17.【答案】b;灯帽;漏斗;木炭燃烧虽然消耗了氧气,但生成了二氧化碳,钟罩内气体压强基本保持不变;将木炭改为红磷;将水倒入浓硫酸中;在量筒中配制溶液
18.【答案】NaHCO3;③;稀盐酸;2NaOH+CO2=Na2CO3+H2O;白色沉淀;除尽碳酸钠;NaOH;立即盖上瓶塞,并放回原处;NaCl和Na2CO3;0.265g;0.8g
19.【答案】(1)水果、蔬菜
(2)食醋
(3)碱
(4)解:设448mL该品牌酱油中所含的铁元素相当于质量为X的硫酸亚铁中所含的铁元素质量,
0.2g添加剂中铁元素的质量为:0.2g×12.5%=0.025g,
448mL酱油中所含的铁元素的质量为:0.025g×=0.112g,
根据题意有:X××100%=0.112g,
X=0.304g,
答:448mL该品牌酱油中所含的铁元素相当于0.304g硫酸亚铁中所含的铁元素质量.
解:设需要硫酸的质量为Y,
Fe+H2SO4=FeSO4+H2↑
98 152
Y 0.304g
=
Y=0.196g,
设需要9.8%的稀硫酸的质量为Z,
则有:Z×9.8%=0.196g,
Z=2g,
答:需要9.8%的稀硫酸的质量为2g.
20.【答案】(1)有刺激性气味的无色液体,溶于水和酒精、熔点为16.6℃
(2)CH3COOH+2O2=2CO2+2H2O
(3)2CH3COOH+Zn=(CH3COO)2Zn+H2↑
21.【答案】(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)氢氧化钠有腐蚀性
(3)H2
22.【答案】(1)有机物
(2)+2价
(3)弱;铜
(4);分解反应
(5)减轻了环境污染,回收了金属资源等
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
