到实验室去:探究金属的性质 同步练习 (含答案)2022-2023学年鲁教版(五四制)九年级全册化学
文档属性
| 名称 | 到实验室去:探究金属的性质 同步练习 (含答案)2022-2023学年鲁教版(五四制)九年级全册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 42.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 11:15:44 | ||
图片预览



文档简介
到实验室去:探究金属的性质 同步练习
一、单选题
1.下列认识或说法正确的是( )
A.向某固体中加入稀盐酸有气泡产生,可以证明该物质一定含有CO32﹣
B.分别将Mg、Fe、Cu、Ag放入稀盐酸中,可以确定他们的活动性顺序
C.采用加入过量的Cu(OH)2,可以去除CuSO4溶液中少量的H2SO4
D.CO和CO2都可将氧化铜还原成铜
2.下列除杂(括号内的物质为杂质)所选试剂合理的是( )
A.铜粉(铁粉) 稀盐酸 B.NaCl溶液(CaCl2) K2CO3溶液
C.CO2(CO) NaOH溶液 D.KOH溶液(K2CO3) 稀盐酸
3.下列关于燃烧现象的描述,不正确的是( )
A.碳在氧气中燃烧发出白光
B.硫在空气中燃烧发出蓝紫色火焰
C.铁丝在空气中剧烈燃烧,火星四射
D.镁条在空气中燃烧发出耀眼的白光
4.某不纯的镁粉样品中含有铝、铁、锌、铜中的两种或几种杂质。现取3.6g该样品,加入100g足量稀硫酸,固体完全溶解,所得到无色溶液的质量为103.3g,则下列选项中的杂质组成合理的是( )
A.Al和Fe B.Zn和Cu C.Al和Zn D.Al、Zn和Cu
5.下列除杂的实验过程都正确的是(括号内为杂质)( )
A.MnO2(KCl)加水溶解、过滤、蒸发、结晶
B.KCl(K2CO3)加足量稀硫酸、过滤、蒸发、结晶
C.CuO(Cu)加足量稀盐酸、过滤、洗涤、干燥
D.BaSO4(BaCO3)加足量稀盐酸、过滤、洗涤、干燥
6.向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入mgZn粉,充分反应后过滤,将滤渣洗涤、干燥后称量,得到的固体质量为mg。下列说法错误的是( )已知:AgNO3+HCl═HNO3+AgCl↓
A.滤渣中的物质至少有两种
B.取滤渣滴加稀硫酸,一定有气泡产生
C.取反应后的滤液观察,滤液一定呈浅绿色
D.取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
7.金属材料在人类活动中已得到越来越广泛的应用.下列性质属于金属共性的是( )
A.硬度很大、熔点很高 B.有良好的导电性、传热性
C.是银白色的固体 D.易与酸反应产生氢气
8.用一氧化碳在加热的条件下还原氧化铜,发现已制得的铜又很快变黑了,你推测产生这种现象的原因是( )
A.温度太低
B.试管口倾斜了
C.反应开始时,没有把试管内的空气排干净
D.铜没有在一氧化碳气流中冷却而又被空气中氧气所氧化
9.下列物质中,不能由金属单质和盐酸直接反应生成的是( )
A.ZnCl2 B.AlCl3 C.FeCl3 D.MgCl2
10.下列说法中正确的是( )
A.pH<7的雨水叫酸雨
B.pH<7的溶液,pH越小,酸性越弱
C.使酚酞溶液变红的溶液是碱性溶液
D.使用pH试纸应先用蒸馏水润湿
11.根据金属活动性顺序Al>Fe>Cu>Ag判断,下列说法不正确的是( )
A.反应Cu+FeSO4═Fe+CuSO4可以发生,属于置换反应
B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生,属于置换反应
C.反应Cu+2AgNO3═2Ag+Cu(NO3)2可以发生,溶液颜色由无色变成蓝色
D.反应2Al+3CuSO4═3Cu+Al2(SO4)3可以表面有红色物质析出,溶液由蓝色变无色
12.关于金属物品的使用正确的是( )
A.铝合金门窗变旧变暗后用砂纸或钢丝球打磨
B.铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡
C.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
D.铁桶中加入硫酸铜溶液和石灰乳配制杀菌剂波尔多液
二、填空题
13.氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为 ,该反应属于基本反应类型中的 ,NaClO3中Cl的化合价为 。
14.中国是世界上最早对金属资源进行利用的国家.
(1)中国古代常用的炼铜方法有两种.方法一:胆铜法,也就是“湿法炼铜”,其原理是将胆矾(硫酸铜晶体)溶于水,再将铁放入胆矾溶液中把铜置换出来,请写出此过程中生成铜的化学方程式 ;方法二:火法炼铜,就是将孔雀石和焦炭混合加热炼铜.先将孔雀石【Cu2(OH)2CO3】加热分解成黑色固体、水和二氧化碳三种氧化物,方程式为 ,然后利用焦炭去高温还原获得金属铜.
(2)中国早在西汉时期就会炼钢,其中一种方法叫“炒铁”,就是将含碳量过高的生铁加热至半流体状,然后加入铁矿石粉混合后不断“翻炒”,从而让生铁中的碳元素不断渗出,被空气氧化从而降低含碳量,写出降低含碳量的原理的方程式 .
(3)上述两种金属的冶炼原理中,没有涉及的基本反应类型是 .
15.人们常说的“五金”是指:金、银、铜、铁、锡。根据所学知识回答:
(1)“真金不怕火炼”说明金即使在高温条件下也不与 反应。
(2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度 (填“大”或“小”)。
16.在“海南一号”打捞出来的文物之,“金龙纹手镯”光彩夺目,铜镜表面有铜锈,铁器则锈迹斑斑,这说明Au、Fe、Cu这三种金属的活动性顺序由强到弱的顺序是 ;炼铁的原理是利用一氧化碳和氧化铁反应,反应的化学方程式为 .
17.小可同学在学习了近一年的初中化学后,总结了一些说法,判断这些说法是否正确。若正确,在右边空白栏打“√”;若错误,用溶质的化学式或反应的化学方程式证明。
说 法 溶质的化学式或反应的化学方程式
不是所有的溶液都是无色的
只有碱溶液才显碱性
有盐和水生成的反应一定是中和反应
所有复分解反应只能生成一种沉淀
18.某兴趣小组的同学对食品中含有的维生素C(化学式为C6H8O6,可表示为Vc)进行探究.
(1)向含有Vc的溶液中滴加紫色石蕊,溶液变红,说明Vc具有的性质是 .
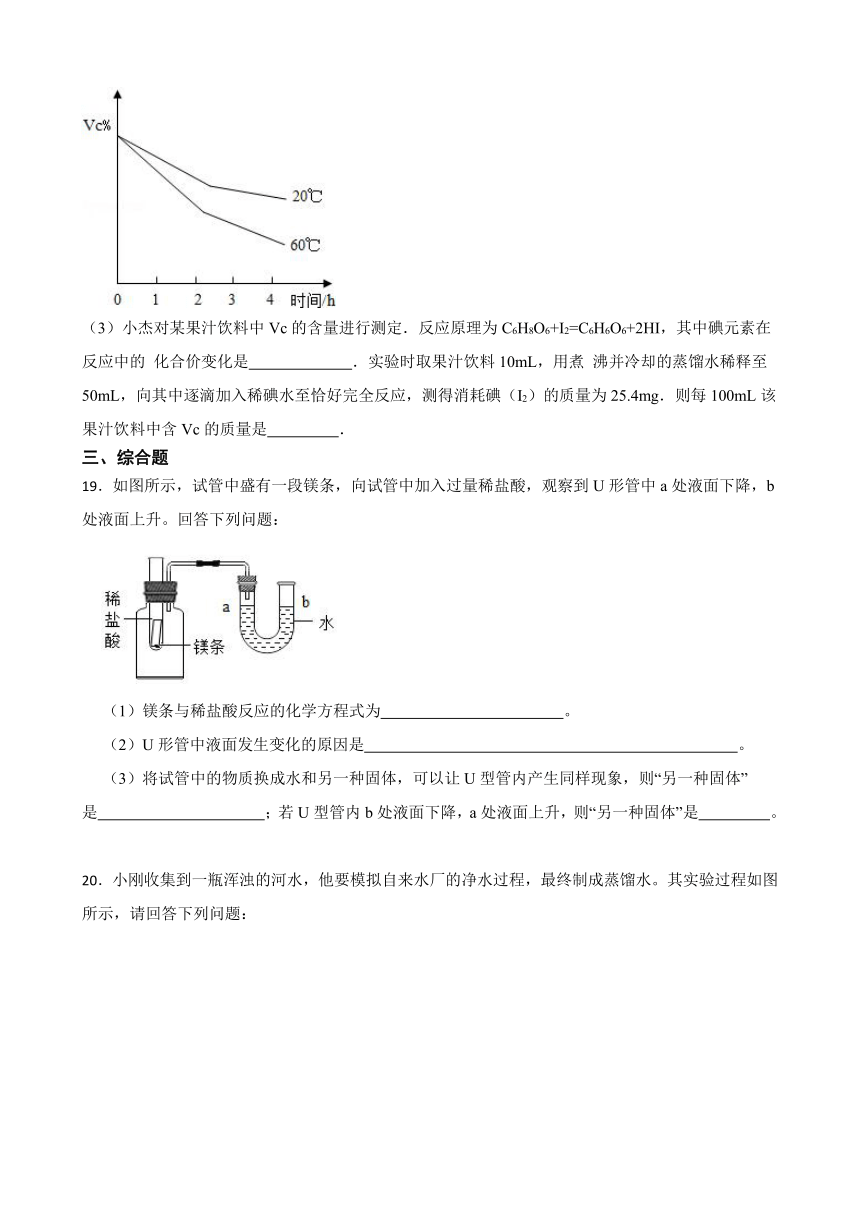
(2)食品中的Vc被氧气氧化时,其含量的变化如图所示,由此可得出的结论有
(3)小杰对某果汁饮料中Vc的含量进行测定.反应原理为C6H8O6+I2=C6H6O6+2HI,其中碘元素在反应中的 化合价变化是 .实验时取果汁饮料10mL,用煮 沸并冷却的蒸馏水稀释至50mL,向其中逐滴加入稀碘水至恰好完全反应,测得消耗碘(I2)的质量为25.4mg.则每100mL该果汁饮料中含Vc的质量是 .
三、综合题
19.如图所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。回答下列问题:
(1)镁条与稀盐酸反应的化学方程式为 。
(2)U形管中液面发生变化的原因是 。
(3)将试管中的物质换成水和另一种固体,可以让U型管内产生同样现象,则“另一种固体”是 ;若U型管内b处液面下降,a处液面上升,则“另一种固体”是 。
20.小刚收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示,请回答下列问题:
(1)最常用的A物质是 ,其作用是 。
(2)操作①的名称是 ,若经过操作①后,所得液体C中仍有浑浊,其原因可能是 (选填字母)。
a.漏斗内的滤纸有破损
b.漏斗下端未紧靠烧杯内壁
c.漏斗内液面高于滤纸的边缘
(3)操作②主要是除去一些异味和色素,利用活性炭的 选填(“物理”或“化学”)性质。
(4)图2中的甲、乙、丙是初中化学中常见的三种物质,其中乙是水,它们之间的转化关系如图2所示。“→”表示由一种物质转化成另一种物质图中部分反应条件及物质略去
①请分析:甲可能是 。
②写出下列转化的文字表达式:甲→丙+乙: ;丙→乙: 。
21.小强向一定量的AgNO3和Cu(NO3)2混合溶液加入一定量的锌粉,并对过滤后得到的溶液A和固体B的成分进行分析和研究.
(1)由推理可知:溶液A中的一定含有的溶质是 (填化学式);
写出一个你认为已发生的化学反应方程式: .
(2)小强将固体B洗净,通过以下实验确定其成分,请将下表填写完整.
实验步骤 现象 实验结论
取少量固体B,滴加 有较多气泡产生 固体B含有
(3)由上述实验可知,溶液A中的溶质一定不含 (填化学式).
22.用氮气(N2)和氢气(H2)合成制取氨气(NH3)是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献,工厂合成制取氨气的工艺流程如下。
(1)合成塔中的反应在高温、高压、催化剂条件下进行,请根据信息写出该反应的化学表示式 ;下列关于催化剂的说法正确的是 (填序号);
A.反应前后催化剂的质量不变
B.反应前后催化剂的性质不变
C.催化剂能改变反应速率
D.催化剂能增加生成物的种类
(2)从合成塔出来的物质是 (填“纯净物”或“混合物”);
(3)请根据上图中信息回答问题:氨分离器中设置适当温度即可将NH3与N2、H2进行分离,可推知物质的沸点NH3 (填“>”、“<”、“=")N2或H2,其原理与 制氧法类似。
答案解析部分
1.【答案】C
2.【答案】A
3.【答案】C
4.【答案】C
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】D
9.【答案】C
10.【答案】C
11.【答案】A
12.【答案】C
13.【答案】分解反应;+5
14.【答案】Fe+CuSO4═Cu+FeSO4;Cu2(OH)2CO32CuO+CO2↑+H2O;C+O2CO2;复分解反应
15.【答案】(1)氧气
(2)大
16.【答案】铁>铜>金;Fe2O3+3CO 2Fe+3CO2
17.【答案】√;Na2CO3或NaHCO3;CuO+2HCl=CuCl2+2H2O;Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
18.【答案】显酸性;温度越高,Vc被氧化的速率越快;相同温度时,放置时间越长,Vc含量越低;从0到﹣1;176 mg
19.【答案】(1)
(2)镁和盐酸反应放出热量,使集气瓶内的气压增大
(3)氢氧化钠或氧化钙;硝酸铵
20.【答案】(1)明矾;在水中形成胶状物,吸附悬浮物,使之沉降
(2)过滤;ac
(3)物理
(4)过氧化氢或H2O2;过氧化氢水+氧气;氢气+氧气水(合理即可)
21.【答案】(1)Zn(NO3)2;Zn+2AgNO3=Zn(NO3)2+2Ag
(2)稀盐酸或稀硫酸;Zn、Ag、Cu
(3)AgNO3、Cu(NO3)2
22.【答案】(1);AC
(2)混合物
(3)>;分离子液态空气法
一、单选题
1.下列认识或说法正确的是( )
A.向某固体中加入稀盐酸有气泡产生,可以证明该物质一定含有CO32﹣
B.分别将Mg、Fe、Cu、Ag放入稀盐酸中,可以确定他们的活动性顺序
C.采用加入过量的Cu(OH)2,可以去除CuSO4溶液中少量的H2SO4
D.CO和CO2都可将氧化铜还原成铜
2.下列除杂(括号内的物质为杂质)所选试剂合理的是( )
A.铜粉(铁粉) 稀盐酸 B.NaCl溶液(CaCl2) K2CO3溶液
C.CO2(CO) NaOH溶液 D.KOH溶液(K2CO3) 稀盐酸
3.下列关于燃烧现象的描述,不正确的是( )
A.碳在氧气中燃烧发出白光
B.硫在空气中燃烧发出蓝紫色火焰
C.铁丝在空气中剧烈燃烧,火星四射
D.镁条在空气中燃烧发出耀眼的白光
4.某不纯的镁粉样品中含有铝、铁、锌、铜中的两种或几种杂质。现取3.6g该样品,加入100g足量稀硫酸,固体完全溶解,所得到无色溶液的质量为103.3g,则下列选项中的杂质组成合理的是( )
A.Al和Fe B.Zn和Cu C.Al和Zn D.Al、Zn和Cu
5.下列除杂的实验过程都正确的是(括号内为杂质)( )
A.MnO2(KCl)加水溶解、过滤、蒸发、结晶
B.KCl(K2CO3)加足量稀硫酸、过滤、蒸发、结晶
C.CuO(Cu)加足量稀盐酸、过滤、洗涤、干燥
D.BaSO4(BaCO3)加足量稀盐酸、过滤、洗涤、干燥
6.向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入mgZn粉,充分反应后过滤,将滤渣洗涤、干燥后称量,得到的固体质量为mg。下列说法错误的是( )已知:AgNO3+HCl═HNO3+AgCl↓
A.滤渣中的物质至少有两种
B.取滤渣滴加稀硫酸,一定有气泡产生
C.取反应后的滤液观察,滤液一定呈浅绿色
D.取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
7.金属材料在人类活动中已得到越来越广泛的应用.下列性质属于金属共性的是( )
A.硬度很大、熔点很高 B.有良好的导电性、传热性
C.是银白色的固体 D.易与酸反应产生氢气
8.用一氧化碳在加热的条件下还原氧化铜,发现已制得的铜又很快变黑了,你推测产生这种现象的原因是( )
A.温度太低
B.试管口倾斜了
C.反应开始时,没有把试管内的空气排干净
D.铜没有在一氧化碳气流中冷却而又被空气中氧气所氧化
9.下列物质中,不能由金属单质和盐酸直接反应生成的是( )
A.ZnCl2 B.AlCl3 C.FeCl3 D.MgCl2
10.下列说法中正确的是( )
A.pH<7的雨水叫酸雨
B.pH<7的溶液,pH越小,酸性越弱
C.使酚酞溶液变红的溶液是碱性溶液
D.使用pH试纸应先用蒸馏水润湿
11.根据金属活动性顺序Al>Fe>Cu>Ag判断,下列说法不正确的是( )
A.反应Cu+FeSO4═Fe+CuSO4可以发生,属于置换反应
B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生,属于置换反应
C.反应Cu+2AgNO3═2Ag+Cu(NO3)2可以发生,溶液颜色由无色变成蓝色
D.反应2Al+3CuSO4═3Cu+Al2(SO4)3可以表面有红色物质析出,溶液由蓝色变无色
12.关于金属物品的使用正确的是( )
A.铝合金门窗变旧变暗后用砂纸或钢丝球打磨
B.铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡
C.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
D.铁桶中加入硫酸铜溶液和石灰乳配制杀菌剂波尔多液
二、填空题
13.氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为 ,该反应属于基本反应类型中的 ,NaClO3中Cl的化合价为 。
14.中国是世界上最早对金属资源进行利用的国家.
(1)中国古代常用的炼铜方法有两种.方法一:胆铜法,也就是“湿法炼铜”,其原理是将胆矾(硫酸铜晶体)溶于水,再将铁放入胆矾溶液中把铜置换出来,请写出此过程中生成铜的化学方程式 ;方法二:火法炼铜,就是将孔雀石和焦炭混合加热炼铜.先将孔雀石【Cu2(OH)2CO3】加热分解成黑色固体、水和二氧化碳三种氧化物,方程式为 ,然后利用焦炭去高温还原获得金属铜.
(2)中国早在西汉时期就会炼钢,其中一种方法叫“炒铁”,就是将含碳量过高的生铁加热至半流体状,然后加入铁矿石粉混合后不断“翻炒”,从而让生铁中的碳元素不断渗出,被空气氧化从而降低含碳量,写出降低含碳量的原理的方程式 .
(3)上述两种金属的冶炼原理中,没有涉及的基本反应类型是 .
15.人们常说的“五金”是指:金、银、铜、铁、锡。根据所学知识回答:
(1)“真金不怕火炼”说明金即使在高温条件下也不与 反应。
(2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度 (填“大”或“小”)。
16.在“海南一号”打捞出来的文物之,“金龙纹手镯”光彩夺目,铜镜表面有铜锈,铁器则锈迹斑斑,这说明Au、Fe、Cu这三种金属的活动性顺序由强到弱的顺序是 ;炼铁的原理是利用一氧化碳和氧化铁反应,反应的化学方程式为 .
17.小可同学在学习了近一年的初中化学后,总结了一些说法,判断这些说法是否正确。若正确,在右边空白栏打“√”;若错误,用溶质的化学式或反应的化学方程式证明。
说 法 溶质的化学式或反应的化学方程式
不是所有的溶液都是无色的
只有碱溶液才显碱性
有盐和水生成的反应一定是中和反应
所有复分解反应只能生成一种沉淀
18.某兴趣小组的同学对食品中含有的维生素C(化学式为C6H8O6,可表示为Vc)进行探究.
(1)向含有Vc的溶液中滴加紫色石蕊,溶液变红,说明Vc具有的性质是 .
(2)食品中的Vc被氧气氧化时,其含量的变化如图所示,由此可得出的结论有
(3)小杰对某果汁饮料中Vc的含量进行测定.反应原理为C6H8O6+I2=C6H6O6+2HI,其中碘元素在反应中的 化合价变化是 .实验时取果汁饮料10mL,用煮 沸并冷却的蒸馏水稀释至50mL,向其中逐滴加入稀碘水至恰好完全反应,测得消耗碘(I2)的质量为25.4mg.则每100mL该果汁饮料中含Vc的质量是 .
三、综合题
19.如图所示,试管中盛有一段镁条,向试管中加入过量稀盐酸,观察到U形管中a处液面下降,b处液面上升。回答下列问题:
(1)镁条与稀盐酸反应的化学方程式为 。
(2)U形管中液面发生变化的原因是 。
(3)将试管中的物质换成水和另一种固体,可以让U型管内产生同样现象,则“另一种固体”是 ;若U型管内b处液面下降,a处液面上升,则“另一种固体”是 。
20.小刚收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示,请回答下列问题:
(1)最常用的A物质是 ,其作用是 。
(2)操作①的名称是 ,若经过操作①后,所得液体C中仍有浑浊,其原因可能是 (选填字母)。
a.漏斗内的滤纸有破损
b.漏斗下端未紧靠烧杯内壁
c.漏斗内液面高于滤纸的边缘
(3)操作②主要是除去一些异味和色素,利用活性炭的 选填(“物理”或“化学”)性质。
(4)图2中的甲、乙、丙是初中化学中常见的三种物质,其中乙是水,它们之间的转化关系如图2所示。“→”表示由一种物质转化成另一种物质图中部分反应条件及物质略去
①请分析:甲可能是 。
②写出下列转化的文字表达式:甲→丙+乙: ;丙→乙: 。
21.小强向一定量的AgNO3和Cu(NO3)2混合溶液加入一定量的锌粉,并对过滤后得到的溶液A和固体B的成分进行分析和研究.
(1)由推理可知:溶液A中的一定含有的溶质是 (填化学式);
写出一个你认为已发生的化学反应方程式: .
(2)小强将固体B洗净,通过以下实验确定其成分,请将下表填写完整.
实验步骤 现象 实验结论
取少量固体B,滴加 有较多气泡产生 固体B含有
(3)由上述实验可知,溶液A中的溶质一定不含 (填化学式).
22.用氮气(N2)和氢气(H2)合成制取氨气(NH3)是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献,工厂合成制取氨气的工艺流程如下。
(1)合成塔中的反应在高温、高压、催化剂条件下进行,请根据信息写出该反应的化学表示式 ;下列关于催化剂的说法正确的是 (填序号);
A.反应前后催化剂的质量不变
B.反应前后催化剂的性质不变
C.催化剂能改变反应速率
D.催化剂能增加生成物的种类
(2)从合成塔出来的物质是 (填“纯净物”或“混合物”);
(3)请根据上图中信息回答问题:氨分离器中设置适当温度即可将NH3与N2、H2进行分离,可推知物质的沸点NH3 (填“>”、“<”、“=")N2或H2,其原理与 制氧法类似。
答案解析部分
1.【答案】C
2.【答案】A
3.【答案】C
4.【答案】C
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】D
9.【答案】C
10.【答案】C
11.【答案】A
12.【答案】C
13.【答案】分解反应;+5
14.【答案】Fe+CuSO4═Cu+FeSO4;Cu2(OH)2CO32CuO+CO2↑+H2O;C+O2CO2;复分解反应
15.【答案】(1)氧气
(2)大
16.【答案】铁>铜>金;Fe2O3+3CO 2Fe+3CO2
17.【答案】√;Na2CO3或NaHCO3;CuO+2HCl=CuCl2+2H2O;Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
18.【答案】显酸性;温度越高,Vc被氧化的速率越快;相同温度时,放置时间越长,Vc含量越低;从0到﹣1;176 mg
19.【答案】(1)
(2)镁和盐酸反应放出热量,使集气瓶内的气压增大
(3)氢氧化钠或氧化钙;硝酸铵
20.【答案】(1)明矾;在水中形成胶状物,吸附悬浮物,使之沉降
(2)过滤;ac
(3)物理
(4)过氧化氢或H2O2;过氧化氢水+氧气;氢气+氧气水(合理即可)
21.【答案】(1)Zn(NO3)2;Zn+2AgNO3=Zn(NO3)2+2Ag
(2)稀盐酸或稀硫酸;Zn、Ag、Cu
(3)AgNO3、Cu(NO3)2
22.【答案】(1);AC
(2)混合物
(3)>;分离子液态空气法
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
