化学人教版(2019)选择性必修2 3.3.3过渡晶体与混合型晶体(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.3过渡晶体与混合型晶体(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 18:17:53 | ||
图片预览




文档简介
(共21张PPT)
该作品属于《WJ化学研究院》原创,如有需要请
通过wj-chem@与我联系

选择性必修二 第三节 金属晶体与离子晶体
第3学时 过渡晶体与混合型晶体
WJ化学研究院
第三章
Institute of Chemistry
2023
学习目标
原创:WJ化学研究院
邮箱wj-chem@
1.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存
在的。
2.了解过渡晶体,掌握石墨这一混合型晶体的结构特点。
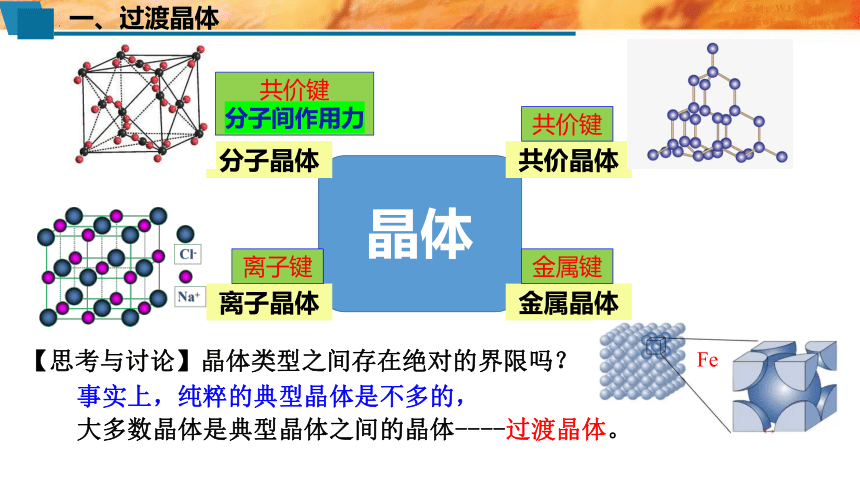
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
晶体
分子晶体
共价晶体
离子晶体
金属晶体
Fe
共价键
分子间作用力
离子键
共价键
金属键
【思考与讨论】晶体类型之间存在绝对的界限吗?
事实上,纯粹的典型晶体是不多的,
大多数晶体是典型晶体之间的晶体----过渡晶体。
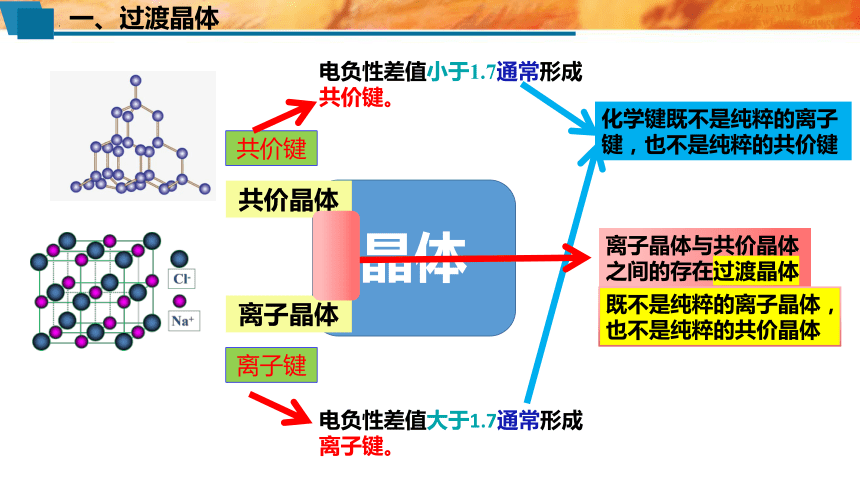
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
晶体
共价晶体
离子晶体
共价键
离子键
电负性差值大于1.7通常形成离子键。
电负性差值小于1.7通常形成共价键。
化学键既不是纯粹的离子键,也不是纯粹的共价键
离子晶体与共价晶体之间的存在过渡晶体
既不是纯粹的离子晶体,也不是纯粹的共价晶体
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
近代实验表明,纯粹的离子键是不存在的,绝大多数离子键都不是典型的,只是离子性占优势而已。
例如:铯的电负性为0.7,而氟的电负性为4.0,两者之差是所有元素中电负性差值最大的,因此氟化铯(CsF)是典型的离子晶体。
但Cs﹢与F﹣的结合也不完全是纯静电作用,仍有部分共价性质。其离子键成分也只是92%,其余8%为共价键成分。这说明即便是像铯和氟这样典型的金属和典型的非金属形成化学键时,成键原子轨道之间依然有部分重叠。
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
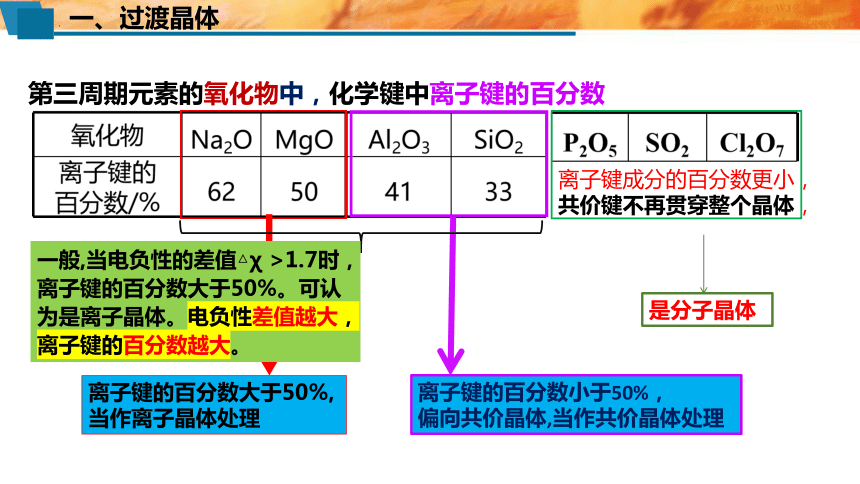
离子键成分的百分数更小,共价键不再贯穿整个晶体,
离子键的百分数大于50%,
当作离子晶体处理
离子键的百分数小于50%,
偏向共价晶体,当作共价晶体处理
第三周期元素的氧化物中,化学键中离子键的百分数
是分子晶体
一般,当电负性的差值△χ >1.7时,离子键的百分数大于50%。可认为是离子晶体。电负性差值越大,离子键的百分数越大。
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
1
2
3
4
分子晶体
共价晶体
离子晶体
金属晶体
晶体
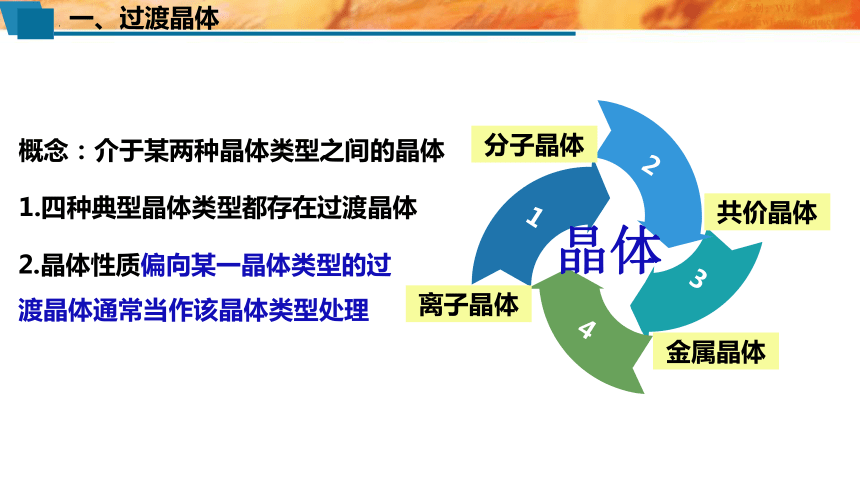
2.晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
1.四种典型晶体类型都存在过渡晶体
概念:介于某两种晶体类型之间的晶体
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
1.正误判断
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅局限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)Al2O3晶体中存在离子键,属于离子晶体( )
√
×
×
√
×
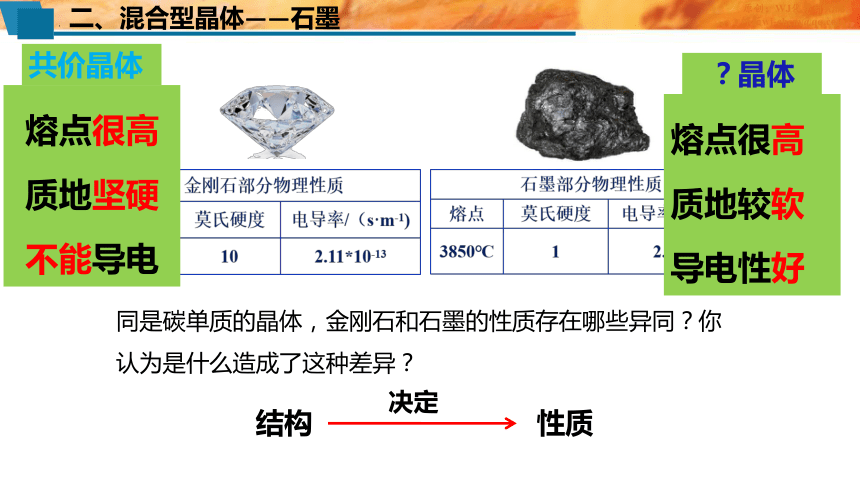
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?你认为是什么造成了这种差异?
结构 性质
决定
熔点很高
质地坚硬
不能导电
共价晶体
熔点很高
质地较软
导电性好
?晶体
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
碳原子均采取sp2杂化,
形成平面六元并环结构。
层内C原子以共价键结合,
层间靠范德华力维系。
石墨的层状结构
混合型晶体:
石墨晶体是一种典型的混合型晶体。
范德华力
共价键
1.石墨晶体的结构与性质
晶体内同时存在若干种不同的作用力,具有若干种晶体的结构和性质。
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
石墨晶体中的二维平面结构
石墨的层状结构
石墨结构中未参与杂化的p轨道
层平面内C原子的配位数为3,共价键的键长很短,键能很大,石墨的熔点很高。
层与层之间靠范德华力维系,作用力弱,容易滑动,所以石墨质软,可作润滑剂。
层中每个碳原子均剩余一个未参与杂化的2p电子,所有的p轨道平行重叠,形成离域π键,这些p轨道中的电子可在整个层平面中运动。
类似共价晶体
类似分子晶体
石墨能导电,类似金属晶体
离域大π键:多个平行的p轨道肩并肩重叠而成的键,简称大π键
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
所以石墨的导电性只能沿石墨平面方向。
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面。
石墨在同一平面(同层中)每个碳原子均剩余一个未参与杂化的含1个电子的p轨道,所有的p轨道平行重叠,形成离域π键,这些p轨道中的电子可在整个层平面中运动。
因此石墨能导电(类似金属晶体的导电性)。
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
石墨晶体内既有共价键,又有类似金属键的非定域键(π键),还有范德华力,因此称为混合型晶体,兼具共价晶体、分子晶体和金属晶体的特征。
范德华力
混合型晶体
层内碳原子之间
未参与杂化的轨道上的电子可在层内运动
层与层碳原子
之间
成键的 sp2杂化轨道
π 键的p轨道
共价键
有金属键的性质
熔点高
导电
质软
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
(1)石墨所有碳原子均采取_______,形成____________ 结构
(2)石墨中碳原子与碳碳键个数比为________。
sp2杂化
平面六元并环
金刚石中碳原子均采取_______,形成____________结构
sp3杂化
三维骨架
2︰3
金刚石中碳原子与碳碳键个数比为________。
1︰2
2.石墨与金刚石的比较
金刚石的晶体结构
石墨晶体中的二维平面结构
(3)质量相同的金刚石与石墨,
两者碳原子的个数比为_______。
两者碳碳键的个数比为_______。
1︰1
4︰3
石墨中C原子以sp2杂化;
石墨晶体中最小环为六元环,
6个原子共平面,
平均含有个6×1/3=2个C原子,
6×1/2=3个C-C键 ;
石墨比金刚石质软,熔点高,更稳定
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
【问题】通过对过渡型晶体、混合型晶体的讨论,你对晶体类型有何认识?
对事物的简单分类,尽管条理鲜明,但可能只是概括了最典型的事实。
许多晶体不能被简单的归类到四种晶体的某一类。
一种结晶形碳,灰黑色,成叶片状、鳞片状和致密块状。质软,具滑腻感,能导电。化学性质不活泼,耐腐蚀,在空气或氧气中强热可以燃烧生成CO2。石墨可用作润滑剂,可用于制造坩埚、电极、铅笔芯等。
石墨用途
石墨电极
石墨坩埚
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
C70
C540
C240
碳纳米管
单层石墨片
C60
几种碳单质
三、资料卡片——硅酸盐
原创:WJ化学研究院
邮箱wj-chem@
SiO44-
Si2O76-
单链
双链
六元环(SiO3)612-
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如SiO44-、Si2O76-、(SiO3)612-(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分Si被Al取代则得到铝硅酸盐。
四、科学 技术 社会——纳米晶体
原创:WJ化学研究院
邮箱wj-chem@
①纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。
纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
②金属铅晶体的熔点3280C。但纳米铅晶体大小与熔点的关系如图
由此可见,晶体颗粒小于200 nm 时,晶粒越小,金属铅的熔点越低。
③纳米晶体为什么会有不同于大块晶体的特性呢
我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm (或者250 nm )时,其熔点会发生变化。
1nm=10-9m
主要原因是晶体的表面积增大
课题练习
原创:WJ化学研究院
邮箱wj-chem@
判断正误
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离 子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)石墨的二维结构内,每个碳原子的配位数为3( )
(6)石墨的导电只能沿石墨平面的方向进行( )
(7)石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
×
×
×
√
√
√
√
六、研究与实践——明矾晶体的制备
原创:WJ化学研究院
邮箱wj-chem@
【结果与讨论】
(1)你是否得到了完美的明矶晶体 请描述你制备的明矾晶体颜色和外形。
能得到明矾晶体,但要得到完美的明矾晶体是比较困难的。
颜色:无色透明;外形:块状,有平滑的晶面与棱角。
教材:P93
六、研究与实践——明矾晶体的制备
原创:WJ化学研究院
邮箱wj-chem@
(2)在上述实验中,为什么所用仪器都要用蒸馏水洗净 为什么晶种一定要悬挂在溶液的中央位置
(3)在上述实验中,制备明矾大晶体所需时间较长。请查阅资料,并制订快速制备明矾大晶体的实验方案。
仪器用蒸馏水洗净,是防止杂质影响结晶的纯度,也会影响结晶的速率与形状。晶种悬挂在溶液中央位置,有利于离子对称地扩散、溶角解与结晶,有利于获得外形对称性较好的晶体。离杯底太近,会与沉底晶体生长在一起,离液面龙大近或者杯壁太近,也会造成同样结果,使晶体形状不规则。
称取约60g明矾,量取60mL蒸馏水,倒入100mL烧杯中,将明矾溶解于水,边搅拌边加热,加热到90℃。选择晶形规则的晶体作为晶种,用棉线拴住,待溶液温度约下降5~6℃,再将其吊在上方,使得晶体处于溶液中的中心位置。30min后,就会很明显地观察到约有1cm3大小的规则的八面体结构的明矾晶体出现。且在此过程中,每隔几分钟,就可以观察到晶体大小的明显变化。(此方案仅作参考)
该作品属于《WJ化学研究院》原创,如有需要请
通过wj-chem@与我联系

选择性必修二 第三节 金属晶体与离子晶体
第3学时 过渡晶体与混合型晶体
WJ化学研究院
第三章
Institute of Chemistry
2023
学习目标
原创:WJ化学研究院
邮箱wj-chem@
1.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存
在的。
2.了解过渡晶体,掌握石墨这一混合型晶体的结构特点。
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
晶体
分子晶体
共价晶体
离子晶体
金属晶体
Fe
共价键
分子间作用力
离子键
共价键
金属键
【思考与讨论】晶体类型之间存在绝对的界限吗?
事实上,纯粹的典型晶体是不多的,
大多数晶体是典型晶体之间的晶体----过渡晶体。
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
晶体
共价晶体
离子晶体
共价键
离子键
电负性差值大于1.7通常形成离子键。
电负性差值小于1.7通常形成共价键。
化学键既不是纯粹的离子键,也不是纯粹的共价键
离子晶体与共价晶体之间的存在过渡晶体
既不是纯粹的离子晶体,也不是纯粹的共价晶体
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
近代实验表明,纯粹的离子键是不存在的,绝大多数离子键都不是典型的,只是离子性占优势而已。
例如:铯的电负性为0.7,而氟的电负性为4.0,两者之差是所有元素中电负性差值最大的,因此氟化铯(CsF)是典型的离子晶体。
但Cs﹢与F﹣的结合也不完全是纯静电作用,仍有部分共价性质。其离子键成分也只是92%,其余8%为共价键成分。这说明即便是像铯和氟这样典型的金属和典型的非金属形成化学键时,成键原子轨道之间依然有部分重叠。
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
离子键成分的百分数更小,共价键不再贯穿整个晶体,
离子键的百分数大于50%,
当作离子晶体处理
离子键的百分数小于50%,
偏向共价晶体,当作共价晶体处理
第三周期元素的氧化物中,化学键中离子键的百分数
是分子晶体
一般,当电负性的差值△χ >1.7时,离子键的百分数大于50%。可认为是离子晶体。电负性差值越大,离子键的百分数越大。
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
1
2
3
4
分子晶体
共价晶体
离子晶体
金属晶体
晶体
2.晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
1.四种典型晶体类型都存在过渡晶体
概念:介于某两种晶体类型之间的晶体
一、过渡晶体
原创:WJ化学研究院
邮箱wj-chem@
1.正误判断
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅局限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)Al2O3晶体中存在离子键,属于离子晶体( )
√
×
×
√
×
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?你认为是什么造成了这种差异?
结构 性质
决定
熔点很高
质地坚硬
不能导电
共价晶体
熔点很高
质地较软
导电性好
?晶体
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
碳原子均采取sp2杂化,
形成平面六元并环结构。
层内C原子以共价键结合,
层间靠范德华力维系。
石墨的层状结构
混合型晶体:
石墨晶体是一种典型的混合型晶体。
范德华力
共价键
1.石墨晶体的结构与性质
晶体内同时存在若干种不同的作用力,具有若干种晶体的结构和性质。
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
石墨晶体中的二维平面结构
石墨的层状结构
石墨结构中未参与杂化的p轨道
层平面内C原子的配位数为3,共价键的键长很短,键能很大,石墨的熔点很高。
层与层之间靠范德华力维系,作用力弱,容易滑动,所以石墨质软,可作润滑剂。
层中每个碳原子均剩余一个未参与杂化的2p电子,所有的p轨道平行重叠,形成离域π键,这些p轨道中的电子可在整个层平面中运动。
类似共价晶体
类似分子晶体
石墨能导电,类似金属晶体
离域大π键:多个平行的p轨道肩并肩重叠而成的键,简称大π键
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
所以石墨的导电性只能沿石墨平面方向。
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面。
石墨在同一平面(同层中)每个碳原子均剩余一个未参与杂化的含1个电子的p轨道,所有的p轨道平行重叠,形成离域π键,这些p轨道中的电子可在整个层平面中运动。
因此石墨能导电(类似金属晶体的导电性)。
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
石墨晶体内既有共价键,又有类似金属键的非定域键(π键),还有范德华力,因此称为混合型晶体,兼具共价晶体、分子晶体和金属晶体的特征。
范德华力
混合型晶体
层内碳原子之间
未参与杂化的轨道上的电子可在层内运动
层与层碳原子
之间
成键的 sp2杂化轨道
π 键的p轨道
共价键
有金属键的性质
熔点高
导电
质软
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
(1)石墨所有碳原子均采取_______,形成____________ 结构
(2)石墨中碳原子与碳碳键个数比为________。
sp2杂化
平面六元并环
金刚石中碳原子均采取_______,形成____________结构
sp3杂化
三维骨架
2︰3
金刚石中碳原子与碳碳键个数比为________。
1︰2
2.石墨与金刚石的比较
金刚石的晶体结构
石墨晶体中的二维平面结构
(3)质量相同的金刚石与石墨,
两者碳原子的个数比为_______。
两者碳碳键的个数比为_______。
1︰1
4︰3
石墨中C原子以sp2杂化;
石墨晶体中最小环为六元环,
6个原子共平面,
平均含有个6×1/3=2个C原子,
6×1/2=3个C-C键 ;
石墨比金刚石质软,熔点高,更稳定
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
【问题】通过对过渡型晶体、混合型晶体的讨论,你对晶体类型有何认识?
对事物的简单分类,尽管条理鲜明,但可能只是概括了最典型的事实。
许多晶体不能被简单的归类到四种晶体的某一类。
一种结晶形碳,灰黑色,成叶片状、鳞片状和致密块状。质软,具滑腻感,能导电。化学性质不活泼,耐腐蚀,在空气或氧气中强热可以燃烧生成CO2。石墨可用作润滑剂,可用于制造坩埚、电极、铅笔芯等。
石墨用途
石墨电极
石墨坩埚
二、混合型晶体——石墨
原创:WJ化学研究院
邮箱wj-chem@
C70
C540
C240
碳纳米管
单层石墨片
C60
几种碳单质
三、资料卡片——硅酸盐
原创:WJ化学研究院
邮箱wj-chem@
SiO44-
Si2O76-
单链
双链
六元环(SiO3)612-
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如SiO44-、Si2O76-、(SiO3)612-(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分Si被Al取代则得到铝硅酸盐。
四、科学 技术 社会——纳米晶体
原创:WJ化学研究院
邮箱wj-chem@
①纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。
纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
②金属铅晶体的熔点3280C。但纳米铅晶体大小与熔点的关系如图
由此可见,晶体颗粒小于200 nm 时,晶粒越小,金属铅的熔点越低。
③纳米晶体为什么会有不同于大块晶体的特性呢
我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm (或者250 nm )时,其熔点会发生变化。
1nm=10-9m
主要原因是晶体的表面积增大
课题练习
原创:WJ化学研究院
邮箱wj-chem@
判断正误
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离 子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)石墨的二维结构内,每个碳原子的配位数为3( )
(6)石墨的导电只能沿石墨平面的方向进行( )
(7)石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
×
×
×
√
√
√
√
六、研究与实践——明矾晶体的制备
原创:WJ化学研究院
邮箱wj-chem@
【结果与讨论】
(1)你是否得到了完美的明矶晶体 请描述你制备的明矾晶体颜色和外形。
能得到明矾晶体,但要得到完美的明矾晶体是比较困难的。
颜色:无色透明;外形:块状,有平滑的晶面与棱角。
教材:P93
六、研究与实践——明矾晶体的制备
原创:WJ化学研究院
邮箱wj-chem@
(2)在上述实验中,为什么所用仪器都要用蒸馏水洗净 为什么晶种一定要悬挂在溶液的中央位置
(3)在上述实验中,制备明矾大晶体所需时间较长。请查阅资料,并制订快速制备明矾大晶体的实验方案。
仪器用蒸馏水洗净,是防止杂质影响结晶的纯度,也会影响结晶的速率与形状。晶种悬挂在溶液中央位置,有利于离子对称地扩散、溶角解与结晶,有利于获得外形对称性较好的晶体。离杯底太近,会与沉底晶体生长在一起,离液面龙大近或者杯壁太近,也会造成同样结果,使晶体形状不规则。
称取约60g明矾,量取60mL蒸馏水,倒入100mL烧杯中,将明矾溶解于水,边搅拌边加热,加热到90℃。选择晶形规则的晶体作为晶种,用棉线拴住,待溶液温度约下降5~6℃,再将其吊在上方,使得晶体处于溶液中的中心位置。30min后,就会很明显地观察到约有1cm3大小的规则的八面体结构的明矾晶体出现。且在此过程中,每隔几分钟,就可以观察到晶体大小的明显变化。(此方案仅作参考)
