8.2第二节 海水“晒盐“第1课时(海水晒盐的过程和粗盐提纯)课件(共53张PPT 内嵌视频)—2022-2023学年九年级化学鲁教版下册
文档属性
| 名称 | 8.2第二节 海水“晒盐“第1课时(海水晒盐的过程和粗盐提纯)课件(共53张PPT 内嵌视频)—2022-2023学年九年级化学鲁教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 23.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 14:56:44 | ||
图片预览








文档简介
(共53张PPT)
第二节 海水晒盐
第八单元 海水中的化学
第1课时
1.通过认识海水“晒盐”过程,能知道海水晒盐的基本原理是蒸发结晶。
2.通过指导学生进行粗盐提纯的实验,使学生初步学会这一分离混合物的基本操作方法。
学 习 目 标
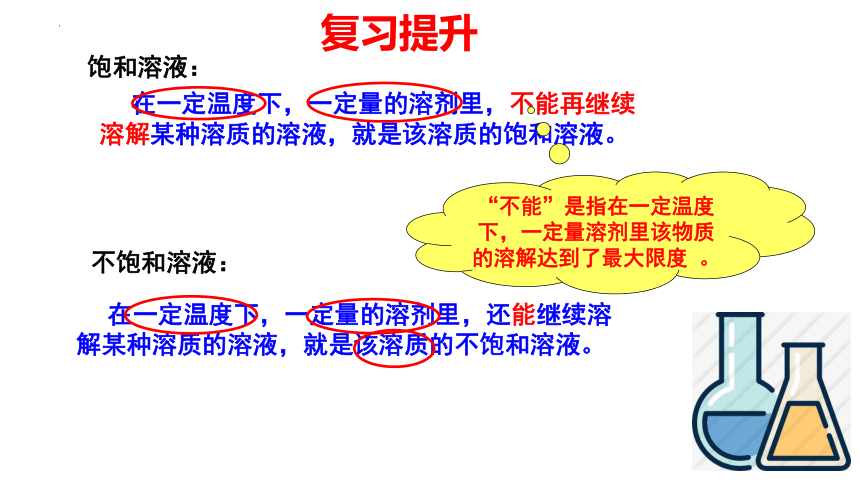
饱和溶液:
在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
“不能”是指在一定温度下,一定量溶剂里该物质的溶解达到了最大限度 。
在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液,就是该溶质的不饱和溶液。
不饱和溶液:
复习提升
(3)在一定温度下KNO3的饱和溶液不能溶解任何溶质。
(1)25℃时,30克NaCl的饱和溶液中倒出一半,则所剩下的溶液的浓度减少。
(2)25℃时,KNO3的饱和溶液一定比同温度下KNO3的不饱和溶液浓度大。
判断下列说法是否正确?
(4) 温度降低不饱和溶液一定能变为饱和溶液。
复习提升
判断下列溶液是否是饱和溶液?
3、一定温度下,一定量的溶剂中,溶质不再继续溶解的溶液
2、蒸发水或改变温度下,析出溶质后的溶液
1、在试管中没有未溶解的固体物质的溶液
不一定
一定是
一定是
复习提升
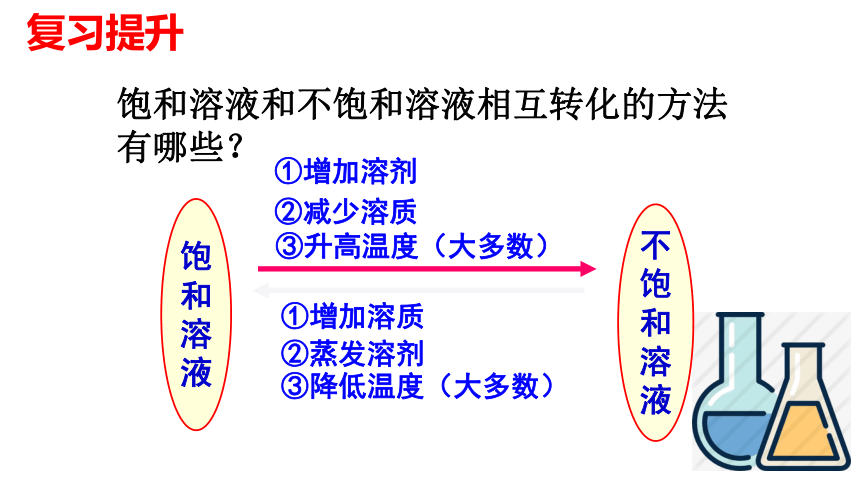
①增加溶质
③降低温度(大多数)
②蒸发溶剂
①增加溶剂
③升高温度(大多数)
饱和溶液和不饱和溶液相互转化的方法有哪些?
饱
和
溶
液
不
饱
和
溶
液
②减少溶质
复习提升
导入新课
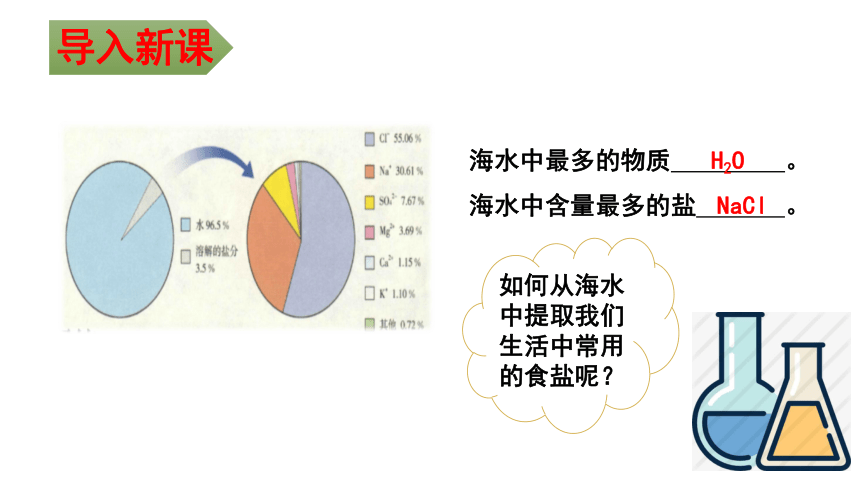
海水中最多的物质 。
海水中含量最多的盐 。
H2O
NaCl
如何从海水中提取我们生活中常用的食盐呢?
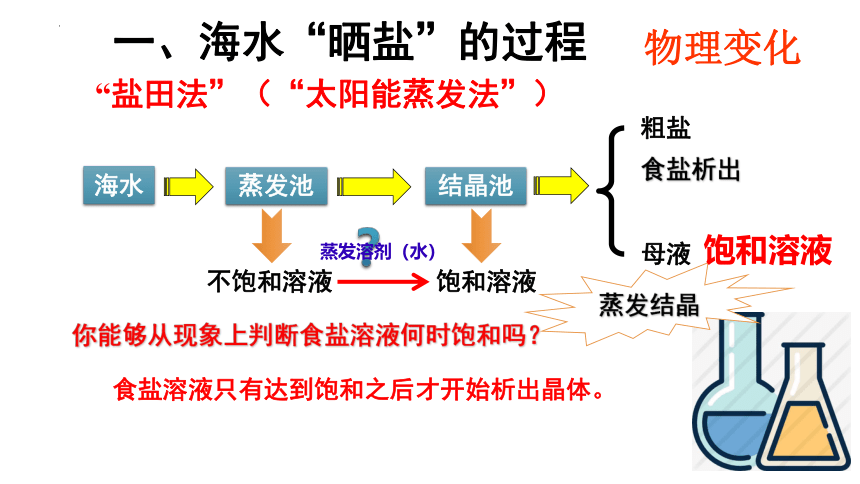
海水
蒸发池
结晶池
粗盐
母液
不饱和溶液
饱和溶液
?
蒸发溶剂(水)
你能够从现象上判断食盐溶液何时饱和吗?
食盐析出
蒸发结晶
食盐溶液只有达到饱和之后才开始析出晶体。
物理变化
一、海水“晒盐”的过程
“盐田法”(“太阳能蒸发法”)
饱和溶液
上述过程中,氯化钠溶液从不饱和变为饱和的途径是什么?你能够从现象上判断溶液何时饱和的吗?
你认为哪些自然条件有利于海水“晒盐”?为什么?
蒸发水分;根据食盐溶液中是否有未溶解固体来判断。如果有未溶解的食盐固体存在,则说明溶液已达到饱和状态。
气温高、湿度低、风力大、阳光充足、雨量少等。这些条件有利于水分的蒸发,形成食盐的饱和溶液。
讨论与交流
☆晶体:具有规则几何外形的固体。
食盐晶体
硫酸铜晶体
硝酸钾晶体
明矾晶体
结晶
固体物质从它的饱和溶液中以晶
体的形式析出的过程叫做结晶。
注:蒸发结晶是结晶的途径之一
结晶的方法:蒸发结晶、降温结晶。
蒸发结晶
结晶的途径之一
海水
食盐饱和溶液
析出晶体
蒸发水分
继续蒸发
食盐不饱和溶液
有白色固体析出
食盐晶体
盐场:
河北的长芦盐场
山东的莱州湾盐场
辽东湾盐区
江苏盐场
海水
蒸发池
结晶池
母液
导入新课
海水晒盐的主要流程
粗盐
可溶性杂质
不溶性杂质
氯化镁MgCl2、硫酸钠Na2SO4、氯化钙CaCl2
等
三、粗盐的提纯
三、粗盐的提纯
CaCl2 MgCl2 Na2SO4
杂质:
难溶性的
泥沙
可溶性的
分析粗盐成分
Cl-
Mg2+
Na+
Ca2+
SO42-
H2O
产品:NaCl
三、粗盐的提纯
任务一:除难溶性杂质(泥沙)
1.怎样将粗盐中的泥沙除去?
2.过滤过程中需要注意哪些问题?
3.蒸发过程中需要注意哪些问题?
4.在各步骤中使用次数最多的仪器是什么?
有何作用?
阅读课本P40-41,P48,回答下列问题
粗盐提纯的操作步骤
①溶解
②过滤
③蒸发
仪器:
烧杯、玻璃棒
玻璃棒的作用:搅拌加速溶解
温馨提示:加水量要适中。即:使食盐恰好完全溶解为最佳。
①溶解
仪器:
铁架台、烧杯、漏斗、玻璃棒
玻璃棒的作用:引流
②过滤
烧杯靠玻璃棒
玻璃棒靠
三层滤纸
滤纸边缘
低于漏斗边缘
滤液液面低于
滤纸的边缘
滤纸紧贴漏斗无气泡
漏斗末端靠
烧杯内壁
一贴二低三靠
仪器:
铁架台、蒸发皿、
玻璃棒、酒精灯
玻璃棒的作用:搅拌使液体受热均匀,防止液体飞溅
③蒸发
1、要用玻璃棒不断搅拌,防止局部过高,造成液滴飞溅
2、当蒸发皿内有大量晶体析出时,请停止加热,利用余热使滤液蒸干。
3、不要立即把蒸发皿直接放在实验台上,以免烫坏实验台,热的蒸发皿要用坩锅钳夹取,不能用手碰。
蒸发过程中要注意:
搅拌,使液体受热均匀,防止局部温度过高而造成液滴飞溅
①溶解
②过滤
③蒸发
【思考】粗盐提纯中:溶解、过滤、蒸发操作都用到了什么仪器?每一步中分别起了什么作用?
搅拌加速溶解
引流,防止液体溅出
玻璃棒
杂质:
成分:NaCl
部分可溶性杂质
三、粗盐的提纯
Cl-
Mg2+
Na+
Ca2+
SO42-
任务二:除可溶性杂质
Mg2+
Ca2+
SO42-
难溶性杂质
CaCl2、MgCl2、Na2SO4等
化学方法除杂质小结
1.化学方法除杂质的原则:
不增——不引入新杂质
不减——不减少被提纯的物质
易分离——被提纯的物质与杂质容易分离
2.除杂的一般方法:
加入化学试剂,让杂质离子转化成气体、沉淀或H2O除去
Cl-
Mg2+
Na+
Ca2+
SO42-
OH- Cl- SO42- CO32-
H+ 溶 溶 溶
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
部分物质的溶解性
任务二:除可溶性杂质
OH-
CO32-
Ba2+
杂 质 加入的试剂 化学方程式
Na2SO4
MgCl2
CaCl2
BaCl2
NaOH
Na2CO3
BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
过量
过量
过量
⑤蒸发
过滤
NaCl
Na2SO4 CaCl2 MgCl2
NaCl
CaCl2 MgCl2
BaCl2
NaCl
NaOH
Na2CO3
NaCl
CaCl2
BaCl2
NaOH
①过量BaCl2溶液
NaCl
H2O
②过量NaOH溶液
NaCl
PH试纸
红色物质都要去掉
④适量 HCI
③过量Na2CO3溶液
请你思考:
1、加入的试剂为什么是过量的?
作用分别是什么?
2、能否将氯化钡换成硝酸钡?为什么?
3、除去粗盐中的可溶性杂质的方法是什么?
食盐的用途:是重要的 和食品添加剂、化工原料。
调味品
温馨提示
(1)在除杂过程中,加入氯化钡和碳酸钠溶液的步骤不能颠倒,若加入两种溶液的顺序颠倒,会导致过量的氯化钡溶液无法除去,从而形成新的杂质
(2)在加入盐酸调节溶液的PH之前必须进行过滤操作,否则生产的沉淀会再次溶解形成杂质
(3)理论上最终所得氯化钠的质量比除杂前要多,这是因为在除杂过程中生成了氯化钠。
除杂过程:
过量BaCl2溶液
过量NaOH溶液
过量Na2CO3溶液
过滤
适量HCl
精制食盐水
粗盐水
除Na2SO4
除MgCl2
除CaCl2
和过量的BaCl2
除沉淀
除过量的Na2CO3、NaOH
加入除杂试剂的顺序可以是:
注意
☆先加BaCl2溶液,后加Na2CO3溶液;
☆稀盐酸过滤后加入。
1.BaCl2→NaOH →Na2CO3 HCl
2. BaCl2→ Na2CO3 → NaOH HCl
3. NaOH →BaCl2→ Na2CO3 HCl
过滤
过滤
过滤
(2)加入试剂的作用
②过量的氯化钡:_______________,化学方程式为
_________________________________________
③过量的氢氧化钠:_______________,化学方程式为
_________________________________________
④过量的碳酸钠:_____________________________,化学方程式为_________________________________________
⑥适量的盐酸:______________________,化学方程式为
完全除去Na2SO4
Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
完全除去MgCl2
MgCl2 + 2NaOH ==== Mg(OH)2↓ + 2NaCl
完全除去CaCl2,
CaCl2 + Na2CO3 ==== CaCO3↓ + 2NaCl
BaCl2 + Na2CO3 ==== BaCO3↓ + 2NaCl
完全除去过量的NaOH和 Na2CO3
NaOH + HCl ==== H2O + NaCl
Na2CO3 + 2HCl==== CO2↑ + H2O + 2NaCl
除去过量的BaCl2
请写出有关反应的化学方程式:
Na2SO4 + BaCl2 ==== BaSO4↓+2NaCl
CaCl2 + Na2CO3 ==== 2NaCl + CaCO3 ↓
BaCl2 + Na2CO3 ==== 2NaCl + BaCO3 ↓
Na2CO3 + 2HCl ==== 2NaCl+ CO2↑+ H2O
NaOH + HCl ==== NaCl + H2O
2NaOH + MgCl2 ==== 2NaCl+ Mg(OH)2 ↓
方法提升
物理方法
过滤
蒸发结晶
蒸馏
气体
水
化学方法
沉淀
物质提纯的一般思路
纯净物
混合物
转移
总结:可溶性杂质的去除
(1)原则:除去杂质的同时不引入新的杂质。
(2)方法:加入化学试剂,
让杂质离子转化成气体、沉淀或水除去。
(3)需考虑的因素:
a.加入合适的试剂;
b.试剂的用量;
c.加入试剂的先后顺序;
d.过量试剂的处理等问题。
Cl-
Mg2+
Na+
Ca2+
SO42-
Ba2+
OH-
CO32-
方法 依据原理 举例
总结分离混合物的方法
分离不溶性固体和液体
分离可溶性固体和液体
分离沸点不同的液体
将可溶性离子转化为沉淀
除去粗盐中的泥沙
净化黄泥水
海水晒盐
蒸馏海水
分离液态空气
石油分馏
海水富集镁
除去粗盐中可溶性杂质
分离溶解度受温度影响较大的可溶性物质
从硝酸钾溶液中获取硝酸钾
从食盐水中得到食盐
过滤
蒸发
蒸馏
化学
沉淀法
降温
结晶
说明除去下列物质中少量杂质的方法和依据的原理
1、白砂糖中混有细沙
2、KNO3中晶体混有NaCl
3、酒精中混有水
4、铁粉中混有铜粉
初试牛刀
过滤
降温结晶
蒸馏
吸附
快速判断下列除杂方法是否正确?并说明理由
(1)NaCl ( Na2CO3) 用稀硫酸
(2)CO2(CO) 用石灰水
(3) Na2SO4 (CuSO4) 用Ba(OH)2溶液
(4)NaOH (Na2CO3) 用稀盐酸(HCl )
(5)CaO (CaCO3) 用稀盐酸HCl
再显身手
除去难溶性杂质后的食盐是混合物,其溶液中还含有硫酸根离子、______、钙离子等杂质离子,为除去这些杂质离子,应向食盐水中加入过量的氯化钡、______、碳酸钠物质,将杂质离子转化为______,通过______方法除去4种沉淀后再加入适量的______,除去多余______和______,得到精盐水,最后经蒸发结晶即得到______。
【答案】镁离子(或Mg2+);氢氧化钠(或NaOH);沉淀;过滤;盐酸 ;氢氧根离子;碳酸根离子;精盐
当堂演练
粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )A.②③①④ B.③②①④
C.①③②④ D.③①②④
A
当堂演练
2.食盐的用途
(1)食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。
(2)食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料,被广泛用于制造化学肥料、塑料、合成橡胶和染料等。
1.从海水中提取食盐的流程如下,下列说法错误的是( )
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中,氯化钠溶液逐渐变浓
C.经过第③步的操作,进入结晶池后,继续蒸发水,有④发生
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
D
课 堂 达 标
C
课 堂 达 标
2.下列有关粗盐提纯实验中的相关装置和操作,正确的是( )
A.溶解粗盐
B.过滤食盐水
C. 蒸发食盐水
D. 冷却蒸发皿
A
3.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是( )A.多加水,让粗盐加速溶解B.玻璃棒用了4次,但作用各不相同C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
A
4.为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,实验操作过程如下图所示:下列说法错误的是
A.实验操作步骤也可以是①③④②⑤⑥B.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7C.在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒D.操作⑤得到的沉淀中共有四种物质
C
第二节 海水晒盐
第八单元 海水中的化学
第1课时
1.通过认识海水“晒盐”过程,能知道海水晒盐的基本原理是蒸发结晶。
2.通过指导学生进行粗盐提纯的实验,使学生初步学会这一分离混合物的基本操作方法。
学 习 目 标
饱和溶液:
在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
“不能”是指在一定温度下,一定量溶剂里该物质的溶解达到了最大限度 。
在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液,就是该溶质的不饱和溶液。
不饱和溶液:
复习提升
(3)在一定温度下KNO3的饱和溶液不能溶解任何溶质。
(1)25℃时,30克NaCl的饱和溶液中倒出一半,则所剩下的溶液的浓度减少。
(2)25℃时,KNO3的饱和溶液一定比同温度下KNO3的不饱和溶液浓度大。
判断下列说法是否正确?
(4) 温度降低不饱和溶液一定能变为饱和溶液。
复习提升
判断下列溶液是否是饱和溶液?
3、一定温度下,一定量的溶剂中,溶质不再继续溶解的溶液
2、蒸发水或改变温度下,析出溶质后的溶液
1、在试管中没有未溶解的固体物质的溶液
不一定
一定是
一定是
复习提升
①增加溶质
③降低温度(大多数)
②蒸发溶剂
①增加溶剂
③升高温度(大多数)
饱和溶液和不饱和溶液相互转化的方法有哪些?
饱
和
溶
液
不
饱
和
溶
液
②减少溶质
复习提升
导入新课
海水中最多的物质 。
海水中含量最多的盐 。
H2O
NaCl
如何从海水中提取我们生活中常用的食盐呢?
海水
蒸发池
结晶池
粗盐
母液
不饱和溶液
饱和溶液
?
蒸发溶剂(水)
你能够从现象上判断食盐溶液何时饱和吗?
食盐析出
蒸发结晶
食盐溶液只有达到饱和之后才开始析出晶体。
物理变化
一、海水“晒盐”的过程
“盐田法”(“太阳能蒸发法”)
饱和溶液
上述过程中,氯化钠溶液从不饱和变为饱和的途径是什么?你能够从现象上判断溶液何时饱和的吗?
你认为哪些自然条件有利于海水“晒盐”?为什么?
蒸发水分;根据食盐溶液中是否有未溶解固体来判断。如果有未溶解的食盐固体存在,则说明溶液已达到饱和状态。
气温高、湿度低、风力大、阳光充足、雨量少等。这些条件有利于水分的蒸发,形成食盐的饱和溶液。
讨论与交流
☆晶体:具有规则几何外形的固体。
食盐晶体
硫酸铜晶体
硝酸钾晶体
明矾晶体
结晶
固体物质从它的饱和溶液中以晶
体的形式析出的过程叫做结晶。
注:蒸发结晶是结晶的途径之一
结晶的方法:蒸发结晶、降温结晶。
蒸发结晶
结晶的途径之一
海水
食盐饱和溶液
析出晶体
蒸发水分
继续蒸发
食盐不饱和溶液
有白色固体析出
食盐晶体
盐场:
河北的长芦盐场
山东的莱州湾盐场
辽东湾盐区
江苏盐场
海水
蒸发池
结晶池
母液
导入新课
海水晒盐的主要流程
粗盐
可溶性杂质
不溶性杂质
氯化镁MgCl2、硫酸钠Na2SO4、氯化钙CaCl2
等
三、粗盐的提纯
三、粗盐的提纯
CaCl2 MgCl2 Na2SO4
杂质:
难溶性的
泥沙
可溶性的
分析粗盐成分
Cl-
Mg2+
Na+
Ca2+
SO42-
H2O
产品:NaCl
三、粗盐的提纯
任务一:除难溶性杂质(泥沙)
1.怎样将粗盐中的泥沙除去?
2.过滤过程中需要注意哪些问题?
3.蒸发过程中需要注意哪些问题?
4.在各步骤中使用次数最多的仪器是什么?
有何作用?
阅读课本P40-41,P48,回答下列问题
粗盐提纯的操作步骤
①溶解
②过滤
③蒸发
仪器:
烧杯、玻璃棒
玻璃棒的作用:搅拌加速溶解
温馨提示:加水量要适中。即:使食盐恰好完全溶解为最佳。
①溶解
仪器:
铁架台、烧杯、漏斗、玻璃棒
玻璃棒的作用:引流
②过滤
烧杯靠玻璃棒
玻璃棒靠
三层滤纸
滤纸边缘
低于漏斗边缘
滤液液面低于
滤纸的边缘
滤纸紧贴漏斗无气泡
漏斗末端靠
烧杯内壁
一贴二低三靠
仪器:
铁架台、蒸发皿、
玻璃棒、酒精灯
玻璃棒的作用:搅拌使液体受热均匀,防止液体飞溅
③蒸发
1、要用玻璃棒不断搅拌,防止局部过高,造成液滴飞溅
2、当蒸发皿内有大量晶体析出时,请停止加热,利用余热使滤液蒸干。
3、不要立即把蒸发皿直接放在实验台上,以免烫坏实验台,热的蒸发皿要用坩锅钳夹取,不能用手碰。
蒸发过程中要注意:
搅拌,使液体受热均匀,防止局部温度过高而造成液滴飞溅
①溶解
②过滤
③蒸发
【思考】粗盐提纯中:溶解、过滤、蒸发操作都用到了什么仪器?每一步中分别起了什么作用?
搅拌加速溶解
引流,防止液体溅出
玻璃棒
杂质:
成分:NaCl
部分可溶性杂质
三、粗盐的提纯
Cl-
Mg2+
Na+
Ca2+
SO42-
任务二:除可溶性杂质
Mg2+
Ca2+
SO42-
难溶性杂质
CaCl2、MgCl2、Na2SO4等
化学方法除杂质小结
1.化学方法除杂质的原则:
不增——不引入新杂质
不减——不减少被提纯的物质
易分离——被提纯的物质与杂质容易分离
2.除杂的一般方法:
加入化学试剂,让杂质离子转化成气体、沉淀或H2O除去
Cl-
Mg2+
Na+
Ca2+
SO42-
OH- Cl- SO42- CO32-
H+ 溶 溶 溶
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
部分物质的溶解性
任务二:除可溶性杂质
OH-
CO32-
Ba2+
杂 质 加入的试剂 化学方程式
Na2SO4
MgCl2
CaCl2
BaCl2
NaOH
Na2CO3
BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
过量
过量
过量
⑤蒸发
过滤
NaCl
Na2SO4 CaCl2 MgCl2
NaCl
CaCl2 MgCl2
BaCl2
NaCl
NaOH
Na2CO3
NaCl
CaCl2
BaCl2
NaOH
①过量BaCl2溶液
NaCl
H2O
②过量NaOH溶液
NaCl
PH试纸
红色物质都要去掉
④适量 HCI
③过量Na2CO3溶液
请你思考:
1、加入的试剂为什么是过量的?
作用分别是什么?
2、能否将氯化钡换成硝酸钡?为什么?
3、除去粗盐中的可溶性杂质的方法是什么?
食盐的用途:是重要的 和食品添加剂、化工原料。
调味品
温馨提示
(1)在除杂过程中,加入氯化钡和碳酸钠溶液的步骤不能颠倒,若加入两种溶液的顺序颠倒,会导致过量的氯化钡溶液无法除去,从而形成新的杂质
(2)在加入盐酸调节溶液的PH之前必须进行过滤操作,否则生产的沉淀会再次溶解形成杂质
(3)理论上最终所得氯化钠的质量比除杂前要多,这是因为在除杂过程中生成了氯化钠。
除杂过程:
过量BaCl2溶液
过量NaOH溶液
过量Na2CO3溶液
过滤
适量HCl
精制食盐水
粗盐水
除Na2SO4
除MgCl2
除CaCl2
和过量的BaCl2
除沉淀
除过量的Na2CO3、NaOH
加入除杂试剂的顺序可以是:
注意
☆先加BaCl2溶液,后加Na2CO3溶液;
☆稀盐酸过滤后加入。
1.BaCl2→NaOH →Na2CO3 HCl
2. BaCl2→ Na2CO3 → NaOH HCl
3. NaOH →BaCl2→ Na2CO3 HCl
过滤
过滤
过滤
(2)加入试剂的作用
②过量的氯化钡:_______________,化学方程式为
_________________________________________
③过量的氢氧化钠:_______________,化学方程式为
_________________________________________
④过量的碳酸钠:_____________________________,化学方程式为_________________________________________
⑥适量的盐酸:______________________,化学方程式为
完全除去Na2SO4
Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
完全除去MgCl2
MgCl2 + 2NaOH ==== Mg(OH)2↓ + 2NaCl
完全除去CaCl2,
CaCl2 + Na2CO3 ==== CaCO3↓ + 2NaCl
BaCl2 + Na2CO3 ==== BaCO3↓ + 2NaCl
完全除去过量的NaOH和 Na2CO3
NaOH + HCl ==== H2O + NaCl
Na2CO3 + 2HCl==== CO2↑ + H2O + 2NaCl
除去过量的BaCl2
请写出有关反应的化学方程式:
Na2SO4 + BaCl2 ==== BaSO4↓+2NaCl
CaCl2 + Na2CO3 ==== 2NaCl + CaCO3 ↓
BaCl2 + Na2CO3 ==== 2NaCl + BaCO3 ↓
Na2CO3 + 2HCl ==== 2NaCl+ CO2↑+ H2O
NaOH + HCl ==== NaCl + H2O
2NaOH + MgCl2 ==== 2NaCl+ Mg(OH)2 ↓
方法提升
物理方法
过滤
蒸发结晶
蒸馏
气体
水
化学方法
沉淀
物质提纯的一般思路
纯净物
混合物
转移
总结:可溶性杂质的去除
(1)原则:除去杂质的同时不引入新的杂质。
(2)方法:加入化学试剂,
让杂质离子转化成气体、沉淀或水除去。
(3)需考虑的因素:
a.加入合适的试剂;
b.试剂的用量;
c.加入试剂的先后顺序;
d.过量试剂的处理等问题。
Cl-
Mg2+
Na+
Ca2+
SO42-
Ba2+
OH-
CO32-
方法 依据原理 举例
总结分离混合物的方法
分离不溶性固体和液体
分离可溶性固体和液体
分离沸点不同的液体
将可溶性离子转化为沉淀
除去粗盐中的泥沙
净化黄泥水
海水晒盐
蒸馏海水
分离液态空气
石油分馏
海水富集镁
除去粗盐中可溶性杂质
分离溶解度受温度影响较大的可溶性物质
从硝酸钾溶液中获取硝酸钾
从食盐水中得到食盐
过滤
蒸发
蒸馏
化学
沉淀法
降温
结晶
说明除去下列物质中少量杂质的方法和依据的原理
1、白砂糖中混有细沙
2、KNO3中晶体混有NaCl
3、酒精中混有水
4、铁粉中混有铜粉
初试牛刀
过滤
降温结晶
蒸馏
吸附
快速判断下列除杂方法是否正确?并说明理由
(1)NaCl ( Na2CO3) 用稀硫酸
(2)CO2(CO) 用石灰水
(3) Na2SO4 (CuSO4) 用Ba(OH)2溶液
(4)NaOH (Na2CO3) 用稀盐酸(HCl )
(5)CaO (CaCO3) 用稀盐酸HCl
再显身手
除去难溶性杂质后的食盐是混合物,其溶液中还含有硫酸根离子、______、钙离子等杂质离子,为除去这些杂质离子,应向食盐水中加入过量的氯化钡、______、碳酸钠物质,将杂质离子转化为______,通过______方法除去4种沉淀后再加入适量的______,除去多余______和______,得到精盐水,最后经蒸发结晶即得到______。
【答案】镁离子(或Mg2+);氢氧化钠(或NaOH);沉淀;过滤;盐酸 ;氢氧根离子;碳酸根离子;精盐
当堂演练
粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )A.②③①④ B.③②①④
C.①③②④ D.③①②④
A
当堂演练
2.食盐的用途
(1)食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。
(2)食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料,被广泛用于制造化学肥料、塑料、合成橡胶和染料等。
1.从海水中提取食盐的流程如下,下列说法错误的是( )
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中,氯化钠溶液逐渐变浓
C.经过第③步的操作,进入结晶池后,继续蒸发水,有④发生
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
D
课 堂 达 标
C
课 堂 达 标
2.下列有关粗盐提纯实验中的相关装置和操作,正确的是( )
A.溶解粗盐
B.过滤食盐水
C. 蒸发食盐水
D. 冷却蒸发皿
A
3.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是( )A.多加水,让粗盐加速溶解B.玻璃棒用了4次,但作用各不相同C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
A
4.为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,实验操作过程如下图所示:下列说法错误的是
A.实验操作步骤也可以是①③④②⑤⑥B.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7C.在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒D.操作⑤得到的沉淀中共有四种物质
C
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
