5.1 生活中的酸和碱 同步练习(含答案) 2022-2023学年沪教版(上海)九年级下册化学
文档属性
| 名称 | 5.1 生活中的酸和碱 同步练习(含答案) 2022-2023学年沪教版(上海)九年级下册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 38.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 15:18:37 | ||
图片预览



文档简介
5.1 生活中的酸和碱 同步练习
一、单选题
1.一些食物的近似pH如下表:
食 物 苹 果 葡 萄 牛 奶 玉米粥
pH 2.9—3.3 3.5—4.5 6.3—6.6 6.8—8.0
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的( )
A.苹果 B.葡萄 C.牛奶 D.玉米粥
2.苹果酸是常用的食品添加剂,苹果酸的化学式是C4H6O5,下列说法正确的是( )
A.苹果酸由C、H、O三种元素组成
B.苹果酸由15个原子构成
C.苹果酸属于氧化物
D.苹果酸中C、O原子个数比为5:4
3.下列叙述不正确的是( )
A.测定人的体液或排泄物的pH能了解人体的健康状况
B.凡生成盐和水的反应就叫中和反应
C.厨房清洁剂具有碱性,卫生间清洁剂具有酸性
D.胃酸过多的病人不能口服氢氧化钠溶液来减轻病痛
4.苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强。下列对苯甲酸性质的推测不合理是( )
A.苯甲酸溶液的pH小于7
B.苯甲酸溶液的pH大于7
C.苯甲酸溶液能使紫色石蕊试液变红色
D.苯甲酸溶液能与氢氧化钠反应
5.正常人的体液pH都在一个相对稳定的范围内,否则人会生病.下列人体体液中,酸性最强的是( )
A.唾液(pH:6.6﹣7.1) B.血浆(pH:7.35﹣7.45)
C.胆汁(pH:7.1﹣7.3) D.胃液(pH:0.9﹣1.5)
6.下列化合物中,属于酸的是
A.NaNO3 B.H2SO4 C.NaOH D.Na2SO4
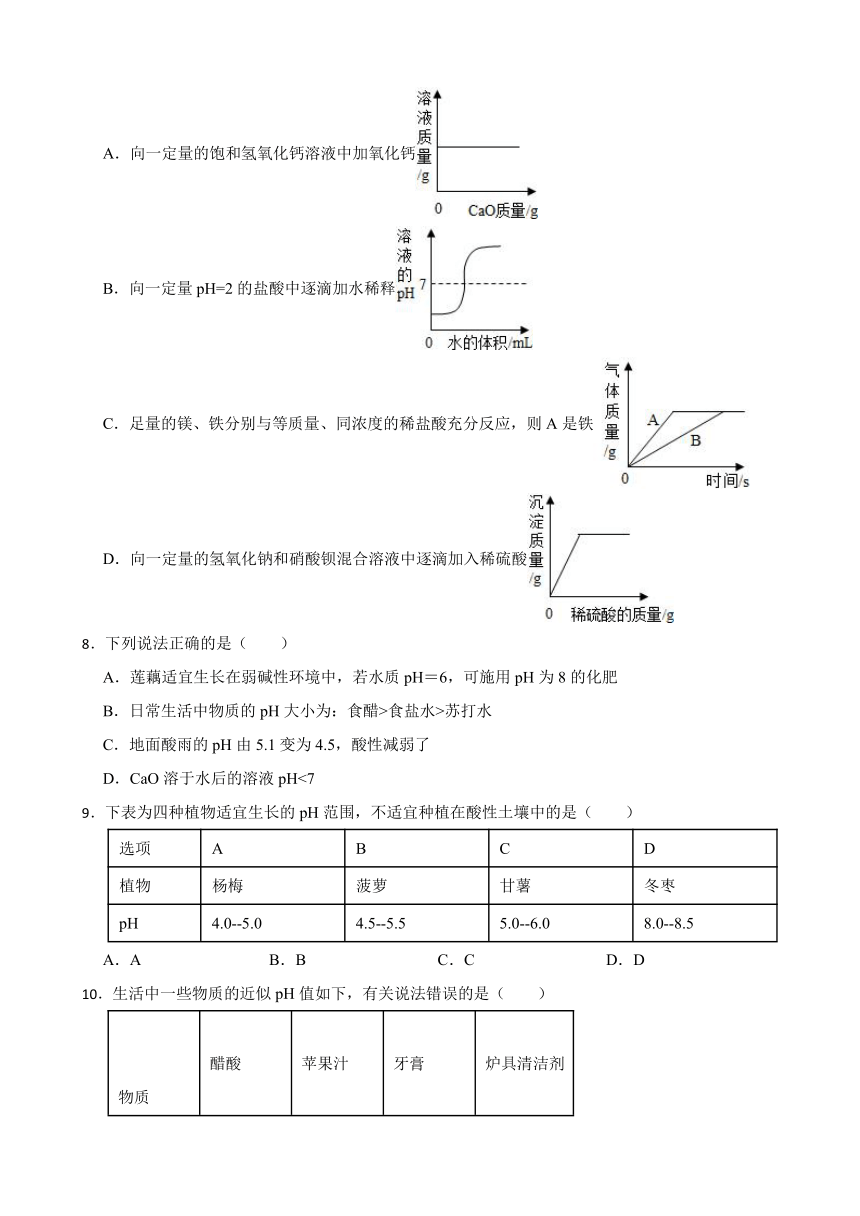
7.下列图像与对应的叙述相符合的是( )
A.向一定量的饱和氢氧化钙溶液中加氧化钙
B.向一定量pH=2的盐酸中逐滴加水稀释
C.足量的镁、铁分别与等质量、同浓度的稀盐酸充分反应,则A是铁
D.向一定量的氢氧化钠和硝酸钡混合溶液中逐滴加入稀硫酸
8.下列说法正确的是( )
A.莲藕适宜生长在弱碱性环境中,若水质pH=6,可施用pH为8的化肥
B.日常生活中物质的pH大小为:食醋>食盐水>苏打水
C.地面酸雨的pH由5.1变为4.5,酸性减弱了
D.CaO溶于水后的溶液pH<7
9.下表为四种植物适宜生长的pH范围,不适宜种植在酸性土壤中的是( )
选项 A B C D
植物 杨梅 菠萝 甘薯 冬枣
pH 4.0--5.0 4.5--5.5 5.0--6.0 8.0--8.5
A.A B.B C.C D.D
10.生活中一些物质的近似pH值如下,有关说法错误的是( )
物质 醋酸 苹果汁 牙膏 炉具清洁剂
pH 2.5 3.1 8.5 12.4
A.胃酸过多的人少吃苹果 B.pH试纸可精确测得以上液体的pH
C.醋酸能使紫色石蕊试液变红 D.炉具清洁剂的碱性比牙膏强
11.常温下,将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
A.4 B.9 C.11 D.14
12.生活中一些常见食物的pH范围如下表:
食物 柠檬汁 鸡蛋清 牛奶 玉米粥
pH 2.0~2.5 7.4~7.6 6.3~8.5 6.8~8.0
上述食物中,胃酸过多的人不宜食用的是( )
A.柠檬汁 B.牛奶 C.鸡蛋 D.玉米粥
二、填空题
13.浓盐酸具有 性气味,还具有 性,还有,所以当打开盛放浓盐酸的试剂瓶盖时,瓶口可以看到 ,盛放浓盐酸的试剂瓶敞口放置一段时间后(不考虑水分蒸发),则溶液的质量 (填”变大”或”变小”),溶质的质量分数 (同上);实验室浓硫酸能用干燥气体,是因为它有 性.
14.溶液的酸碱度常用 来表示,pH=7时溶液呈 性,pH<7时呈 性,pH>7时呈 性.
15.将氢氧化钠溶液慢慢滴入盛有稀盐酸的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入将氢氧化钠溶液的质量变化曲线如图所示:
(1)在滴加的过程中,烧杯中溶液的pH如何变化?C点溶液中的溶质是什么?
(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是吸热反应还是放热反应?
16.经测定,某溶液的pH=1,取少量该溶液滴入紫色石蕊,溶液 ,则该溶液中不可能存在NaNO3、NaOH、Na2SO4中的 。
17.在稀硫酸中存在的自由移动的微粒是 ,它能和氢氧化钠溶液发生中和反应,反应过程中不断减少的微粒是 .
18.久置的苛性钠溶液易发生变质,这是由于它与 发生了反应,反应的化学方程式为 ;如果要检验苛性钠溶液是否变质,可取出少量溶液于试管,向其中滴加足量稀硝酸,若有 产 生,则证明已经变质。此反应的化学方程式 。
三、综合题
19.化学来源于生活,并为生活服务。用化学知识解释下列生活现象。
(1)硬水危害人们健康,生活中软化硬水的方法是 ;
(2)为减少雾霾的吸入,人们出行经常带防雾霾口罩,是利用口罩中填充物活性炭的 性;
(3)厨房调味品中能用来除水垢的物质是 ;
(4)袋装小米中填充氮气保鲜,这是因为 ;
(5)“洁厕灵”和“漂白精”是家庭常用的两种清洁剂。“洁厕灵”的有效成分是盐酸,“漂白精”的主要成分是次氯酸钠(NaClO),次氯酸钠(NaClO)中氯元素化合价为 ,它们不能混用,两者若混合易产生一种有毒气体X,化学方程式为,则X的化学式为 。
20.现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2与加入稀盐酸的数据如图.
(1)当加入 g盐酸时,才开始产生CO2;图中V= mL.
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?(百分数精确到0.1%,质量精确到0.01g)
21.如图表示盐酸与氢氧化钠溶液反应的 pH变化图,
(1)盐酸与氢氧化钠反应的化学方程式
(2)如图表示将 加入 中.
(3) 点表示两种物质恰好完全反应.
(4)c点溶液中的溶质是 ,向该溶液中滴加紫色石蕊,溶液呈 色.
22.请根据我们学过的化学知识填空。(①到⑤填写化学式)
(1)人们常说:“高原缺氧。”这里的氧是指 ;
(2)汽水里含有的酸 ;
(3)人体胃液中帮助消化的一种酸 ;
(4)作为调味剂和防腐剂的盐为 ;
(5)农业上改良酸性土壤的一种碱 ;
(6)写出用稀盐酸除铁锈的化学方程式 ;现象为 。
(7)酸有多种分类方法,如下表格:
一元酸 酸根 二元酸 酸根
HCl Cl H2SO4 SO4
HNO3 NO3 H2CO3 CO3
CH3COOH CH3COO
根据以上分类信息,区分一元酸和二元酸的依据是: 。
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】B
4.【答案】B
5.【答案】D
6.【答案】B
7.【答案】D
8.【答案】A
9.【答案】D
10.【答案】B
11.【答案】B
12.【答案】A
13.【答案】刺激;挥发;白雾;变小;变小;吸水
14.【答案】pH;中;酸;碱
15.【答案】(1)从小于7逐渐变化到大于7,氢氧化钠和氯化钠
(2)放热
16.【答案】变红色;NaOH
17.【答案】H+、SO42﹣、H2O;H+和OH﹣
18.【答案】二氧化碳;;气体;
19.【答案】(1)煮沸
(2)吸附
(3)食醋
(4)氮气的化学性质不活泼,能做保护气
(5)+1;Cl2
20.【答案】(1)5;444
(2)解:①444 mLCO2的质量= ×1.98g/L═0.88克,设产生0.88gCO2时,消耗HCl的质量为X.
NaHCO3+ HCl=NaCl+ CO2↑+H2O
36.5 44
x 0.88g
═
得:x=0.73g
∴盐酸溶液中溶质的质量分数= ×100%=7.3%.
②设加入5g盐酸时,参加反应的碳酸钠的质量为Y,生成碳酸氢钠的质量为Z.
5克盐酸中溶质的质量=5克×7.3%=0.365克.
Na2CO3+ HCl═ NaHCO3+NaCl
106 36.5 84
y 0.365g z
═
解得:Y=1.06克
═
得:Z=0.84克
556mLCO2的质量=556mL÷1000×1.98g/L=1.10克,设放出556mLCO2时反应的NaHCO3质量为m.
NaHCO3+HCl=NaCl+ CO2↑+H2O
84 44
m 1.10g
═
得:M=2.10克
∴原样品中NaHCO3的质量=2.1克﹣0.84克=1.26克.
答:①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g;NaHCO3 1.26g.
21.【答案】(1)HCl+NaOH=NaCl+H2O
(2)盐酸;氢氧化钠
(3)b
(4)NaCl HCl;红
22.【答案】(1)O2
(2)H2CO3
(3)HCl
(4)NaCl
(5)Ca(OH)2
(6)Fe2O3+6HCl = 2FeCl3+3H2O;铁锈逐渐减少,溶液由无色变成黄色
(7)分子中与酸根结合的氢原子个数
一、单选题
1.一些食物的近似pH如下表:
食 物 苹 果 葡 萄 牛 奶 玉米粥
pH 2.9—3.3 3.5—4.5 6.3—6.6 6.8—8.0
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的( )
A.苹果 B.葡萄 C.牛奶 D.玉米粥
2.苹果酸是常用的食品添加剂,苹果酸的化学式是C4H6O5,下列说法正确的是( )
A.苹果酸由C、H、O三种元素组成
B.苹果酸由15个原子构成
C.苹果酸属于氧化物
D.苹果酸中C、O原子个数比为5:4
3.下列叙述不正确的是( )
A.测定人的体液或排泄物的pH能了解人体的健康状况
B.凡生成盐和水的反应就叫中和反应
C.厨房清洁剂具有碱性,卫生间清洁剂具有酸性
D.胃酸过多的病人不能口服氢氧化钠溶液来减轻病痛
4.苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强。下列对苯甲酸性质的推测不合理是( )
A.苯甲酸溶液的pH小于7
B.苯甲酸溶液的pH大于7
C.苯甲酸溶液能使紫色石蕊试液变红色
D.苯甲酸溶液能与氢氧化钠反应
5.正常人的体液pH都在一个相对稳定的范围内,否则人会生病.下列人体体液中,酸性最强的是( )
A.唾液(pH:6.6﹣7.1) B.血浆(pH:7.35﹣7.45)
C.胆汁(pH:7.1﹣7.3) D.胃液(pH:0.9﹣1.5)
6.下列化合物中,属于酸的是
A.NaNO3 B.H2SO4 C.NaOH D.Na2SO4
7.下列图像与对应的叙述相符合的是( )
A.向一定量的饱和氢氧化钙溶液中加氧化钙
B.向一定量pH=2的盐酸中逐滴加水稀释
C.足量的镁、铁分别与等质量、同浓度的稀盐酸充分反应,则A是铁
D.向一定量的氢氧化钠和硝酸钡混合溶液中逐滴加入稀硫酸
8.下列说法正确的是( )
A.莲藕适宜生长在弱碱性环境中,若水质pH=6,可施用pH为8的化肥
B.日常生活中物质的pH大小为:食醋>食盐水>苏打水
C.地面酸雨的pH由5.1变为4.5,酸性减弱了
D.CaO溶于水后的溶液pH<7
9.下表为四种植物适宜生长的pH范围,不适宜种植在酸性土壤中的是( )
选项 A B C D
植物 杨梅 菠萝 甘薯 冬枣
pH 4.0--5.0 4.5--5.5 5.0--6.0 8.0--8.5
A.A B.B C.C D.D
10.生活中一些物质的近似pH值如下,有关说法错误的是( )
物质 醋酸 苹果汁 牙膏 炉具清洁剂
pH 2.5 3.1 8.5 12.4
A.胃酸过多的人少吃苹果 B.pH试纸可精确测得以上液体的pH
C.醋酸能使紫色石蕊试液变红 D.炉具清洁剂的碱性比牙膏强
11.常温下,将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )
A.4 B.9 C.11 D.14
12.生活中一些常见食物的pH范围如下表:
食物 柠檬汁 鸡蛋清 牛奶 玉米粥
pH 2.0~2.5 7.4~7.6 6.3~8.5 6.8~8.0
上述食物中,胃酸过多的人不宜食用的是( )
A.柠檬汁 B.牛奶 C.鸡蛋 D.玉米粥
二、填空题
13.浓盐酸具有 性气味,还具有 性,还有,所以当打开盛放浓盐酸的试剂瓶盖时,瓶口可以看到 ,盛放浓盐酸的试剂瓶敞口放置一段时间后(不考虑水分蒸发),则溶液的质量 (填”变大”或”变小”),溶质的质量分数 (同上);实验室浓硫酸能用干燥气体,是因为它有 性.
14.溶液的酸碱度常用 来表示,pH=7时溶液呈 性,pH<7时呈 性,pH>7时呈 性.
15.将氢氧化钠溶液慢慢滴入盛有稀盐酸的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入将氢氧化钠溶液的质量变化曲线如图所示:
(1)在滴加的过程中,烧杯中溶液的pH如何变化?C点溶液中的溶质是什么?
(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是吸热反应还是放热反应?
16.经测定,某溶液的pH=1,取少量该溶液滴入紫色石蕊,溶液 ,则该溶液中不可能存在NaNO3、NaOH、Na2SO4中的 。
17.在稀硫酸中存在的自由移动的微粒是 ,它能和氢氧化钠溶液发生中和反应,反应过程中不断减少的微粒是 .
18.久置的苛性钠溶液易发生变质,这是由于它与 发生了反应,反应的化学方程式为 ;如果要检验苛性钠溶液是否变质,可取出少量溶液于试管,向其中滴加足量稀硝酸,若有 产 生,则证明已经变质。此反应的化学方程式 。
三、综合题
19.化学来源于生活,并为生活服务。用化学知识解释下列生活现象。
(1)硬水危害人们健康,生活中软化硬水的方法是 ;
(2)为减少雾霾的吸入,人们出行经常带防雾霾口罩,是利用口罩中填充物活性炭的 性;
(3)厨房调味品中能用来除水垢的物质是 ;
(4)袋装小米中填充氮气保鲜,这是因为 ;
(5)“洁厕灵”和“漂白精”是家庭常用的两种清洁剂。“洁厕灵”的有效成分是盐酸,“漂白精”的主要成分是次氯酸钠(NaClO),次氯酸钠(NaClO)中氯元素化合价为 ,它们不能混用,两者若混合易产生一种有毒气体X,化学方程式为,则X的化学式为 。
20.现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O.
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2与加入稀盐酸的数据如图.
(1)当加入 g盐酸时,才开始产生CO2;图中V= mL.
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?(百分数精确到0.1%,质量精确到0.01g)
21.如图表示盐酸与氢氧化钠溶液反应的 pH变化图,
(1)盐酸与氢氧化钠反应的化学方程式
(2)如图表示将 加入 中.
(3) 点表示两种物质恰好完全反应.
(4)c点溶液中的溶质是 ,向该溶液中滴加紫色石蕊,溶液呈 色.
22.请根据我们学过的化学知识填空。(①到⑤填写化学式)
(1)人们常说:“高原缺氧。”这里的氧是指 ;
(2)汽水里含有的酸 ;
(3)人体胃液中帮助消化的一种酸 ;
(4)作为调味剂和防腐剂的盐为 ;
(5)农业上改良酸性土壤的一种碱 ;
(6)写出用稀盐酸除铁锈的化学方程式 ;现象为 。
(7)酸有多种分类方法,如下表格:
一元酸 酸根 二元酸 酸根
HCl Cl H2SO4 SO4
HNO3 NO3 H2CO3 CO3
CH3COOH CH3COO
根据以上分类信息,区分一元酸和二元酸的依据是: 。
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】B
4.【答案】B
5.【答案】D
6.【答案】B
7.【答案】D
8.【答案】A
9.【答案】D
10.【答案】B
11.【答案】B
12.【答案】A
13.【答案】刺激;挥发;白雾;变小;变小;吸水
14.【答案】pH;中;酸;碱
15.【答案】(1)从小于7逐渐变化到大于7,氢氧化钠和氯化钠
(2)放热
16.【答案】变红色;NaOH
17.【答案】H+、SO42﹣、H2O;H+和OH﹣
18.【答案】二氧化碳;;气体;
19.【答案】(1)煮沸
(2)吸附
(3)食醋
(4)氮气的化学性质不活泼,能做保护气
(5)+1;Cl2
20.【答案】(1)5;444
(2)解:①444 mLCO2的质量= ×1.98g/L═0.88克,设产生0.88gCO2时,消耗HCl的质量为X.
NaHCO3+ HCl=NaCl+ CO2↑+H2O
36.5 44
x 0.88g
═
得:x=0.73g
∴盐酸溶液中溶质的质量分数= ×100%=7.3%.
②设加入5g盐酸时,参加反应的碳酸钠的质量为Y,生成碳酸氢钠的质量为Z.
5克盐酸中溶质的质量=5克×7.3%=0.365克.
Na2CO3+ HCl═ NaHCO3+NaCl
106 36.5 84
y 0.365g z
═
解得:Y=1.06克
═
得:Z=0.84克
556mLCO2的质量=556mL÷1000×1.98g/L=1.10克,设放出556mLCO2时反应的NaHCO3质量为m.
NaHCO3+HCl=NaCl+ CO2↑+H2O
84 44
m 1.10g
═
得:M=2.10克
∴原样品中NaHCO3的质量=2.1克﹣0.84克=1.26克.
答:①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g;NaHCO3 1.26g.
21.【答案】(1)HCl+NaOH=NaCl+H2O
(2)盐酸;氢氧化钠
(3)b
(4)NaCl HCl;红
22.【答案】(1)O2
(2)H2CO3
(3)HCl
(4)NaCl
(5)Ca(OH)2
(6)Fe2O3+6HCl = 2FeCl3+3H2O;铁锈逐渐减少,溶液由无色变成黄色
(7)分子中与酸根结合的氢原子个数
