7.1 酸及其性质 同步练习 (含答案) 2022-2023学年鲁教版九年级下册化学
文档属性
| 名称 | 7.1 酸及其性质 同步练习 (含答案) 2022-2023学年鲁教版九年级下册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 69.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 15:56:21 | ||
图片预览


文档简介
7.1 酸及其性质 同步练习
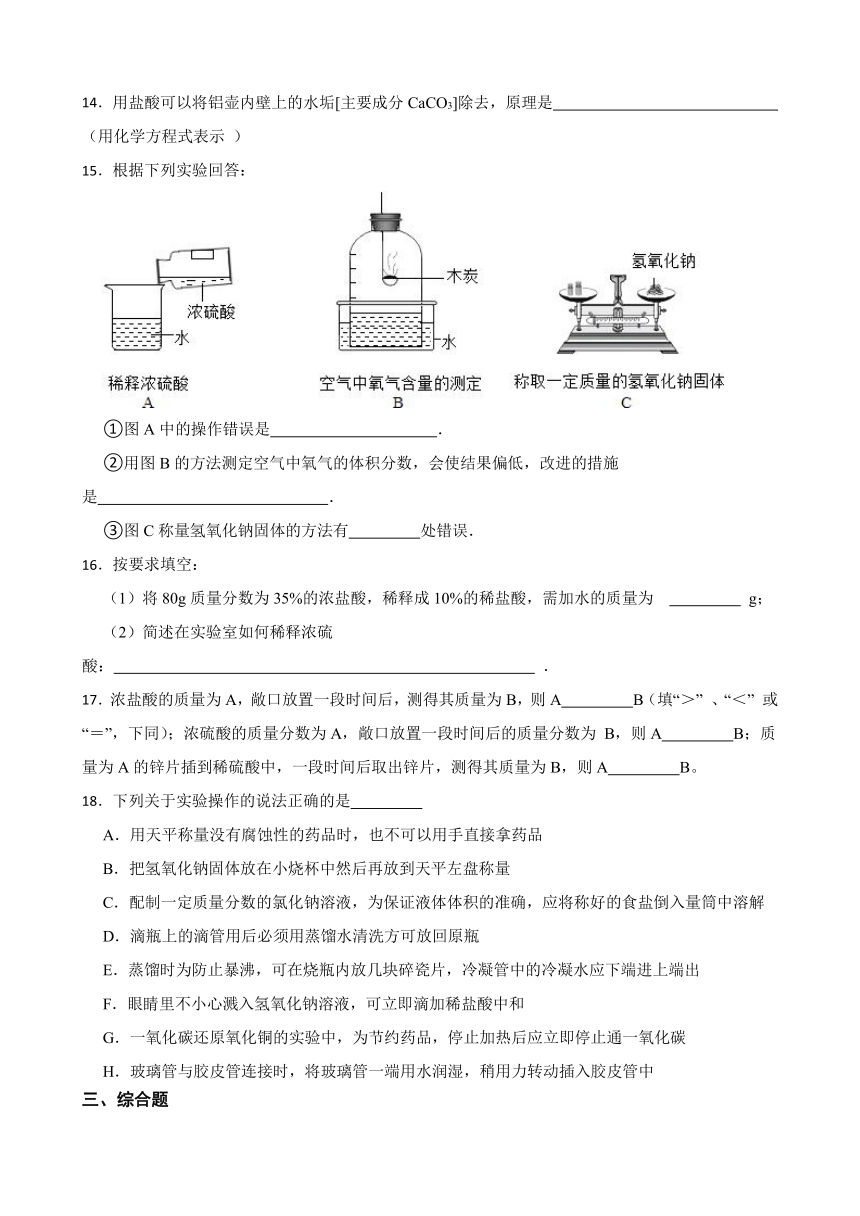
一、单选题
1.向含有一定量H2SO4和CuSO4的混合溶液中逐滴滴加NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示。下列说法不正确是( )
A.0a段发生了中和反应 B.ab段反应产生了蓝色沉淀
C.b点溶液中的溶质是Na2SO4 D.c点溶液呈中性
2.下列物质中不能由金属和稀酸直接反应制得的是( )
A.AlCl3 B.ZnSO4 C.FeCl3 D.MgSO4
3.试管内壁附着的下列物质不能用稀盐酸浸泡而除去的是( )
A.盛石灰水后残留的白色固体
B.用氢气还原氧化铜留下的红色固体
C.探究铁生锈条件后留下的红棕色固体
D.硫酸镁溶液与氢氧化钠溶液反应后留下的白色固体
4.下列化学实验操作中,正确的是 ( )
A.用燃着的酒精灯点燃另一只酒精灯
B.用托盘天平称量药品时,砝码放左盘
C.倾倒液体时,试剂瓶上的标签向着手心
D.给试管中的液体加热时,液体体积最多不超过试管容积的1/2
5.下列物质敞口放置一段时间后,质量增大且无化学变化的是( )
A.浓盐酸 B.浓硫酸 C.烧碱溶液 D.澄清石灰水
6.下列有关盐酸的说法正确的是( )
A.稀盐酸的溶质是一种气体
B.打开浓盐酸瓶塞,可看到大量白烟
C.镁和稀盐酸的反应是一个吸热反应
D.向稀盐酸中逐滴加入氢氧化钠溶液,溶液的pH先增大后减小
7.完成下列变化,不能通过加盐酸一步反应实现的是( )
A.AgNO3→HNO3 B.Ba(OH)2→BaCl2
C.Fe2O3→Fe D.Al→AlCl3
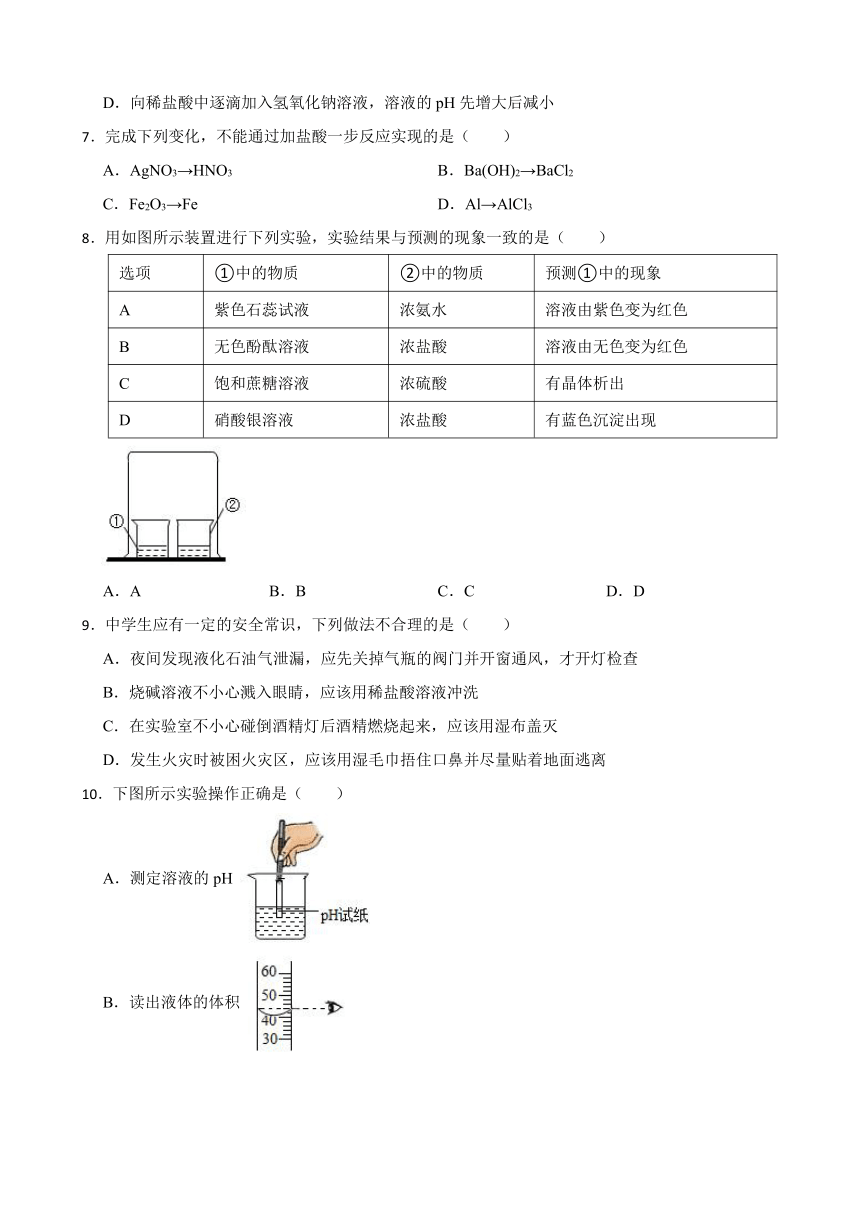
8.用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
选项 ①中的物质 ②中的物质 预测①中的现象
A 紫色石蕊试液 浓氨水 溶液由紫色变为红色
B 无色酚酞溶液 浓盐酸 溶液由无色变为红色
C 饱和蔗糖溶液 浓硫酸 有晶体析出
D 硝酸银溶液 浓盐酸 有蓝色沉淀出现
A.A B.B C.C D.D
9.中学生应有一定的安全常识,下列做法不合理的是( )
A.夜间发现液化石油气泄漏,应先关掉气瓶的阀门并开窗通风,才开灯检查
B.烧碱溶液不小心溅入眼睛,应该用稀盐酸溶液冲洗
C.在实验室不小心碰倒酒精灯后酒精燃烧起来,应该用湿布盖灭
D.发生火灾时被困火灾区,应该用湿毛巾捂住口鼻并尽量贴着地面逃离
10.下图所示实验操作正确是( )
A.测定溶液的pH
B.读出液体的体积
C.稀释浓硫酸
D.移走蒸发皿
11.将浓硫酸和浓盐酸都敞口放置在空气中,一段时间后,它们发生的相同变化是( )
A.溶质的质量都变小. B.溶液的质量都变大
C.溶质的质量分数都变小 D.溶剂的质量都变大
12.下列说法正确的是( )
A.分别敞口放置的浓盐酸和浓硫酸,其溶质质量分数都会逐渐减小
B.变瘪的乒乓球放在热水中鼓起来,是由于分子的体积变大
C.铁丝在空气中燃烧,火星四射,生成黑色固体
D.为保持腊肠肉质鲜美,添加过量亚硝酸钠
二、填空题
13.同学们在探究物质的性质时,进行了如下实验:
编号 实验内容与操作 实验现象 分析与结论
(i) 分别向盛有NaOH溶液、KOH溶液的A,B两试管中加入CuSO4溶液 两支试管均有 沉淀生成 不同的碱溶液都含有 (填化学符号)所以不同的碱都有相似的化学性质
(ii) 用玻璃棒分别蘸取稀 和浓 于白纸A,B上,片刻. 白纸A没明显现象;白纸B变黑(生成了炭) 同种酸,由于 不同,它们性质不完全相同
(iii)另一个同学利用铜丝、硫酸铝溶液、硝酸银溶液等三种药品以及试管,完成了一个探究实验.请将相应内容填在下表中.
实验内容与操作 实验现象 结论
14.用盐酸可以将铝壶内壁上的水垢[主要成分CaCO3]除去,原理是 (用化学方程式表示 )
15.根据下列实验回答:
①图A中的操作错误是 .
②用图B的方法测定空气中氧气的体积分数,会使结果偏低,改进的措施是 .
③图C称量氢氧化钠固体的方法有 处错误.
16.按要求填空:
(1)将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为 g;
(2)简述在实验室如何稀释浓硫酸: .
17.浓盐酸的质量为A,敞口放置一段时间后,测得其质量为B,则A B(填“>” 、“<” 或“=”,下同);浓硫酸的质量分数为A,敞口放置一段时间后的质量分数为 B,则A B;质量为A的锌片插到稀硫酸中,一段时间后取出锌片,测得其质量为B,则A B。
18.下列关于实验操作的说法正确的是
A.用天平称量没有腐蚀性的药品时,也不可以用手直接拿药品
B.把氢氧化钠固体放在小烧杯中然后再放到天平左盘称量
C.配制一定质量分数的氯化钠溶液,为保证液体体积的准确,应将称好的食盐倒入量筒中溶解
D.滴瓶上的滴管用后必须用蒸馏水清洗方可放回原瓶
E.蒸馏时为防止暴沸,可在烧瓶内放几块碎瓷片,冷凝管中的冷凝水应下端进上端出
F.眼睛里不小心溅入氢氧化钠溶液,可立即滴加稀盐酸中和
G.一氧化碳还原氧化铜的实验中,为节约药品,停止加热后应立即停止通一氧化碳
H.玻璃管与胶皮管连接时,将玻璃管一端用水润湿,稍用力转动插入胶皮管中
三、综合题
19.仔细阅读下列材料,回答问题。
山西老陈醋历史渊源、驰名中外,素有“天下第一醋”的盛誉。食醋含醋酸(CH3COOH)3%-5%,还含有少量如乳酸、葡萄糖酸、琥珀酸、氨基酸、维生素
B、钙盐、亚铁盐等营养成分。乙酸是一种重要的有机酸,俗称醋酸。乙酸在常温下是一种有强烈刺激性气味的无色液体,易溶于水和乙醇,熔点为16.5℃,沸点为118.1℃。水溶液呈酸性,能与醇类物质发生酯化反应。
炒莱时放点食醋能软化植物纤维素,改善食物的色、香、味,并有利于保护食物中的维生素C(维生素C在酸性条件下稳定),能溶解骨质,促进人体对钙、磷的吸收。
将精制短棉花干燥后,与醋酸等物质混合,再在催化剂硫酸的作用下,经一系列杂的化学、物理变化可制得醋酸纤维素。醋酸纤维素用于纺丝、制药品的肠溶衣、醋纤维塑料、醋酸纤维素过滤膜等。根据材料回答下列问题
(1)山西老陈醋属于 (填“混合物”或“纯净物”);写出食醋中含有的一种离子 (填离子符号)。
(2)写出乙酸的一条物理性质
(3)制取醋酸纤维素过程中硫酸的作用是
(4)食醋在生活中还有很多妙用,下列使用食醋能达到目的的是________
A.除去菜刀表面的铁锈
B.炖排骨时,放点食醋可促进人体对钙、磷的吸收
C.清洗溅到皮肤上的炉具清洁剂
D.除去水壶内壁上的水垢
20.从化学的视角认识生活中的有关问题:
(1)下列食物中,能为人体提供大量维生素的是 (填序号);
A.青菜 B.牛肉 C.大米 D.植物油
(2)硬水有很多危害,实验室中常用 来区分硬水和软水;
(3)铁制品易生锈,常用稀盐酸来除锈,将生锈铁钉放入稀盐酸中,开始时观察到的实验现象是 .
21.据报道:一家政服务人员在清洗抽水马桶时,同时倒入了“84消毒液”和洁厕剂,结果被两者反应产生的有毒气体熏倒在地。
(1)“84消毒液”的主要成分是次氯酸钠(NaClO),其中Cl的化合价为 。次氯酸钠(NaClO)与盐酸混合后,会生成氯化钠、水及有毒的氯气。请你写出此反应的化学方程式: 。
(2)目前市场上的洁厕剂大多为酸性,含有一定量的稀酸(如稀盐酸、稀磷酸等),具有腐蚀性。下列物体中,表面可用这类洁厕剂清洗的是____。
A.大理石台面(主要成分是CaCO3)
B.釉面砖(釉面的主要成分是SiO2)
C.不锈钢管
(3)洁厕剂中的稀盐酸可用来除锈,白醋、柠檬酸溶液也能发生类似的反应,因为白醋、柠檬酸溶液、盐酸中都含有 (填离子符号)离子。
22.用合适的化学用语填空。
(1)2个氯分子 ;氦气 ;铵根离子 。
(2)烧水的铝壶中常结有一层水垢(水垢的主要成分之一是CaCO3),用适量的稀盐酸可以将它除去,反应的化学方程式是 ,
若盐酸的用量过多,会损坏铝壶,可以用化学方程式解释为 ;
用氢氧化钠溶液来吸收有毒的二氧化硫气体 。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】B
4.【答案】C
5.【答案】B
6.【答案】A
7.【答案】C
8.【答案】C
9.【答案】B
10.【答案】C
11.【答案】C
12.【答案】A
13.【答案】蓝色;OH﹣;硫酸;硫酸;浓度;分别将铜丝浸入盛有硝酸银、硫酸铝溶液的A、B两试管中;试管A中的铜丝表面有银白色物质生成,溶液逐渐变蓝色,试管B无明显现象;金属活动性顺序:Al>Cu>Ag
14.【答案】
15.【答案】没有用玻璃棒搅拌;将木炭换成红磷(或白磷);2
16.【答案】200;将浓硫酸沿烧杯壁缓慢地注入水中,用玻璃棒不断搅动
17.【答案】>;>;>
18.【答案】ABEH
19.【答案】(1)混合物;H + (或 CH 3 COO - 或 Ca 2+ 或 Fe 2+ 等,合理即可)
(2)刺激性气味(合理即可)
(3)催化作用
(4)A;B;C;D
20.【答案】(1)A
(2)肥皂水
(3)铁锈溶解,溶液由无色变成了黄色
21.【答案】(1)+1;
(2)B
(3)H+
22.【答案】(1)2Cl2;He;NH4+
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;2Al + 6HCl = 2AlCl3 + 3H2↑;2NaOH + SO2 = Na2SO3 + H2O
一、单选题
1.向含有一定量H2SO4和CuSO4的混合溶液中逐滴滴加NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示。下列说法不正确是( )
A.0a段发生了中和反应 B.ab段反应产生了蓝色沉淀
C.b点溶液中的溶质是Na2SO4 D.c点溶液呈中性
2.下列物质中不能由金属和稀酸直接反应制得的是( )
A.AlCl3 B.ZnSO4 C.FeCl3 D.MgSO4
3.试管内壁附着的下列物质不能用稀盐酸浸泡而除去的是( )
A.盛石灰水后残留的白色固体
B.用氢气还原氧化铜留下的红色固体
C.探究铁生锈条件后留下的红棕色固体
D.硫酸镁溶液与氢氧化钠溶液反应后留下的白色固体
4.下列化学实验操作中,正确的是 ( )
A.用燃着的酒精灯点燃另一只酒精灯
B.用托盘天平称量药品时,砝码放左盘
C.倾倒液体时,试剂瓶上的标签向着手心
D.给试管中的液体加热时,液体体积最多不超过试管容积的1/2
5.下列物质敞口放置一段时间后,质量增大且无化学变化的是( )
A.浓盐酸 B.浓硫酸 C.烧碱溶液 D.澄清石灰水
6.下列有关盐酸的说法正确的是( )
A.稀盐酸的溶质是一种气体
B.打开浓盐酸瓶塞,可看到大量白烟
C.镁和稀盐酸的反应是一个吸热反应
D.向稀盐酸中逐滴加入氢氧化钠溶液,溶液的pH先增大后减小
7.完成下列变化,不能通过加盐酸一步反应实现的是( )
A.AgNO3→HNO3 B.Ba(OH)2→BaCl2
C.Fe2O3→Fe D.Al→AlCl3
8.用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
选项 ①中的物质 ②中的物质 预测①中的现象
A 紫色石蕊试液 浓氨水 溶液由紫色变为红色
B 无色酚酞溶液 浓盐酸 溶液由无色变为红色
C 饱和蔗糖溶液 浓硫酸 有晶体析出
D 硝酸银溶液 浓盐酸 有蓝色沉淀出现
A.A B.B C.C D.D
9.中学生应有一定的安全常识,下列做法不合理的是( )
A.夜间发现液化石油气泄漏,应先关掉气瓶的阀门并开窗通风,才开灯检查
B.烧碱溶液不小心溅入眼睛,应该用稀盐酸溶液冲洗
C.在实验室不小心碰倒酒精灯后酒精燃烧起来,应该用湿布盖灭
D.发生火灾时被困火灾区,应该用湿毛巾捂住口鼻并尽量贴着地面逃离
10.下图所示实验操作正确是( )
A.测定溶液的pH
B.读出液体的体积
C.稀释浓硫酸
D.移走蒸发皿
11.将浓硫酸和浓盐酸都敞口放置在空气中,一段时间后,它们发生的相同变化是( )
A.溶质的质量都变小. B.溶液的质量都变大
C.溶质的质量分数都变小 D.溶剂的质量都变大
12.下列说法正确的是( )
A.分别敞口放置的浓盐酸和浓硫酸,其溶质质量分数都会逐渐减小
B.变瘪的乒乓球放在热水中鼓起来,是由于分子的体积变大
C.铁丝在空气中燃烧,火星四射,生成黑色固体
D.为保持腊肠肉质鲜美,添加过量亚硝酸钠
二、填空题
13.同学们在探究物质的性质时,进行了如下实验:
编号 实验内容与操作 实验现象 分析与结论
(i) 分别向盛有NaOH溶液、KOH溶液的A,B两试管中加入CuSO4溶液 两支试管均有 沉淀生成 不同的碱溶液都含有 (填化学符号)所以不同的碱都有相似的化学性质
(ii) 用玻璃棒分别蘸取稀 和浓 于白纸A,B上,片刻. 白纸A没明显现象;白纸B变黑(生成了炭) 同种酸,由于 不同,它们性质不完全相同
(iii)另一个同学利用铜丝、硫酸铝溶液、硝酸银溶液等三种药品以及试管,完成了一个探究实验.请将相应内容填在下表中.
实验内容与操作 实验现象 结论
14.用盐酸可以将铝壶内壁上的水垢[主要成分CaCO3]除去,原理是 (用化学方程式表示 )
15.根据下列实验回答:
①图A中的操作错误是 .
②用图B的方法测定空气中氧气的体积分数,会使结果偏低,改进的措施是 .
③图C称量氢氧化钠固体的方法有 处错误.
16.按要求填空:
(1)将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为 g;
(2)简述在实验室如何稀释浓硫酸: .
17.浓盐酸的质量为A,敞口放置一段时间后,测得其质量为B,则A B(填“>” 、“<” 或“=”,下同);浓硫酸的质量分数为A,敞口放置一段时间后的质量分数为 B,则A B;质量为A的锌片插到稀硫酸中,一段时间后取出锌片,测得其质量为B,则A B。
18.下列关于实验操作的说法正确的是
A.用天平称量没有腐蚀性的药品时,也不可以用手直接拿药品
B.把氢氧化钠固体放在小烧杯中然后再放到天平左盘称量
C.配制一定质量分数的氯化钠溶液,为保证液体体积的准确,应将称好的食盐倒入量筒中溶解
D.滴瓶上的滴管用后必须用蒸馏水清洗方可放回原瓶
E.蒸馏时为防止暴沸,可在烧瓶内放几块碎瓷片,冷凝管中的冷凝水应下端进上端出
F.眼睛里不小心溅入氢氧化钠溶液,可立即滴加稀盐酸中和
G.一氧化碳还原氧化铜的实验中,为节约药品,停止加热后应立即停止通一氧化碳
H.玻璃管与胶皮管连接时,将玻璃管一端用水润湿,稍用力转动插入胶皮管中
三、综合题
19.仔细阅读下列材料,回答问题。
山西老陈醋历史渊源、驰名中外,素有“天下第一醋”的盛誉。食醋含醋酸(CH3COOH)3%-5%,还含有少量如乳酸、葡萄糖酸、琥珀酸、氨基酸、维生素
B、钙盐、亚铁盐等营养成分。乙酸是一种重要的有机酸,俗称醋酸。乙酸在常温下是一种有强烈刺激性气味的无色液体,易溶于水和乙醇,熔点为16.5℃,沸点为118.1℃。水溶液呈酸性,能与醇类物质发生酯化反应。
炒莱时放点食醋能软化植物纤维素,改善食物的色、香、味,并有利于保护食物中的维生素C(维生素C在酸性条件下稳定),能溶解骨质,促进人体对钙、磷的吸收。
将精制短棉花干燥后,与醋酸等物质混合,再在催化剂硫酸的作用下,经一系列杂的化学、物理变化可制得醋酸纤维素。醋酸纤维素用于纺丝、制药品的肠溶衣、醋纤维塑料、醋酸纤维素过滤膜等。根据材料回答下列问题
(1)山西老陈醋属于 (填“混合物”或“纯净物”);写出食醋中含有的一种离子 (填离子符号)。
(2)写出乙酸的一条物理性质
(3)制取醋酸纤维素过程中硫酸的作用是
(4)食醋在生活中还有很多妙用,下列使用食醋能达到目的的是________
A.除去菜刀表面的铁锈
B.炖排骨时,放点食醋可促进人体对钙、磷的吸收
C.清洗溅到皮肤上的炉具清洁剂
D.除去水壶内壁上的水垢
20.从化学的视角认识生活中的有关问题:
(1)下列食物中,能为人体提供大量维生素的是 (填序号);
A.青菜 B.牛肉 C.大米 D.植物油
(2)硬水有很多危害,实验室中常用 来区分硬水和软水;
(3)铁制品易生锈,常用稀盐酸来除锈,将生锈铁钉放入稀盐酸中,开始时观察到的实验现象是 .
21.据报道:一家政服务人员在清洗抽水马桶时,同时倒入了“84消毒液”和洁厕剂,结果被两者反应产生的有毒气体熏倒在地。
(1)“84消毒液”的主要成分是次氯酸钠(NaClO),其中Cl的化合价为 。次氯酸钠(NaClO)与盐酸混合后,会生成氯化钠、水及有毒的氯气。请你写出此反应的化学方程式: 。
(2)目前市场上的洁厕剂大多为酸性,含有一定量的稀酸(如稀盐酸、稀磷酸等),具有腐蚀性。下列物体中,表面可用这类洁厕剂清洗的是____。
A.大理石台面(主要成分是CaCO3)
B.釉面砖(釉面的主要成分是SiO2)
C.不锈钢管
(3)洁厕剂中的稀盐酸可用来除锈,白醋、柠檬酸溶液也能发生类似的反应,因为白醋、柠檬酸溶液、盐酸中都含有 (填离子符号)离子。
22.用合适的化学用语填空。
(1)2个氯分子 ;氦气 ;铵根离子 。
(2)烧水的铝壶中常结有一层水垢(水垢的主要成分之一是CaCO3),用适量的稀盐酸可以将它除去,反应的化学方程式是 ,
若盐酸的用量过多,会损坏铝壶,可以用化学方程式解释为 ;
用氢氧化钠溶液来吸收有毒的二氧化硫气体 。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】B
4.【答案】C
5.【答案】B
6.【答案】A
7.【答案】C
8.【答案】C
9.【答案】B
10.【答案】C
11.【答案】C
12.【答案】A
13.【答案】蓝色;OH﹣;硫酸;硫酸;浓度;分别将铜丝浸入盛有硝酸银、硫酸铝溶液的A、B两试管中;试管A中的铜丝表面有银白色物质生成,溶液逐渐变蓝色,试管B无明显现象;金属活动性顺序:Al>Cu>Ag
14.【答案】
15.【答案】没有用玻璃棒搅拌;将木炭换成红磷(或白磷);2
16.【答案】200;将浓硫酸沿烧杯壁缓慢地注入水中,用玻璃棒不断搅动
17.【答案】>;>;>
18.【答案】ABEH
19.【答案】(1)混合物;H + (或 CH 3 COO - 或 Ca 2+ 或 Fe 2+ 等,合理即可)
(2)刺激性气味(合理即可)
(3)催化作用
(4)A;B;C;D
20.【答案】(1)A
(2)肥皂水
(3)铁锈溶解,溶液由无色变成了黄色
21.【答案】(1)+1;
(2)B
(3)H+
22.【答案】(1)2Cl2;He;NH4+
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;2Al + 6HCl = 2AlCl3 + 3H2↑;2NaOH + SO2 = Na2SO3 + H2O
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
