9.2 金属的化学性质 同步练习(含答案) 2022-2023学年鲁教版九年级下册化学
文档属性
| 名称 | 9.2 金属的化学性质 同步练习(含答案) 2022-2023学年鲁教版九年级下册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 174.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 18:19:45 | ||
图片预览


文档简介
9.2 金属的化学性质 同步练习
一、单选题
1.下列反应不属于置换反应的是( )
A.CH4+2O2 CO2+2H2O B.C+2CuO 2Cu+CO2↑
C.Zn+Cu(NO3)2═Zn(NO3)2+Cu D.C+H2O H2+CO
2.关于化学反应A+B=C+D,下列说法中正确的是()
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
B.若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C.若A是可溶性碱,B是可溶性盐,则C和D可能是两种沉淀
D.若A、B各取10g混合,使其充分反应,则C,D质量的总和一定等于20g
3.向Mg(NO3)2和Cu(NO3)2的混合溶液中加入过量的Zn粉,充分反应后过滤,滤纸上的物质为( )
A.Cu B.Mg 、Cu
C.Zn、Cu D.Mg、Zn、Cu
4.科学兴趣小组对金属R的活动性探究时发现:将R放入稀硫酸中,有气泡产生,同时生成正二价的盐:将R放入ZnSO4溶液中无任何变化。根据以上信息,下列化学方程式正确的是( )
A.R+MgCl2=RCl2+Mg B.R +2AgCl=RCl2+2Ag
C.R+2HCl=RCl2+H2↑ D.Al+RSO4=AlSO4+ R
5.下列图像能正确反映对应变化关系的是( )
A. 加热一定量的高锰酸钾制氧气
B. 表示将稀盐酸滴入氢氧化钠溶液中,在M点时,溶液中的溶质只有氯化钠
C. 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D. 在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
6.下列描述与事实相符合的是( )
A.细铁丝伸入盛有氧气的集气瓶中剧烈燃烧
B.电解水实验,电源正极产生的气体燃烧时会发出淡蓝色火焰
C.镁带在空气中燃烧,发出耀眼的白光,生成白色固体
D.铜丝插入硫酸铝溶液中,溶液由无色变为蓝色
7.金属活动性顺序在工农业生产和科学研究中有重要作用。下列金属中活动性最强的是( )
A.镁(Mg) B.铝(Al) C.铁(Fe) D.铜(Cu)
8.现有Cu、Zn、Ag三种金属,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是( )
A.AgNO3溶液 B.稀H2SO4 C.CuSO4溶液 D.ZnCl2溶液
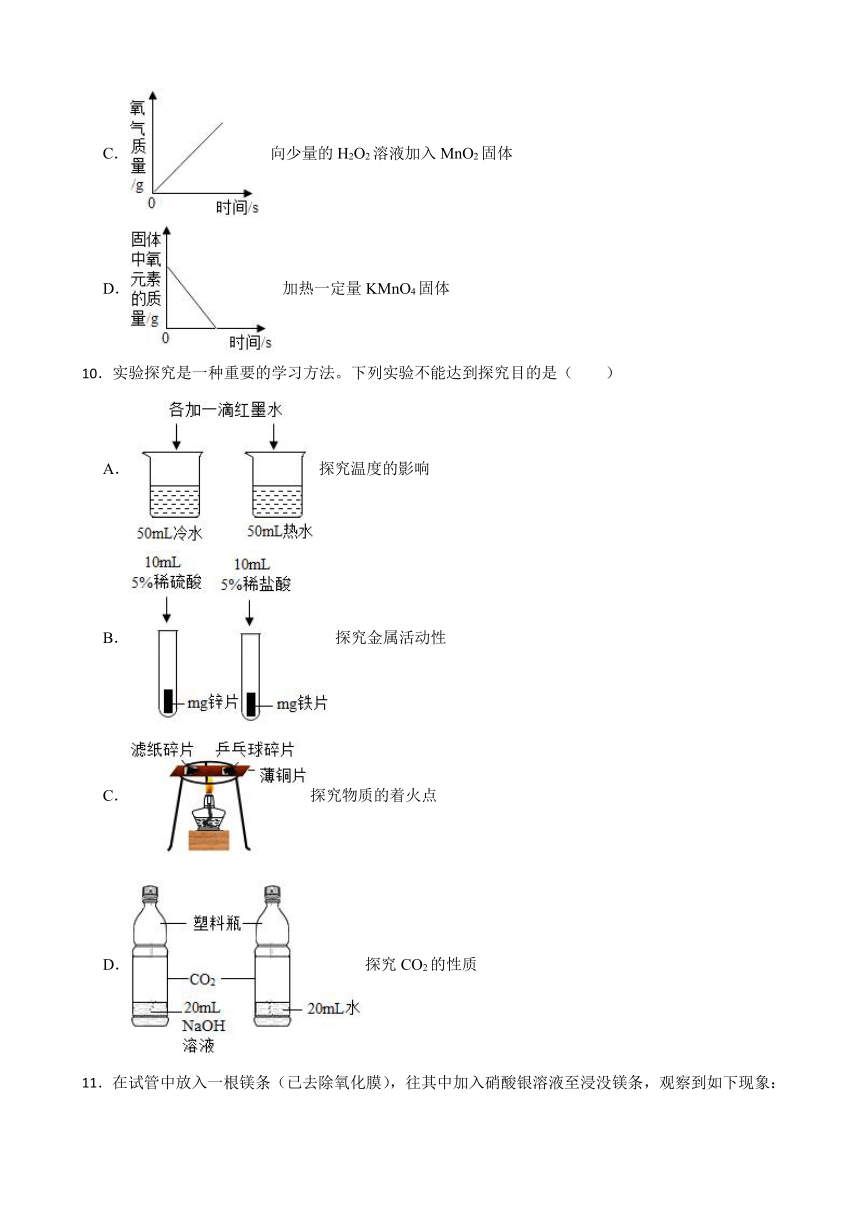
9.如图所示的四个图像,能正确反映对应变化关系的是( )
A. 水的电解
B. 将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中
C. 向少量的H2O2溶液加入MnO2固体
D. 加热一定量KMnO4固体
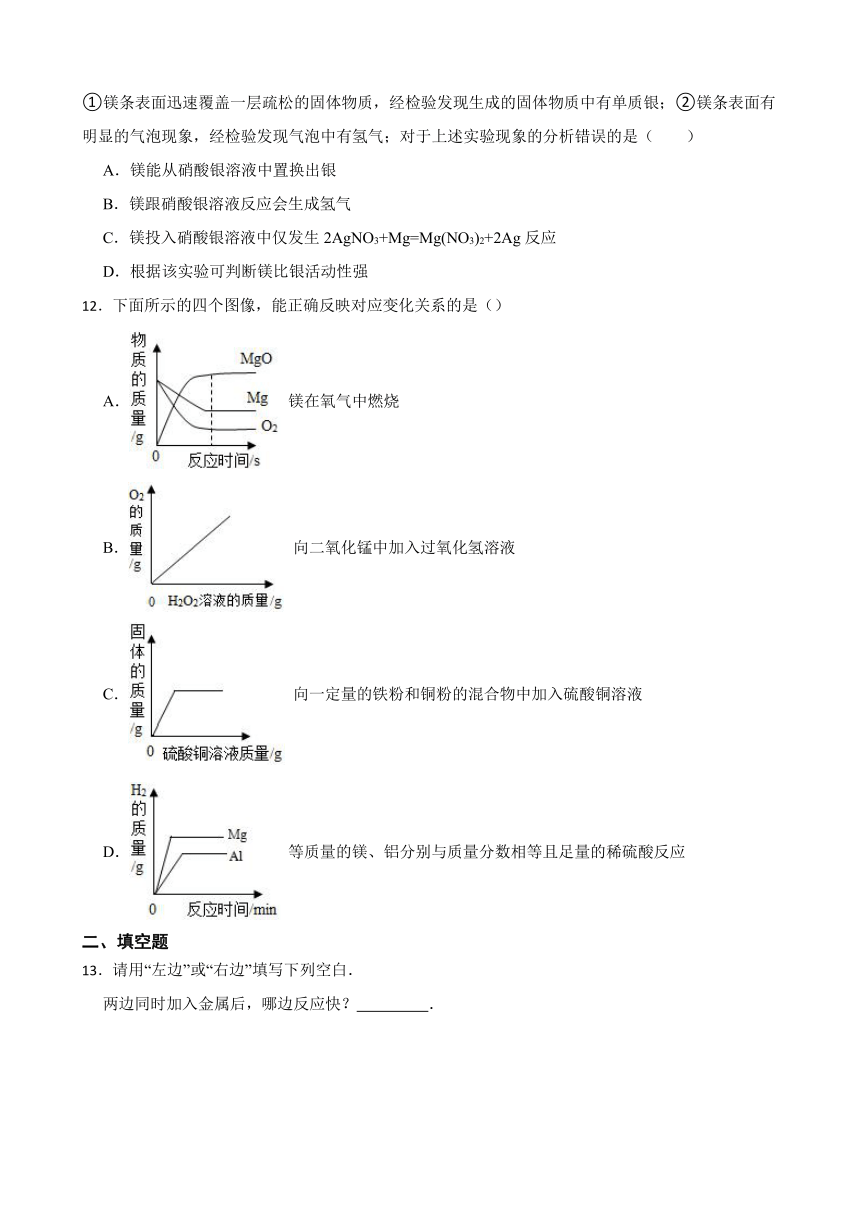
10.实验探究是一种重要的学习方法。下列实验不能达到探究目的是( )
A.探究温度的影响
B.探究金属活动性
C.探究物质的着火点
D.探究CO2的性质
11.在试管中放入一根镁条(已去除氧化膜),往其中加入硝酸银溶液至浸没镁条,观察到如下现象:①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中有单质银;②镁条表面有明显的气泡现象,经检验发现气泡中有氢气;对于上述实验现象的分析错误的是( )
A.镁能从硝酸银溶液中置换出银
B.镁跟硝酸银溶液反应会生成氢气
C.镁投入硝酸银溶液中仅发生2AgNO3+Mg=Mg(NO3)2+2Ag反应
D.根据该实验可判断镁比银活动性强
12.下面所示的四个图像,能正确反映对应变化关系的是()
A. 镁在氧气中燃烧
B. 向二氧化锰中加入过氧化氢溶液
C. 向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D. 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
二、填空题
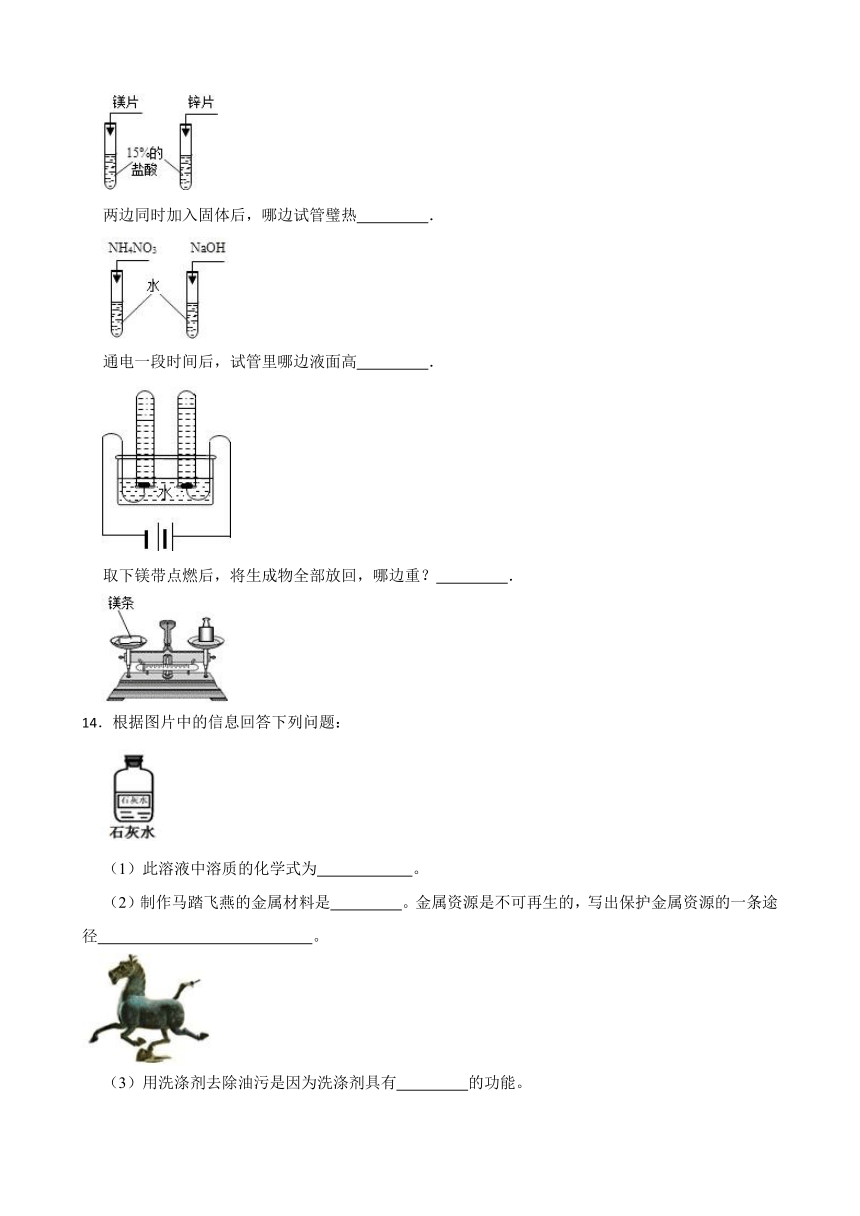
13.请用“左边”或“右边”填写下列空白.
两边同时加入金属后,哪边反应快? .
两边同时加入固体后,哪边试管璧热 .
通电一段时间后,试管里哪边液面高 .
取下镁带点燃后,将生成物全部放回,哪边重? .
14.根据图片中的信息回答下列问题:
(1)此溶液中溶质的化学式为 。
(2)制作马踏飞燕的金属材料是 。金属资源是不可再生的,写出保护金属资源的一条途径 。
(3)用洗涤剂去除油污是因为洗涤剂具有 的功能。
(4)打开汽水瓶盖时,汽水会自动喷出来的原因:汽水中溶有CO2,打开瓶盖, , ,气体逸出,所以汽水自动喷出。
15.工厂师傅在切割钢板时,常用硫酸铜溶液画线,是因为 (用化学方程式表示)。
16.NaOH、CuCl2、HCl、CO2、Fe五种物质间能发生的反应共有 个,任写一个发生反应的化学方程式 。
17.铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
(1)按人类开始使用这三种金属的先后排序为 (用元素符号表示).
(2)在空气中 制品(填“铝”或“铁”)更耐腐蚀.
(3)用下列试剂验证这三种金属的活动性顺序,能达到目的是 (填序号).
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
(4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度 (填“大”或“小”).
18.用实验验证铁、铜、银三种金属的活动性顺序,请写出两种可行方案所需的物质.
方案1: ;方案2: .
三、综合题
19.金属材料对于促进生产发展,改善人类生活发挥了重大作用,因此学习金属性质,根据性质合理使用金属就显得十分重要。请按要求回答下列有关金属性质的问题:
(1)铝具有很好的抗腐蚀性能原因是 。
(2)向含有硝酸铜、硝酸银和硝酸锌的混合溶液中,加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣。滤液中一定含有的溶质是 ,滤渣中一定含有的物质是 。
20.金属材料在生活、生产中有广泛的应用。请回答下列问题:
(1)生活中用铁锅炒菜,主要利用了铁的 性。
(2)工业上用赤铁矿(主要成分为氧化铁)炼铁,其反应原理是 (用化学方程式表示)。
(3)2020年6月21日,时速600公里的高速磁悬浮试验样车成功试跑,制造样车外壳的主要材料是铝合金。铝合金与纯铝相比具有的优点是 (写出一点即可)。
(4)金属资源有限,不能再生。写出防止铁生锈的一种方法 。
21.金属材料在生产和生活中应用广泛。
(1)骑自行车出行,是“低碳”生活的一种方式。
①如图标出的构件中由金属材料制成的是 (填图中的字母)。
②自行车车圈的主要材料是铁合金。请写出工业用赤铁矿炼铁的化学方程式 。
(2)中国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有 的优越性能(答一条)。
(3)某化学小组同学在实验室进行了两个有关金属性质的实验:
实验I:硫酸铝溶液和铁粉混合
实验Ⅱ:硫酸铜溶液与铁粉混合
在上述两个实验结束后,该同学将实验I和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多,原因是 (用文字说明)。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。则所得滤液中溶质一定含有 。
22.氯化铁溶液能腐蚀铜,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程。请回答下列问题:
(1)根据图示,可以推测出步骤①中铜和FeCl3反应的化学方程式是 。
(2)步骤②中发生了两个反应:2FeCl3+Fe=3FeCl2和 。
(3)滤渣的成分有 。
(4)步骤②③所得的滤液中的溶质可与一种气体单质发生化合反应转化为FeCl3,从而实现循环使用。该气体单质是 。
答案解析部分
1.【答案】A
2.【答案】C
3.【答案】C
4.【答案】C
5.【答案】C
6.【答案】C
7.【答案】A
8.【答案】C
9.【答案】B
10.【答案】B
11.【答案】C
12.【答案】B
13.【答案】左边;右边;右边;左边
14.【答案】(1)
(2)青铜;在金属制品表面涂上油漆
(3)乳化
(4)瓶内气压减小; 的溶解度变小
15.【答案】Fe+CuSO4═FeSO4+Cu
16.【答案】5;CuCl2+Fe= FeCl2+Cu(合理即可)
17.【答案】Cu、Fe、Al;铝;B;大
18.【答案】Cu,FeSO4溶液,AgNO3溶液;CuSO4溶液,Fe,Ag
19.【答案】(1)表面有一层致密的氧化膜
(2)硝酸锌、硝酸亚铁或Zn(NO3)2、Fe(NO3)2;银或Ag
20.【答案】(1)导热
(2)
(3)硬度大等合理答案
(4)涂油(或喷漆;或镀上一层耐腐蚀的金属等合理答案)
21.【答案】(1)bde;
(2)硬度大(或强度高、韧性好等合理答案)
(3)实验Ⅰ中未发生反应的铁粉与实验Ⅱ中过量的硫酸铜溶液继续反应生成铜(合理即可);硫酸铝、硫酸亚铁
22.【答案】(1)2FeCl3+Cu=2FeCl2+CuCl2
(2)Fe+CuCl2=FeCl2+Cu
(3)铁、铜
(4)Cl2或氯气
一、单选题
1.下列反应不属于置换反应的是( )
A.CH4+2O2 CO2+2H2O B.C+2CuO 2Cu+CO2↑
C.Zn+Cu(NO3)2═Zn(NO3)2+Cu D.C+H2O H2+CO
2.关于化学反应A+B=C+D,下列说法中正确的是()
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
B.若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C.若A是可溶性碱,B是可溶性盐,则C和D可能是两种沉淀
D.若A、B各取10g混合,使其充分反应,则C,D质量的总和一定等于20g
3.向Mg(NO3)2和Cu(NO3)2的混合溶液中加入过量的Zn粉,充分反应后过滤,滤纸上的物质为( )
A.Cu B.Mg 、Cu
C.Zn、Cu D.Mg、Zn、Cu
4.科学兴趣小组对金属R的活动性探究时发现:将R放入稀硫酸中,有气泡产生,同时生成正二价的盐:将R放入ZnSO4溶液中无任何变化。根据以上信息,下列化学方程式正确的是( )
A.R+MgCl2=RCl2+Mg B.R +2AgCl=RCl2+2Ag
C.R+2HCl=RCl2+H2↑ D.Al+RSO4=AlSO4+ R
5.下列图像能正确反映对应变化关系的是( )
A. 加热一定量的高锰酸钾制氧气
B. 表示将稀盐酸滴入氢氧化钠溶液中,在M点时,溶液中的溶质只有氯化钠
C. 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D. 在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
6.下列描述与事实相符合的是( )
A.细铁丝伸入盛有氧气的集气瓶中剧烈燃烧
B.电解水实验,电源正极产生的气体燃烧时会发出淡蓝色火焰
C.镁带在空气中燃烧,发出耀眼的白光,生成白色固体
D.铜丝插入硫酸铝溶液中,溶液由无色变为蓝色
7.金属活动性顺序在工农业生产和科学研究中有重要作用。下列金属中活动性最强的是( )
A.镁(Mg) B.铝(Al) C.铁(Fe) D.铜(Cu)
8.现有Cu、Zn、Ag三种金属,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是( )
A.AgNO3溶液 B.稀H2SO4 C.CuSO4溶液 D.ZnCl2溶液
9.如图所示的四个图像,能正确反映对应变化关系的是( )
A. 水的电解
B. 将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中
C. 向少量的H2O2溶液加入MnO2固体
D. 加热一定量KMnO4固体
10.实验探究是一种重要的学习方法。下列实验不能达到探究目的是( )
A.探究温度的影响
B.探究金属活动性
C.探究物质的着火点
D.探究CO2的性质
11.在试管中放入一根镁条(已去除氧化膜),往其中加入硝酸银溶液至浸没镁条,观察到如下现象:①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中有单质银;②镁条表面有明显的气泡现象,经检验发现气泡中有氢气;对于上述实验现象的分析错误的是( )
A.镁能从硝酸银溶液中置换出银
B.镁跟硝酸银溶液反应会生成氢气
C.镁投入硝酸银溶液中仅发生2AgNO3+Mg=Mg(NO3)2+2Ag反应
D.根据该实验可判断镁比银活动性强
12.下面所示的四个图像,能正确反映对应变化关系的是()
A. 镁在氧气中燃烧
B. 向二氧化锰中加入过氧化氢溶液
C. 向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D. 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
二、填空题
13.请用“左边”或“右边”填写下列空白.
两边同时加入金属后,哪边反应快? .
两边同时加入固体后,哪边试管璧热 .
通电一段时间后,试管里哪边液面高 .
取下镁带点燃后,将生成物全部放回,哪边重? .
14.根据图片中的信息回答下列问题:
(1)此溶液中溶质的化学式为 。
(2)制作马踏飞燕的金属材料是 。金属资源是不可再生的,写出保护金属资源的一条途径 。
(3)用洗涤剂去除油污是因为洗涤剂具有 的功能。
(4)打开汽水瓶盖时,汽水会自动喷出来的原因:汽水中溶有CO2,打开瓶盖, , ,气体逸出,所以汽水自动喷出。
15.工厂师傅在切割钢板时,常用硫酸铜溶液画线,是因为 (用化学方程式表示)。
16.NaOH、CuCl2、HCl、CO2、Fe五种物质间能发生的反应共有 个,任写一个发生反应的化学方程式 。
17.铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
(1)按人类开始使用这三种金属的先后排序为 (用元素符号表示).
(2)在空气中 制品(填“铝”或“铁”)更耐腐蚀.
(3)用下列试剂验证这三种金属的活动性顺序,能达到目的是 (填序号).
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
(4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度 (填“大”或“小”).
18.用实验验证铁、铜、银三种金属的活动性顺序,请写出两种可行方案所需的物质.
方案1: ;方案2: .
三、综合题
19.金属材料对于促进生产发展,改善人类生活发挥了重大作用,因此学习金属性质,根据性质合理使用金属就显得十分重要。请按要求回答下列有关金属性质的问题:
(1)铝具有很好的抗腐蚀性能原因是 。
(2)向含有硝酸铜、硝酸银和硝酸锌的混合溶液中,加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣。滤液中一定含有的溶质是 ,滤渣中一定含有的物质是 。
20.金属材料在生活、生产中有广泛的应用。请回答下列问题:
(1)生活中用铁锅炒菜,主要利用了铁的 性。
(2)工业上用赤铁矿(主要成分为氧化铁)炼铁,其反应原理是 (用化学方程式表示)。
(3)2020年6月21日,时速600公里的高速磁悬浮试验样车成功试跑,制造样车外壳的主要材料是铝合金。铝合金与纯铝相比具有的优点是 (写出一点即可)。
(4)金属资源有限,不能再生。写出防止铁生锈的一种方法 。
21.金属材料在生产和生活中应用广泛。
(1)骑自行车出行,是“低碳”生活的一种方式。
①如图标出的构件中由金属材料制成的是 (填图中的字母)。
②自行车车圈的主要材料是铁合金。请写出工业用赤铁矿炼铁的化学方程式 。
(2)中国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有 的优越性能(答一条)。
(3)某化学小组同学在实验室进行了两个有关金属性质的实验:
实验I:硫酸铝溶液和铁粉混合
实验Ⅱ:硫酸铜溶液与铁粉混合
在上述两个实验结束后,该同学将实验I和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多,原因是 (用文字说明)。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。则所得滤液中溶质一定含有 。
22.氯化铁溶液能腐蚀铜,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程。请回答下列问题:
(1)根据图示,可以推测出步骤①中铜和FeCl3反应的化学方程式是 。
(2)步骤②中发生了两个反应:2FeCl3+Fe=3FeCl2和 。
(3)滤渣的成分有 。
(4)步骤②③所得的滤液中的溶质可与一种气体单质发生化合反应转化为FeCl3,从而实现循环使用。该气体单质是 。
答案解析部分
1.【答案】A
2.【答案】C
3.【答案】C
4.【答案】C
5.【答案】C
6.【答案】C
7.【答案】A
8.【答案】C
9.【答案】B
10.【答案】B
11.【答案】C
12.【答案】B
13.【答案】左边;右边;右边;左边
14.【答案】(1)
(2)青铜;在金属制品表面涂上油漆
(3)乳化
(4)瓶内气压减小; 的溶解度变小
15.【答案】Fe+CuSO4═FeSO4+Cu
16.【答案】5;CuCl2+Fe= FeCl2+Cu(合理即可)
17.【答案】Cu、Fe、Al;铝;B;大
18.【答案】Cu,FeSO4溶液,AgNO3溶液;CuSO4溶液,Fe,Ag
19.【答案】(1)表面有一层致密的氧化膜
(2)硝酸锌、硝酸亚铁或Zn(NO3)2、Fe(NO3)2;银或Ag
20.【答案】(1)导热
(2)
(3)硬度大等合理答案
(4)涂油(或喷漆;或镀上一层耐腐蚀的金属等合理答案)
21.【答案】(1)bde;
(2)硬度大(或强度高、韧性好等合理答案)
(3)实验Ⅰ中未发生反应的铁粉与实验Ⅱ中过量的硫酸铜溶液继续反应生成铜(合理即可);硫酸铝、硫酸亚铁
22.【答案】(1)2FeCl3+Cu=2FeCl2+CuCl2
(2)Fe+CuCl2=FeCl2+Cu
(3)铁、铜
(4)Cl2或氯气
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
