1.3 物质的溶解性 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学
文档属性
| 名称 | 1.3 物质的溶解性 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 122.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-03 19:09:32 | ||
图片预览




文档简介
1.3 物质的溶解性 同步练习
一、单选题
1.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
A.在t1℃时,物质a、c的溶液中溶质质量分数相同
B.在t3℃时, a物质的饱和溶液中溶质质量分数为50%
C.b中混有少量a,可采用降温结晶的方法提纯b
D.将t2℃时a、b的饱和溶液降温到t1℃均有晶体析出
2.如图是甲、乙、丙三种固体物质的溶解度曲线.下列有关说法错误的是( )
A.丙物质的溶解度随温度的升高而降低
B.T1℃时三种物质的饱和溶液,乙的溶质质量分数最大
C.P点表示T2℃时甲、乙两物质的溶解度相等,均为50%
D.保持溶质质量分数不变的情况下,使处于Q点的甲溶液达到饱和状态应采取降温的方法
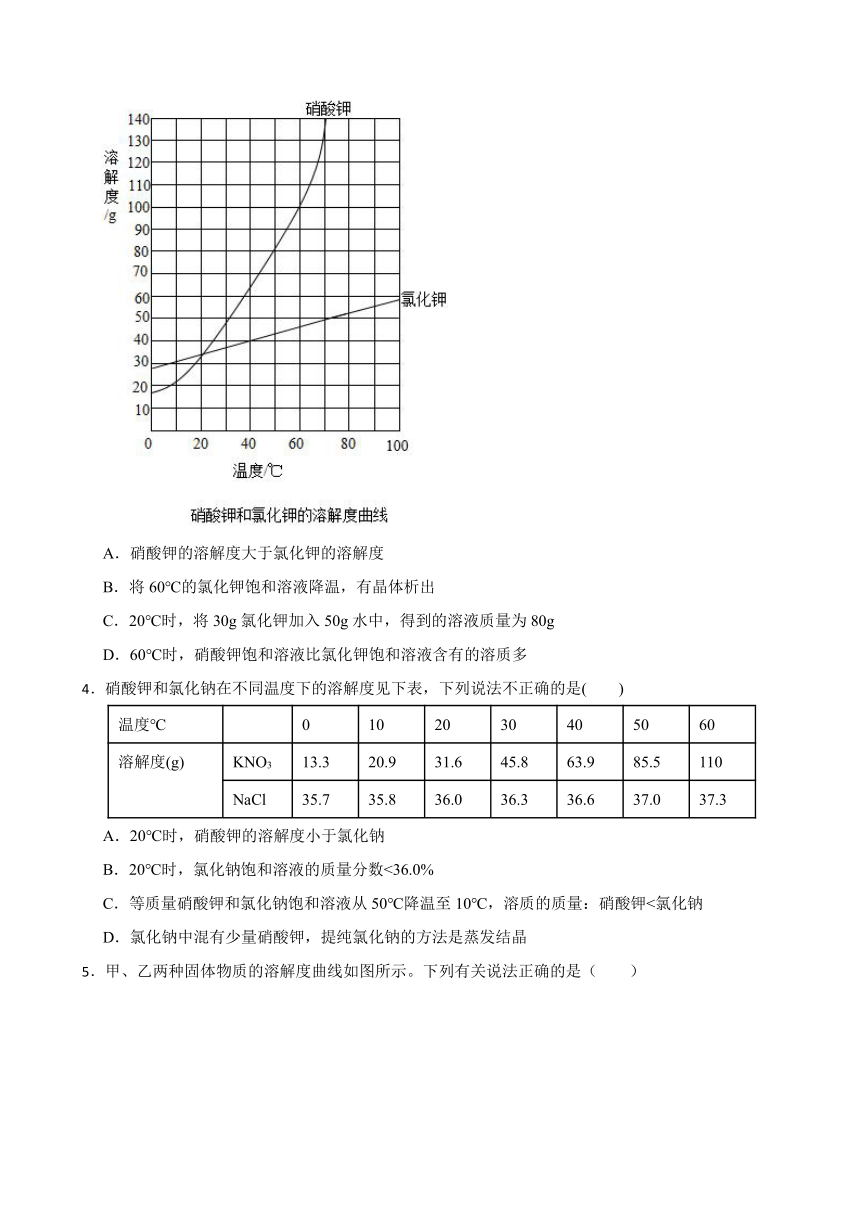
3.图为硝酸钾和氯化钾的溶解度曲线,下列分析正确的是( )
A.硝酸钾的溶解度大于氯化钾的溶解度
B.将60℃的氯化钾饱和溶液降温,有晶体析出
C.20℃时,将30g氯化钾加入50g水中,得到的溶液质量为80g
D.60℃时,硝酸钾饱和溶液比氯化钾饱和溶液含有的溶质多
4.硝酸钾和氯化钠在不同温度下的溶解度见下表,下列说法不正确的是( )
温度℃ 0 10 20 30 40 50 60
溶解度(g) KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
A.20℃时,硝酸钾的溶解度小于氯化钠
B.20℃时,氯化钠饱和溶液的质量分数<36.0%
C.等质量硝酸钾和氯化钠饱和溶液从50℃降温至10℃,溶质的质量:硝酸钾<氯化钠
D.氯化钠中混有少量硝酸钾,提纯氯化钠的方法是蒸发结晶
5.甲、乙两种固体物质的溶解度曲线如图所示。下列有关说法正确的是( )
A.乙中含有少量甲,可采用升温结晶的方法提纯乙
B.M点表示t1℃时100g甲、乙饱和溶液中均含有65g溶质
C.t2℃时等质量的甲、乙溶液中,甲溶液所含溶质较多
D.将t2℃的甲、乙饱和溶液降温至t1℃,得到两溶液的溶质质量分数相等
6.A;B;C三种物质的溶解度曲线如图所示.下列分析正确的是( )
A.t1℃时,A;C两种物质的饱和溶液中溶质的质量相等
B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3
C.将t2℃时A;B;C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D.将C的饱和溶液变为不饱和溶液,可采用升温的方法
7.如图为两种物质的溶解度曲线,下列说法正确的是( )
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于 Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的 Na2Cr2O7、Na2SO4溶液
8.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.打开啤酒瓶盖有大量泡沫逸出
B.烧开水时沸腾前有气泡逸出
C.喝下汽水感到有气味冲到鼻腔
D.夏季黄昏池塘里的鱼常浮出水面
9.甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中正确的是( )
A.t1℃时,甲物质的溶解度与乙物质的溶解度相等
B.t2℃时,将50g甲物质放入100g水中,所得溶液的质量为150g
C.升高温度可将乙物质的饱和溶液变为不饱和溶液
D.当甲物质中含少量乙物质时,可用降温结晶的方法提纯甲物质
10.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转发为M点的甲溶液,可采取恒温蒸发溶剂的方法
11.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.烧开水时,沸腾前有气泡逸出
B.阳光充足,盛满水的鱼缸壁上有小气泡
C.打开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
12.如图为甲乙两种固体在水中的溶解度曲线,下列说法正确的是( )
A.t2时,将甲乙两种物质的饱和溶液降低至t1,仍为饱和溶液
B.t1时,甲乙饱和溶液的溶质质量分数为20%
C.甲物质中混有少量乙,可采用蒸发溶剂方法提纯甲
D.t2时,N点表示乙物质的不饱和溶液
二、填空题
13.NaCl、KNO3的部分溶解度数据见下表。
温度(℃) 10 20 30 40 60 80 100
溶解度(g/100g水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36 36.3 36.4 37 38.4 39.8
①20℃时,硝酸钾的溶解度是 。
②20℃时,称取 60g硝酸钾固体加入到100g水中,用 (写出仪器名称)搅拌,充分溶解后得到 (选填“饱和”或“不饱和”)溶液。将此溶液升温至 60℃,所得溶液的溶质质量分数是 。
③从含有84.5g硝酸钾和8g氯化钠的混合物中提纯硝酸钾,进行如下实验。(实验中不考虑各种损耗)
I、操作1的名称 。
II、溶液1、2、3中关于溶质硝酸钾质量的大小关系 (用“1”、“2”、“3”表示)
III、固体M的成分及质量是 。
IV、对整个实验过程分析正确的是 。
A、40℃~60℃开始析出晶体
B、氯化钠在整个过程中一直保持不饱和状态
C、上述方法不能将氯化钠和硝酸钾完全分离
D、若溶液1直接降温至20℃,析出硝酸钾的质量不变
14.根据硝酸钾和氯化钠的溶解度曲线及下表数据,回答下列问题。
(1)点P的含义是 ;
(2)80℃时将质量相同的氯化钠和硝酸钾配制成饱和溶液,需水量大的是 ;
(3)若要从混有少量氯化钠的硝酸钾固体中得到纯净的硝酸钾应采用的方法是 (选填 “冷却热饱和溶液”或“蒸发溶剂结晶”)。
15.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
(1)P点的含义是 .
(2)t2℃时30ga物质加入到50g水中不断搅拌,能形成80g溶液吗? (填写“能”或“不能”).
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号).
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号).
A.c>a=b B.a=b>c C.a>b>c D.b>a>c.
16.如图是a、b、c三种固体物质的溶解度曲线,回答问题:
①若a中含有少量b,可用 的方法提纯a。
②t2℃时,等质量的a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中溶剂质量由大到小的顺序为 。
17.去年,我国部分地区爆发了H7N9禽流感.为了防止禽流感蔓延,人们将家禽捕杀、掩埋,并在禽舍和掩埋坑中洒上大量热石灰.
(1)熟石灰属于 (填“酸”、“碱”或“盐”).用熟石灰处理硫酸厂废水中的硫酸,其化学方程式为 .
(2)熟石灰的溶解度曲线如图所示,30℃时,将1g 熟石灰加入100g水中充分搅拌、过滤,若不计溶液损失,得到溶液的质量是 g.将该溶液降温到20℃,是否有固体析出 ,(填“是”或“否”)溶液中溶质的质量分数将 (填序号)
A.不变B.增大C.减小.
18.根据下图中(Ⅰ)和(Ⅱ)回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象,如图(Ⅰ)所示,要使剩余的甲固体继续溶解可采用的方法是 .
(2)图(Ⅱ)中a、b分别表示上述两种物质的溶解度曲线,在 ℃时,这两种物质的溶解度相等;a表示的是 物质(填“甲”或“乙”)的溶解度曲线.
三、综合题
19.t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。完成下列各题。
(1)烧杯①的溶液是 (填溶质的化学式)的溶液
(2)t1 ℃时,20g硝酸钾放入50g水中,所得溶液为 (“饱和”或“不饱和”)溶液。
(3)若将烧杯①和烧杯②的溶液都升温到t2 ℃,则两烧杯中溶液的溶质质量分数的大小关系为烧杯①溶液的浓度 (选填“大于”、“小于”、“等于”或“无法比较”)烧杯②溶液的浓度。
(4)t1 ℃时,若将125g硝酸钾的饱和溶液稀释至溶质质量分数为10%,需加水的质量为 g 。
20.如图为甲、乙、丙三种物质的溶解度(溶剂均为水)曲线,请回答下列问题。
(1)当温度为 ℃时,甲乙的溶解度相等。
(2)图中A点表示的乙溶液为 (填“饱和”或“不饱和”)溶液;
(3)t2℃时甲、乙、丙三种物质溶解度的大小关系为 ;
(4)t3℃时,将40g甲物质加入到50g水中,所得溶液溶质的质量分数为 ;
(5)t3℃时,等质量的甲、乙和丙三种物质的饱和溶液中,所含有溶剂质量大小关系为 。
(6)t3℃时,将甲、乙和丙三种物质的饱和溶液降温到t1℃,所得溶液的质量分数大小关系为 。
21.甲、乙两种物质的溶解度曲线如图所示,请回答下列问题:
(1)P点表示的含义是 ;
(2)30℃时,甲物质的溶解度 (填“大于”“小于”或 “等于”)乙物质的溶解度;
(3)要使接近饱和的甲溶液变成饱和溶液、可采用的方法是 (写一种)。
22.两种固体物质NaCl和KCl的溶解度曲线如图所示,现有40gNaCl、40gKCl两份固体,分别置于两只烧杯中,各倒入100g50℃蒸馏水充分溶解,实验现象如图所示。请回答下列问题:
(1)NaCl和KCl的溶解度相等时的温度为 。
(2)甲中加入的固体是 (填“NaCl”或“KCl”)。
(3)50℃时,甲中溶液 (填“是”或“不是”)饱和状态。
(4)分别将甲、乙中的溶液降温至10℃,乙中溶液的质量分数 (填“>”“<”或“=”)甲中溶质的质量分数。
(5)对于t℃时的30%KCl溶液,下列说法正确的是____。
A.均一、稳定、透明
B.每100g水中溶解30g KCl
C.某种条件下,可转化为悬浊液
D.若再加30g氯化钾,则变为60%KCl溶液
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】B
4.【答案】C
5.【答案】A
6.【答案】B
7.【答案】D
8.【答案】A
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】B
13.【答案】31.6g;玻璃棒;饱和;37.5%;过滤;1=2>3;硝酸钾68.7g;BC
14.【答案】(1)该温度下,硝酸钾和氯化钠的溶解度相等
(2)氯化钠
(3)冷却热饱和溶液
15.【答案】t1℃时a和c的溶解度都为20克;不能;c<b<a;D
16.【答案】降温结晶(或冷却热饱和溶液);c>b>a
17.【答案】碱;Ca(OH)2+H2SO4=CaSO4+2H2O;100.15;否;B
18.【答案】升高温度或加入水;t2;甲
19.【答案】(1)KNO3
(2)饱和
(3)等于
(4)125
20.【答案】(1)t1
(2)不饱和
(3)甲=乙>丙
(4)37.5%
(5)丙>乙>甲
(6)乙>甲>丙
21.【答案】(1)甲、乙溶解度相等
(2)大于
(3)降温
22.【答案】(1)28℃
(2)KCl
(3)不是
(4)>
(5)A;C
一、单选题
1.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
A.在t1℃时,物质a、c的溶液中溶质质量分数相同
B.在t3℃时, a物质的饱和溶液中溶质质量分数为50%
C.b中混有少量a,可采用降温结晶的方法提纯b
D.将t2℃时a、b的饱和溶液降温到t1℃均有晶体析出
2.如图是甲、乙、丙三种固体物质的溶解度曲线.下列有关说法错误的是( )
A.丙物质的溶解度随温度的升高而降低
B.T1℃时三种物质的饱和溶液,乙的溶质质量分数最大
C.P点表示T2℃时甲、乙两物质的溶解度相等,均为50%
D.保持溶质质量分数不变的情况下,使处于Q点的甲溶液达到饱和状态应采取降温的方法
3.图为硝酸钾和氯化钾的溶解度曲线,下列分析正确的是( )
A.硝酸钾的溶解度大于氯化钾的溶解度
B.将60℃的氯化钾饱和溶液降温,有晶体析出
C.20℃时,将30g氯化钾加入50g水中,得到的溶液质量为80g
D.60℃时,硝酸钾饱和溶液比氯化钾饱和溶液含有的溶质多
4.硝酸钾和氯化钠在不同温度下的溶解度见下表,下列说法不正确的是( )
温度℃ 0 10 20 30 40 50 60
溶解度(g) KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
A.20℃时,硝酸钾的溶解度小于氯化钠
B.20℃时,氯化钠饱和溶液的质量分数<36.0%
C.等质量硝酸钾和氯化钠饱和溶液从50℃降温至10℃,溶质的质量:硝酸钾<氯化钠
D.氯化钠中混有少量硝酸钾,提纯氯化钠的方法是蒸发结晶
5.甲、乙两种固体物质的溶解度曲线如图所示。下列有关说法正确的是( )
A.乙中含有少量甲,可采用升温结晶的方法提纯乙
B.M点表示t1℃时100g甲、乙饱和溶液中均含有65g溶质
C.t2℃时等质量的甲、乙溶液中,甲溶液所含溶质较多
D.将t2℃的甲、乙饱和溶液降温至t1℃,得到两溶液的溶质质量分数相等
6.A;B;C三种物质的溶解度曲线如图所示.下列分析正确的是( )
A.t1℃时,A;C两种物质的饱和溶液中溶质的质量相等
B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3
C.将t2℃时A;B;C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D.将C的饱和溶液变为不饱和溶液,可采用升温的方法
7.如图为两种物质的溶解度曲线,下列说法正确的是( )
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于 Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的 Na2Cr2O7、Na2SO4溶液
8.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.打开啤酒瓶盖有大量泡沫逸出
B.烧开水时沸腾前有气泡逸出
C.喝下汽水感到有气味冲到鼻腔
D.夏季黄昏池塘里的鱼常浮出水面
9.甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中正确的是( )
A.t1℃时,甲物质的溶解度与乙物质的溶解度相等
B.t2℃时,将50g甲物质放入100g水中,所得溶液的质量为150g
C.升高温度可将乙物质的饱和溶液变为不饱和溶液
D.当甲物质中含少量乙物质时,可用降温结晶的方法提纯甲物质
10.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转发为M点的甲溶液,可采取恒温蒸发溶剂的方法
11.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.烧开水时,沸腾前有气泡逸出
B.阳光充足,盛满水的鱼缸壁上有小气泡
C.打开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
12.如图为甲乙两种固体在水中的溶解度曲线,下列说法正确的是( )
A.t2时,将甲乙两种物质的饱和溶液降低至t1,仍为饱和溶液
B.t1时,甲乙饱和溶液的溶质质量分数为20%
C.甲物质中混有少量乙,可采用蒸发溶剂方法提纯甲
D.t2时,N点表示乙物质的不饱和溶液
二、填空题
13.NaCl、KNO3的部分溶解度数据见下表。
温度(℃) 10 20 30 40 60 80 100
溶解度(g/100g水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36 36.3 36.4 37 38.4 39.8
①20℃时,硝酸钾的溶解度是 。
②20℃时,称取 60g硝酸钾固体加入到100g水中,用 (写出仪器名称)搅拌,充分溶解后得到 (选填“饱和”或“不饱和”)溶液。将此溶液升温至 60℃,所得溶液的溶质质量分数是 。
③从含有84.5g硝酸钾和8g氯化钠的混合物中提纯硝酸钾,进行如下实验。(实验中不考虑各种损耗)
I、操作1的名称 。
II、溶液1、2、3中关于溶质硝酸钾质量的大小关系 (用“1”、“2”、“3”表示)
III、固体M的成分及质量是 。
IV、对整个实验过程分析正确的是 。
A、40℃~60℃开始析出晶体
B、氯化钠在整个过程中一直保持不饱和状态
C、上述方法不能将氯化钠和硝酸钾完全分离
D、若溶液1直接降温至20℃,析出硝酸钾的质量不变
14.根据硝酸钾和氯化钠的溶解度曲线及下表数据,回答下列问题。
(1)点P的含义是 ;
(2)80℃时将质量相同的氯化钠和硝酸钾配制成饱和溶液,需水量大的是 ;
(3)若要从混有少量氯化钠的硝酸钾固体中得到纯净的硝酸钾应采用的方法是 (选填 “冷却热饱和溶液”或“蒸发溶剂结晶”)。
15.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
(1)P点的含义是 .
(2)t2℃时30ga物质加入到50g水中不断搅拌,能形成80g溶液吗? (填写“能”或“不能”).
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号).
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号).
A.c>a=b B.a=b>c C.a>b>c D.b>a>c.
16.如图是a、b、c三种固体物质的溶解度曲线,回答问题:
①若a中含有少量b,可用 的方法提纯a。
②t2℃时,等质量的a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中溶剂质量由大到小的顺序为 。
17.去年,我国部分地区爆发了H7N9禽流感.为了防止禽流感蔓延,人们将家禽捕杀、掩埋,并在禽舍和掩埋坑中洒上大量热石灰.
(1)熟石灰属于 (填“酸”、“碱”或“盐”).用熟石灰处理硫酸厂废水中的硫酸,其化学方程式为 .
(2)熟石灰的溶解度曲线如图所示,30℃时,将1g 熟石灰加入100g水中充分搅拌、过滤,若不计溶液损失,得到溶液的质量是 g.将该溶液降温到20℃,是否有固体析出 ,(填“是”或“否”)溶液中溶质的质量分数将 (填序号)
A.不变B.增大C.减小.
18.根据下图中(Ⅰ)和(Ⅱ)回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象,如图(Ⅰ)所示,要使剩余的甲固体继续溶解可采用的方法是 .
(2)图(Ⅱ)中a、b分别表示上述两种物质的溶解度曲线,在 ℃时,这两种物质的溶解度相等;a表示的是 物质(填“甲”或“乙”)的溶解度曲线.
三、综合题
19.t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。完成下列各题。
(1)烧杯①的溶液是 (填溶质的化学式)的溶液
(2)t1 ℃时,20g硝酸钾放入50g水中,所得溶液为 (“饱和”或“不饱和”)溶液。
(3)若将烧杯①和烧杯②的溶液都升温到t2 ℃,则两烧杯中溶液的溶质质量分数的大小关系为烧杯①溶液的浓度 (选填“大于”、“小于”、“等于”或“无法比较”)烧杯②溶液的浓度。
(4)t1 ℃时,若将125g硝酸钾的饱和溶液稀释至溶质质量分数为10%,需加水的质量为 g 。
20.如图为甲、乙、丙三种物质的溶解度(溶剂均为水)曲线,请回答下列问题。
(1)当温度为 ℃时,甲乙的溶解度相等。
(2)图中A点表示的乙溶液为 (填“饱和”或“不饱和”)溶液;
(3)t2℃时甲、乙、丙三种物质溶解度的大小关系为 ;
(4)t3℃时,将40g甲物质加入到50g水中,所得溶液溶质的质量分数为 ;
(5)t3℃时,等质量的甲、乙和丙三种物质的饱和溶液中,所含有溶剂质量大小关系为 。
(6)t3℃时,将甲、乙和丙三种物质的饱和溶液降温到t1℃,所得溶液的质量分数大小关系为 。
21.甲、乙两种物质的溶解度曲线如图所示,请回答下列问题:
(1)P点表示的含义是 ;
(2)30℃时,甲物质的溶解度 (填“大于”“小于”或 “等于”)乙物质的溶解度;
(3)要使接近饱和的甲溶液变成饱和溶液、可采用的方法是 (写一种)。
22.两种固体物质NaCl和KCl的溶解度曲线如图所示,现有40gNaCl、40gKCl两份固体,分别置于两只烧杯中,各倒入100g50℃蒸馏水充分溶解,实验现象如图所示。请回答下列问题:
(1)NaCl和KCl的溶解度相等时的温度为 。
(2)甲中加入的固体是 (填“NaCl”或“KCl”)。
(3)50℃时,甲中溶液 (填“是”或“不是”)饱和状态。
(4)分别将甲、乙中的溶液降温至10℃,乙中溶液的质量分数 (填“>”“<”或“=”)甲中溶质的质量分数。
(5)对于t℃时的30%KCl溶液,下列说法正确的是____。
A.均一、稳定、透明
B.每100g水中溶解30g KCl
C.某种条件下,可转化为悬浊液
D.若再加30g氯化钾,则变为60%KCl溶液
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】B
4.【答案】C
5.【答案】A
6.【答案】B
7.【答案】D
8.【答案】A
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】B
13.【答案】31.6g;玻璃棒;饱和;37.5%;过滤;1=2>3;硝酸钾68.7g;BC
14.【答案】(1)该温度下,硝酸钾和氯化钠的溶解度相等
(2)氯化钠
(3)冷却热饱和溶液
15.【答案】t1℃时a和c的溶解度都为20克;不能;c<b<a;D
16.【答案】降温结晶(或冷却热饱和溶液);c>b>a
17.【答案】碱;Ca(OH)2+H2SO4=CaSO4+2H2O;100.15;否;B
18.【答案】升高温度或加入水;t2;甲
19.【答案】(1)KNO3
(2)饱和
(3)等于
(4)125
20.【答案】(1)t1
(2)不饱和
(3)甲=乙>丙
(4)37.5%
(5)丙>乙>甲
(6)乙>甲>丙
21.【答案】(1)甲、乙溶解度相等
(2)大于
(3)降温
22.【答案】(1)28℃
(2)KCl
(3)不是
(4)>
(5)A;C
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
