3.3.2 金属晶体与离子晶体(第2课时 离子晶体)(课件精讲)(共25张PPT)高二化学同步课件精讲(人教版2019选择性必修2)
文档属性
| 名称 | 3.3.2 金属晶体与离子晶体(第2课时 离子晶体)(课件精讲)(共25张PPT)高二化学同步课件精讲(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 10:13:30 | ||
图片预览







文档简介
(共25张PPT)
第三节 金属晶体与离子晶体
课时2
离子晶体
第三章 晶体结构与性质
学习
目标
PART
01
PART
02
离子晶体的性质
PART
03
离子晶体
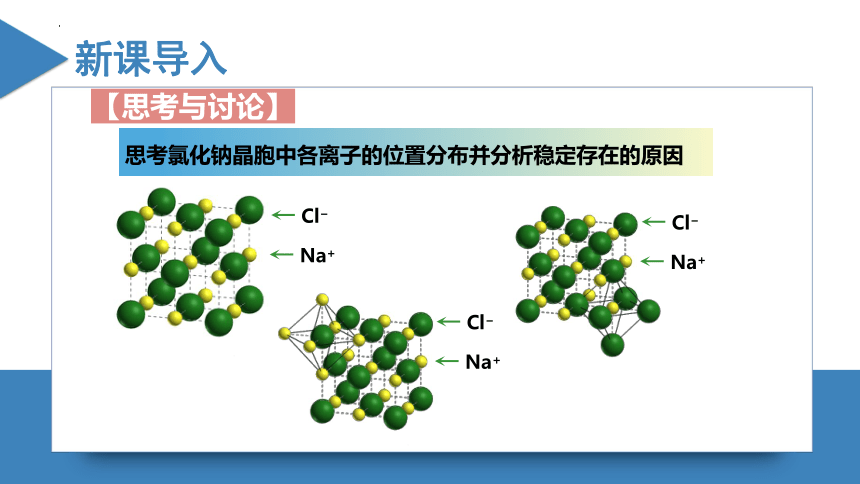
离子键
Cl
Na+
思考氯化钠晶胞中各离子的位置分布并分析稳定存在的原因
Cl
Na+
Cl
Na+
【思考与讨论】
01
离子键
01、离子键
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
(1)影响因素:
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
01、离子键
(2)特征:
离子键没有方向性和饱和性。
因此,以离子键结合的化合物倾向于形成紧密堆积,使每个离子周围尽可能多地排列异性电荷的离子,从而达到稳定的目的。
离子键的实质:是静电作用,它包括阴、阳离子之间的引力和两种离子的原子核之间以及它们的电子之间的斥力两个方面,当引力与斥力之间达到平衡时就形成了稳定的离子化合物,它不显电性。
(3)实质:
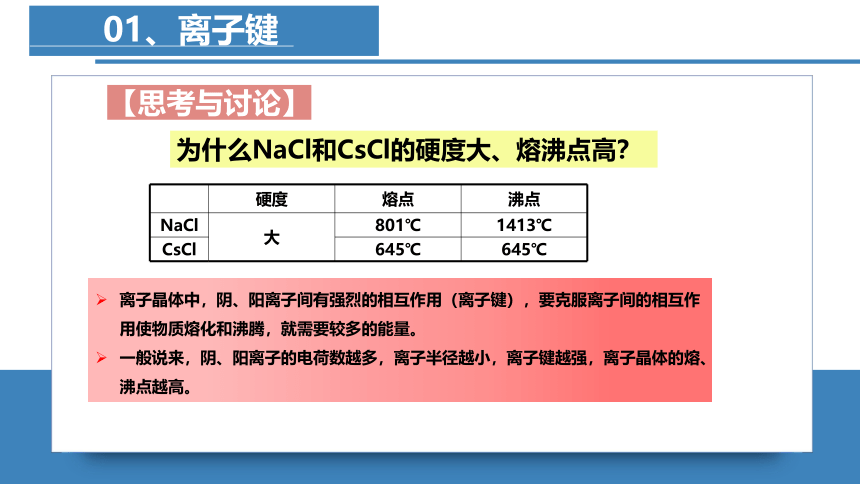
01、离子键
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
为什么NaCl和CsCl的硬度大、熔沸点高?
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
【思考与讨论】
02
离子晶体
02、离子晶体
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
下列晶体构成微粒有什么共同点?
微粒之间存在哪种相同的作用力?
02、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
常见的离子晶体
离子晶体的性质
熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
概念:
02、离子晶体
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
02、离子晶体
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
顶点和面心是钠离子
棱上和体心是氯离子
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
NaCl
氯化钠晶体
02、离子晶体
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
这几个Na+在空间构成的几何构型为正八面体
配位数:一个离子周围最邻近的异电性离子的数目
02、离子晶体
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
一种离子周围最邻近的带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
氯化钠晶体
02、离子晶体
CsCl晶体
02、离子晶体
(1)铯离子和氯离子的位置?
铯离子:
氯离子:
(2)每个晶胞含铯离子、氯离子的个数?
铯离子:
氯离子:
或者反之
1个;
1个。
体心
顶点
Cl-
Cs+
(3)配位数
它们所围成的空间几何构型是 。
8
正六面体
Cs+的配位数为: ;Cl-的配位数为: 。
8
8
8
CsCl晶体
03
离子晶体的性质
03、离子晶体的性质
1、导电性
离子化合物溶于水时,阴、阳离子受到水分子作用变成了自由移动的离子(实质上是水合离子),在外界电场作用下,阴、阳离子定向移动而导电。
离子晶体中,离子键较强,离子不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
当升高温度时,阴、阳离子获得足够能量克服离子间的相互作用,成为自由移动的离子(熔融状态),在外界电场作用下,离子定向移动而形成电流。
03、离子晶体的性质
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。因此,离子晶体具有较高的熔、沸点和难挥发的性质。
2、具有较高的熔、沸点,难挥发
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
03、离子晶体的性质
3、硬度
离子晶体的硬度较大,难于压缩。
阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
发生滑动
施加外力
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
03、离子晶体的性质
4、溶解性
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
比较不同晶体熔、沸点的基本思路
1.下列说法错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.共价晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
C
2.下列关于晶体性质的比较中,错误的是
A.熔点:SiO2>CO2
B.硬度:金刚石>晶体硅
C.延展性:Fe>Au
D.晶格能:MgO>Na2O
C
3.填空。
A B C
化学式 CH3CH2Cl CH3CH2CH2Cl CH3NH3Cl
熔点/℃ -139 -123 230
(1)化合物A、B、C的熔点如下表:化合物C的熔点明显高于A的原因是___________。(2)20%的NaCl溶液中滴加乙醇会有白色固体析出,原因是___________。
(1)C是离子晶体,A是分子晶体,离子键强于分子间作用力
(2)乙醇和水是互溶的,NaCl易溶于水难溶于乙醇,滴加乙醇会使NaCl在溶液中的饱和浓度减小,从而饱和析出
第三节 金属晶体与离子晶体
课时2
离子晶体
第三章 晶体结构与性质
学习
目标
PART
01
PART
02
离子晶体的性质
PART
03
离子晶体
离子键
Cl
Na+
思考氯化钠晶胞中各离子的位置分布并分析稳定存在的原因
Cl
Na+
Cl
Na+
【思考与讨论】
01
离子键
01、离子键
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
(1)影响因素:
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
01、离子键
(2)特征:
离子键没有方向性和饱和性。
因此,以离子键结合的化合物倾向于形成紧密堆积,使每个离子周围尽可能多地排列异性电荷的离子,从而达到稳定的目的。
离子键的实质:是静电作用,它包括阴、阳离子之间的引力和两种离子的原子核之间以及它们的电子之间的斥力两个方面,当引力与斥力之间达到平衡时就形成了稳定的离子化合物,它不显电性。
(3)实质:
01、离子键
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
为什么NaCl和CsCl的硬度大、熔沸点高?
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
【思考与讨论】
02
离子晶体
02、离子晶体
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
下列晶体构成微粒有什么共同点?
微粒之间存在哪种相同的作用力?
02、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
常见的离子晶体
离子晶体的性质
熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
概念:
02、离子晶体
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
02、离子晶体
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
顶点和面心是钠离子
棱上和体心是氯离子
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
NaCl
氯化钠晶体
02、离子晶体
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
这几个Na+在空间构成的几何构型为正八面体
配位数:一个离子周围最邻近的异电性离子的数目
02、离子晶体
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
一种离子周围最邻近的带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
氯化钠晶体
02、离子晶体
CsCl晶体
02、离子晶体
(1)铯离子和氯离子的位置?
铯离子:
氯离子:
(2)每个晶胞含铯离子、氯离子的个数?
铯离子:
氯离子:
或者反之
1个;
1个。
体心
顶点
Cl-
Cs+
(3)配位数
它们所围成的空间几何构型是 。
8
正六面体
Cs+的配位数为: ;Cl-的配位数为: 。
8
8
8
CsCl晶体
03
离子晶体的性质
03、离子晶体的性质
1、导电性
离子化合物溶于水时,阴、阳离子受到水分子作用变成了自由移动的离子(实质上是水合离子),在外界电场作用下,阴、阳离子定向移动而导电。
离子晶体中,离子键较强,离子不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
当升高温度时,阴、阳离子获得足够能量克服离子间的相互作用,成为自由移动的离子(熔融状态),在外界电场作用下,离子定向移动而形成电流。
03、离子晶体的性质
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。因此,离子晶体具有较高的熔、沸点和难挥发的性质。
2、具有较高的熔、沸点,难挥发
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
03、离子晶体的性质
3、硬度
离子晶体的硬度较大,难于压缩。
阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
发生滑动
施加外力
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
03、离子晶体的性质
4、溶解性
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
比较不同晶体熔、沸点的基本思路
1.下列说法错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.共价晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
C
2.下列关于晶体性质的比较中,错误的是
A.熔点:SiO2>CO2
B.硬度:金刚石>晶体硅
C.延展性:Fe>Au
D.晶格能:MgO>Na2O
C
3.填空。
A B C
化学式 CH3CH2Cl CH3CH2CH2Cl CH3NH3Cl
熔点/℃ -139 -123 230
(1)化合物A、B、C的熔点如下表:化合物C的熔点明显高于A的原因是___________。(2)20%的NaCl溶液中滴加乙醇会有白色固体析出,原因是___________。
(1)C是离子晶体,A是分子晶体,离子键强于分子间作用力
(2)乙醇和水是互溶的,NaCl易溶于水难溶于乙醇,滴加乙醇会使NaCl在溶液中的饱和浓度减小,从而饱和析出
