3.3.1 粗盐提纯 从海水中提取溴 课件(共18张PPT) 2022-2023学年高一上学期化学苏教版2019 必修第一册
文档属性
| 名称 | 3.3.1 粗盐提纯 从海水中提取溴 课件(共18张PPT) 2022-2023学年高一上学期化学苏教版2019 必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 20:56:56 | ||
图片预览






文档简介
(共18张PPT)
3.3.1 粗盐提纯 从海水中提取溴
从太空中遥望地球
蓝色星球
海水中含有大量盐类,平均每公里3海水中含3500万吨无机盐类物质,其中含量较高的有氯(1900万吨/公里3)、钠(1050万吨/公里3)、镁(135万吨/公里3)、硫(88.5万吨/公里3)、钙(40万吨/公里3)、钾(38万吨/公里3)、溴(6.5万吨/公里3)、碳(2.8万吨/公里3)、锶(0.8万吨/公里3)和硼(0.46万吨/公里3),以及锂、铷、磷、碘、钡、铟、锌、铁、铅、铝等。
它们大都呈化合物状态存在,如氯化钠、氯化镁、硫酸钙等,其中氯化钠约占海洋盐类总重量(约5亿亿吨)的80%。
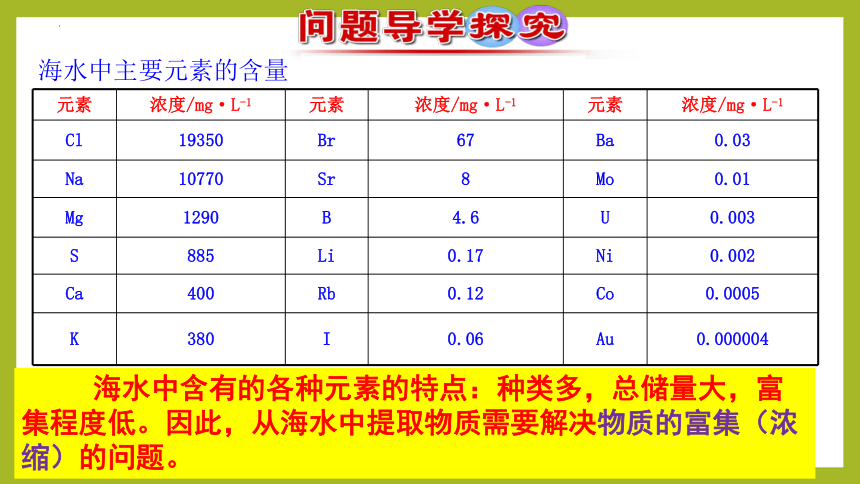
元素 浓度/mg·L-1 元素 浓度/mg·L-1 元素 浓度/mg·L-1
Cl 19350 Br 67 Ba 0.03
Na 10770 Sr 8 Mo 0.01
Mg 1290 B 4.6 U 0.003
S 885 Li 0.17 Ni 0.002
Ca 400 Rb 0.12 Co 0.0005
K 380 I 0.06 Au 0.000004
海水中主要元素的含量
海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集(浓缩)的问题。
知识复习
在之前的课程中,我们学过哪些物质是从海水中
得到的?你能说出它的制备方法吗?
1.食盐
2.氯气、氢气、氢氧化钠
——海水晒盐
——氯碱工业
3.金属钠
——电解熔融氯化钠
一、粗盐精制
直接从海水中提取的氯化钠含有CaCl2、MgCl2、Na2SO4和难溶性物质等许多杂质,需要提纯,也就是精制。
可溶性杂质(CaCl2、MgCl2、Na2SO4)
任务一 难溶性杂质的去除
步骤 杂质离子 加入试剂 离子方程式
1 SO42-
2 Mg2+
3 Ca2+
4
5
6
过量NaOH溶液
过量BaCl2溶液
Ba2+
Ba2++SO42-=BaSO4↓
Mg2++2OH-=Mg(OH)2↓
OH-
过量Na2CO3溶液
Ca2++CO32-=CaCO3↓
CO32-
Ba2++CO32-=BaCO3↓
稀盐酸
H++OH-=H2O
2H++ CO32-=CO2↑+H2O
任务二 可溶性杂质的去除
可溶性杂质(CaCl2、MgCl2、Na2SO4)
除杂的基本原则:
①除杂不引杂
②除杂试剂应过量
③过量的杂质离子应除去
思考:除杂试剂应按什么顺序加入?
NaOH →BaCl2→Na2CO3→ HCl
BaCl2→NaOH →Na2CO3→ HCl
BaCl2→Na2CO3→NaOH → HCl
先“钡”后“碳”,碱随意
任务三 粗盐提纯的工艺流程
过滤之后加盐酸
思考:如何检验食盐中的杂质离子SO42-是否除尽
静置,取上层清液,继续滴加氯化钡溶液,若无白色沉淀生成,说明SO42-已除尽。
液溴Br2
溴蒸气
溴(Br2)的物理性质
颜色:深红棕色
状态:常温下,Br2是唯一呈液态状的非金属单质。
密度:比水大
溶解度:在水中溶解度很小;易溶于酒精、四氯化碳等有机溶剂
沸点:易挥发;
保存:密闭保存,常往盛溴的试剂瓶中加入一些水——水封。
二、从海水中提取溴
承装溴水的试剂瓶不能用橡胶塞
2Br- + Cl2 == Br2 + 2Cl-
利用氧化还原反应原理,将氯气通入提取食盐后的母液(用硫酸酸化以抑制氯、溴与水的反应)中,将溶液中的溴离子转化为溴单质。
海水中
NaBr
-1
Br2
0
失电子
加氧化剂
1、原理:
③热空气或水蒸气吹出
①硫酸酸化
②氯气氧化
海水
苦卤
提取粗盐
含Br2的海水
含Br2的空气
粗溴
纯溴
2、工艺流程
思考1: 如何将溴从海水中提取出来呢
冷凝
精制
溴的应用
变色玻璃原理:
光线变暗:2Ag+Br2==2AgBr
CuO
强光照射:2AgBr==2Ag+Br2
光
③热空气或水蒸气吹出
①硫酸酸化
②氯气氧化
海水
苦卤
提取粗盐
含Br2的海水
含Br2的空气
④SO2吸收
吸收液
⑤氯气氧化
Br2与水的混合物
⑥热空气吹出
Br2蒸气
2、工艺流程
思考1:得到的单质溴仍然溶解在海水中,如何将溴从海水中提取出来呢
思考3:为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”
思考2:含溴的空气与SO2反应的原理是什么?
课堂小结
课堂练习:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、__________、__________或H2、__________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,可制得HBr和硫酸,该反应中,氧化剂是____________(填化学式,下同),氧化产物是____________。
(3)写出步骤Ⅲ反应的化学方程式:___________________________。
NaClO
Cl2
NaOH
Br2
H2SO4
Cl2+2HBr===2HCl+Br2
3.3.1 粗盐提纯 从海水中提取溴
从太空中遥望地球
蓝色星球
海水中含有大量盐类,平均每公里3海水中含3500万吨无机盐类物质,其中含量较高的有氯(1900万吨/公里3)、钠(1050万吨/公里3)、镁(135万吨/公里3)、硫(88.5万吨/公里3)、钙(40万吨/公里3)、钾(38万吨/公里3)、溴(6.5万吨/公里3)、碳(2.8万吨/公里3)、锶(0.8万吨/公里3)和硼(0.46万吨/公里3),以及锂、铷、磷、碘、钡、铟、锌、铁、铅、铝等。
它们大都呈化合物状态存在,如氯化钠、氯化镁、硫酸钙等,其中氯化钠约占海洋盐类总重量(约5亿亿吨)的80%。
元素 浓度/mg·L-1 元素 浓度/mg·L-1 元素 浓度/mg·L-1
Cl 19350 Br 67 Ba 0.03
Na 10770 Sr 8 Mo 0.01
Mg 1290 B 4.6 U 0.003
S 885 Li 0.17 Ni 0.002
Ca 400 Rb 0.12 Co 0.0005
K 380 I 0.06 Au 0.000004
海水中主要元素的含量
海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集(浓缩)的问题。
知识复习
在之前的课程中,我们学过哪些物质是从海水中
得到的?你能说出它的制备方法吗?
1.食盐
2.氯气、氢气、氢氧化钠
——海水晒盐
——氯碱工业
3.金属钠
——电解熔融氯化钠
一、粗盐精制
直接从海水中提取的氯化钠含有CaCl2、MgCl2、Na2SO4和难溶性物质等许多杂质,需要提纯,也就是精制。
可溶性杂质(CaCl2、MgCl2、Na2SO4)
任务一 难溶性杂质的去除
步骤 杂质离子 加入试剂 离子方程式
1 SO42-
2 Mg2+
3 Ca2+
4
5
6
过量NaOH溶液
过量BaCl2溶液
Ba2+
Ba2++SO42-=BaSO4↓
Mg2++2OH-=Mg(OH)2↓
OH-
过量Na2CO3溶液
Ca2++CO32-=CaCO3↓
CO32-
Ba2++CO32-=BaCO3↓
稀盐酸
H++OH-=H2O
2H++ CO32-=CO2↑+H2O
任务二 可溶性杂质的去除
可溶性杂质(CaCl2、MgCl2、Na2SO4)
除杂的基本原则:
①除杂不引杂
②除杂试剂应过量
③过量的杂质离子应除去
思考:除杂试剂应按什么顺序加入?
NaOH →BaCl2→Na2CO3→ HCl
BaCl2→NaOH →Na2CO3→ HCl
BaCl2→Na2CO3→NaOH → HCl
先“钡”后“碳”,碱随意
任务三 粗盐提纯的工艺流程
过滤之后加盐酸
思考:如何检验食盐中的杂质离子SO42-是否除尽
静置,取上层清液,继续滴加氯化钡溶液,若无白色沉淀生成,说明SO42-已除尽。
液溴Br2
溴蒸气
溴(Br2)的物理性质
颜色:深红棕色
状态:常温下,Br2是唯一呈液态状的非金属单质。
密度:比水大
溶解度:在水中溶解度很小;易溶于酒精、四氯化碳等有机溶剂
沸点:易挥发;
保存:密闭保存,常往盛溴的试剂瓶中加入一些水——水封。
二、从海水中提取溴
承装溴水的试剂瓶不能用橡胶塞
2Br- + Cl2 == Br2 + 2Cl-
利用氧化还原反应原理,将氯气通入提取食盐后的母液(用硫酸酸化以抑制氯、溴与水的反应)中,将溶液中的溴离子转化为溴单质。
海水中
NaBr
-1
Br2
0
失电子
加氧化剂
1、原理:
③热空气或水蒸气吹出
①硫酸酸化
②氯气氧化
海水
苦卤
提取粗盐
含Br2的海水
含Br2的空气
粗溴
纯溴
2、工艺流程
思考1: 如何将溴从海水中提取出来呢
冷凝
精制
溴的应用
变色玻璃原理:
光线变暗:2Ag+Br2==2AgBr
CuO
强光照射:2AgBr==2Ag+Br2
光
③热空气或水蒸气吹出
①硫酸酸化
②氯气氧化
海水
苦卤
提取粗盐
含Br2的海水
含Br2的空气
④SO2吸收
吸收液
⑤氯气氧化
Br2与水的混合物
⑥热空气吹出
Br2蒸气
2、工艺流程
思考1:得到的单质溴仍然溶解在海水中,如何将溴从海水中提取出来呢
思考3:为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”
思考2:含溴的空气与SO2反应的原理是什么?
课堂小结
课堂练习:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、__________、__________或H2、__________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,可制得HBr和硫酸,该反应中,氧化剂是____________(填化学式,下同),氧化产物是____________。
(3)写出步骤Ⅲ反应的化学方程式:___________________________。
NaClO
Cl2
NaOH
Br2
H2SO4
Cl2+2HBr===2HCl+Br2
