2.1共价键 课件(共22张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1共价键 课件(共22张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 | 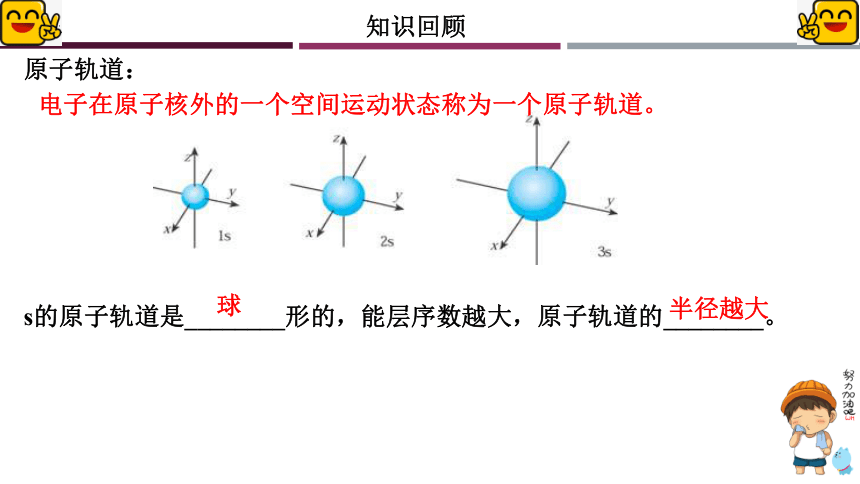 | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 21:00:36 | ||
图片预览



文档简介
(共22张PPT)
s的原子轨道是________形的,能层序数越大,原子轨道的________。
球
半径越大
电子在原子核外的一个空间运动状态称为一个原子轨道。
原子轨道:
知识回顾
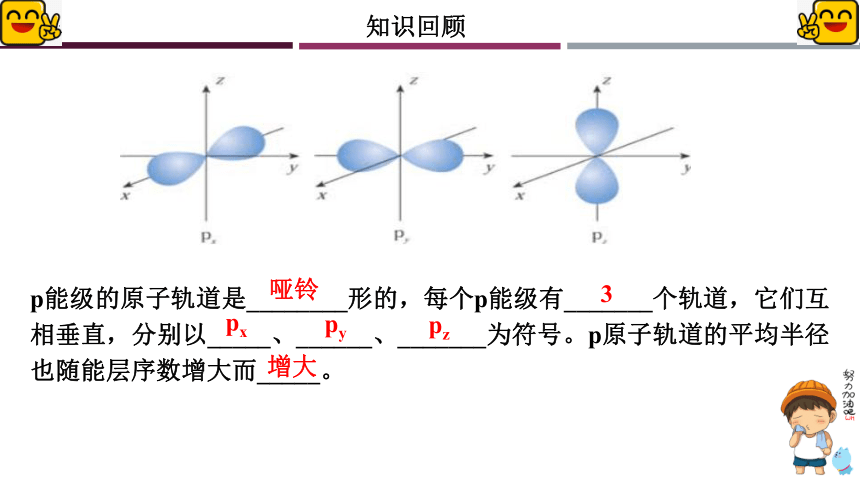
p能级的原子轨道是________形的,每个p能级有_______个轨道,它们互相垂直,分别以_____、______、_______为符号。p原子轨道的平均半径也随能层序数增大而_____。
哑铃
3
px
py
pz
增大
知识回顾
一、共价键
H
H
H
H
用原子轨道描述氢原子形成氢分子的过程
1s1
1s1
相互靠拢
原子轨道相互重叠
形成氢分子的共价键(H-H)
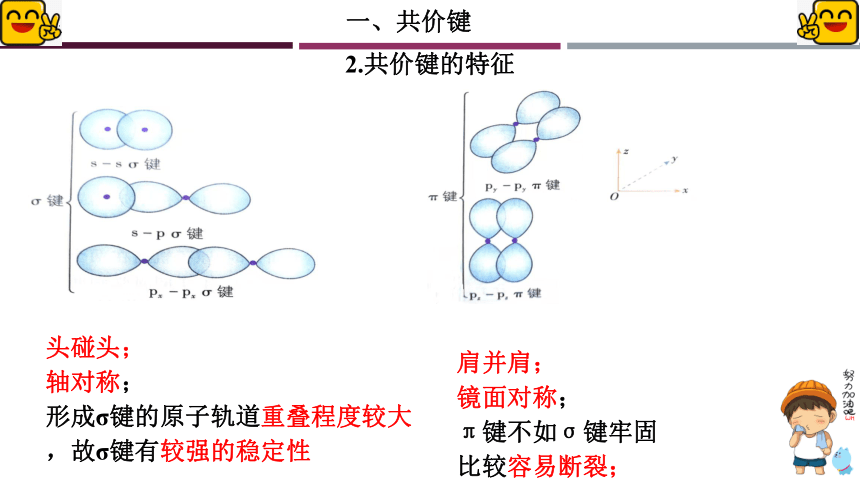
① σ键
特征
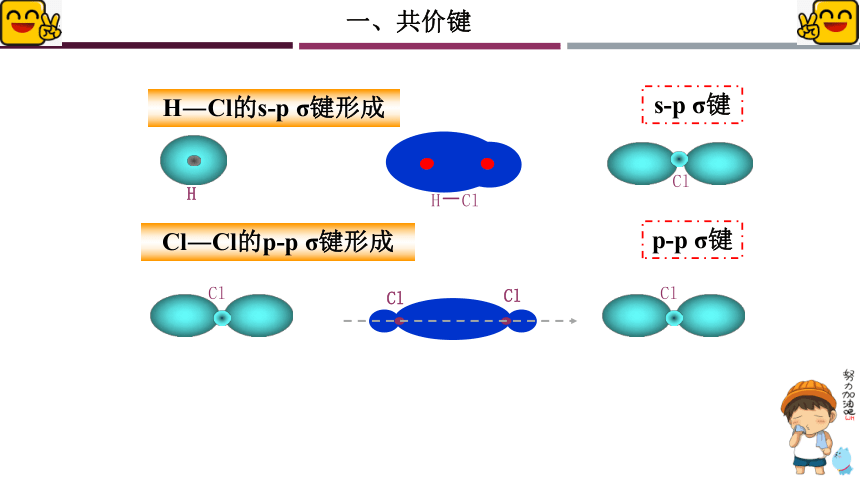
s-s σ键
以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称
1.定义:
原子间通共用电子对所形成的相互作用叫做共价键。
2.本质:原子间通过共用电子对 (即原子轨道重叠)产生的强烈作用
3 分类
H
Cl
H-Cl
H―Cl的s-p σ键形成
Cl
Cl
Cl
Cl
Cl―Cl的p-p σ键形成
s-p σ键
p-p σ键
一、共价键
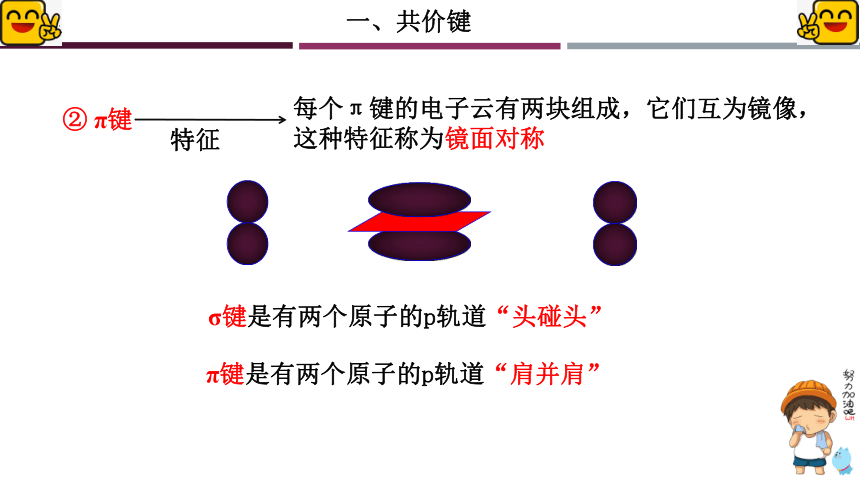
② π键
σ键是有两个原子的p轨道“头碰头”
π键是有两个原子的p轨道“肩并肩”
每个π键的电子云有两块组成,它们互为镜像,这种特征称为镜面对称
特征
一、共价键
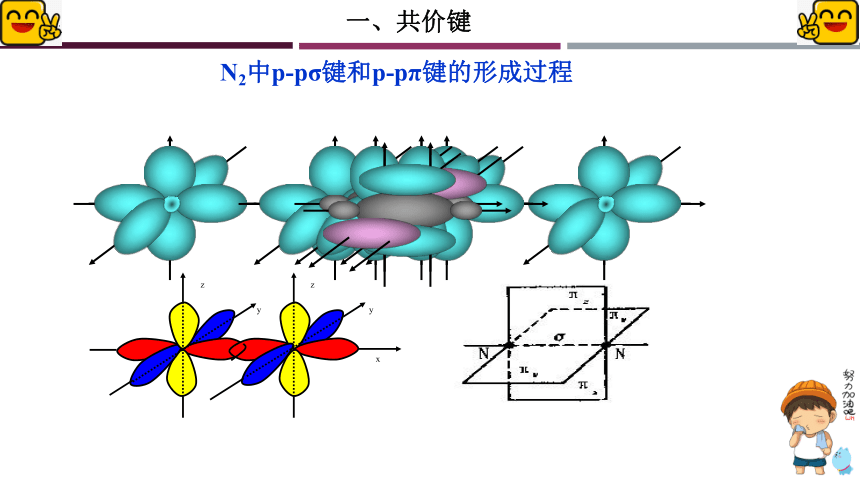
N2中p-pσ键和p-pπ键的形成过程
z
z
y
y
x
一、共价键
特别提醒
两个自旋方向相反的s电子或s电子与p电子只能形成σ键不能形成π键,而两个自旋方向相反的p电子既可形成σ键,又可形成π键,但是首先要形成σ键。因为形成σ键时原子轨道重叠的程度比形成π键时原子轨道重叠的程度大,电子在核间出现的概率大,共价键强,形成的分子更稳定。
关于如何判断是 σ键 或是 π键
规律:
共价单键是 σ键;
双键中一个σ键,另一个是 π键;
三键中一个是 σ键,另两个是π键
σ键可以单独存在;π键不能单独存在!
一、共价键
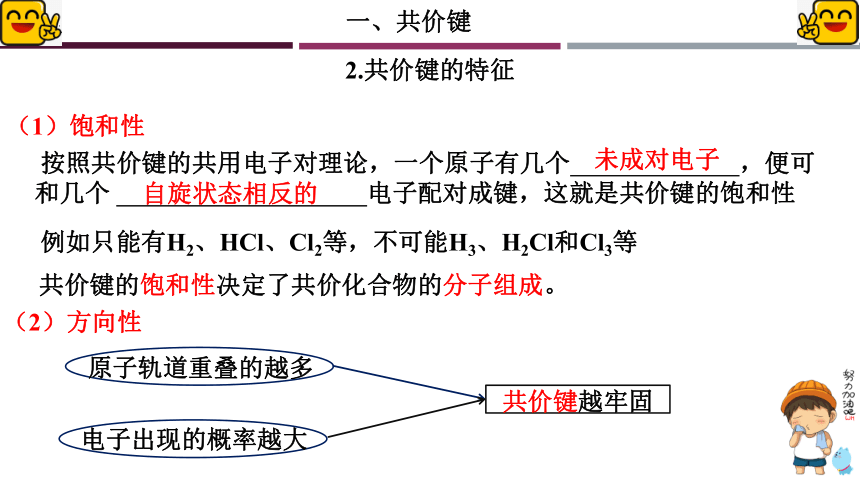
2.共价键的特征
(1)饱和性
按照共价键的共用电子对理论,一个原子有几个 ,便可和几个 电子配对成键,这就是共价键的饱和性
未成对电子
自旋状态相反的
例如只能有H2、HCl、Cl2等,不可能H3、H2Cl和Cl3等
共价键的饱和性决定了共价化合物的分子组成。
(2)方向性
原子轨道重叠的越多
电子出现的概率越大
共价键越牢固
一、共价键
头碰头;
轴对称;
形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性
肩并肩;
镜面对称;
π键不如σ键牢固
比较容易断裂;
2.共价键的特征
一、共价键
乙烷、乙烯和乙炔分子中的共价键分别有几个 σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
探究~~共价键
乙烷分子中由7个σ键组成;
2.共价键的特征
一、共价键
【思考】CO2、CO 、HCN(氢氰酸) 、苯分子中的共价键有几个σ键和几个π键组成?
注意:苯分子中含有12 个σ键和1个大π键!
CO2:含有______个σ键;______个π键;
CO:含有______个σ键;______个π键;
HCN:含有______个σ键;______个π键;
苯:含有______个σ键;______个π键;
C≡O
1
2
2
O=C=O
2
H-C≡N
2
2
12
1
对点练习
归纳:共价键的分类方法
单键、双键、三键
极性键、非极性键
σ键、π键
二、键参数
1.键能
键能指气态分子中1mol化学键解离成气态原子所吸收的能量
298.15K、101kPa条件下的标准值
共价键的强弱可用键能来衡量,键能越大,化学键越牢固,分子越稳定。
2.应用:
(1)判断分子的稳定性;
稳定性:
HF ﹥ HCl ﹥ HBr﹥HI
应用:(2)计算化学反应的反应热。
根据表中数据,计算1molH2跟1molCl2反应的反应热
Q吸=(436+242.7)kJ/mol=678.7kJ/mol
H2 + Cl2 = 2HCl
Q放= 2×428.0kJ/mol=856kJ/mol
H= (678.7- 856) kJ/mol= - 177.3kJ/mol
二、键参数
衡量共价键的强弱的另一个参数
定义:是构成化学键的两个原子的核间距
2 键长
只是振动着的原子处于平衡位置时的核间距
一般情况下,键长越短,键能越大,共价键越牢固
特殊情况
如F-F键
二、键参数
从以下数据中可以得到什么结论:
③ 相同的成键原子:单键键长 > 双键键长 >叁键键长
① 通常,键能越大,键长越短,共价键越稳定。
② 同种类型的键,成键原子半径越小,键长越短,
键能越大,键越牢固。
H-F H-Cl H-Br H-I
键长(pm) 92 128 141 161
键能(kJ/mol) 567 431 366 298
C-C C=C C C
键长(pm) 154 134 120
键能(kJ/mol) 347 598 820
二、键参数
3.键角
描述分子空间结构的重要参数
在多原子分子中,两个相邻共价键之间的夹角为键角
CO2 的结构式为 O=C=O
H2 O 的结构式为 H-O-H
180°
直线形
105°
V形(或称角形)
CH4
109°28′
二、键参数
3.键角
多原子分子的键角一定,表明共价键具有方向性
键长和键角的数值可通过晶体的X射线衍射实验获得
4 总结
键参数对分子性质的影响
二、键参数
练习 1 下列事实不能用键能的大小来解释的是( )
A.氮元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.HF比H2O稳定
B
(1)由原子半径和共用电子对数判断:成键原子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
(2)由键能判断:共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
(3)由键长判断:共价键的键长越短,共价键越牢固,破坏共价键消耗的能量越多。
(4)由电负性判断:元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键越稳定。
三 共价键强弱的判断方法
[例1]从实验测得不同物质中氧—氧之间的键长和键能数据(如下表):其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。该规律性是( )
成键时电子数越多,键能越大
键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键的电子对越偏移,键能越大
氧氧键数据 O22- O2- O2 O2+
键长/10-12m 149 128 121 112
键能(kJ·mol-1) X Y Z=494 W=628
B
当堂练习
练习 2 下列说法中正确的是( )
A.在分子中,两个原子间的距离叫键长
B.非极性键的键能大于极性键的键能
C.键能越大,表示该分子越容易受热分解
D.H—Cl的键能为431.8 kJ·mol-1,H—I的键能为298.7 kJ·mol-1,这可说明HCl分子比HI分子稳定
D
当堂练习
s的原子轨道是________形的,能层序数越大,原子轨道的________。
球
半径越大
电子在原子核外的一个空间运动状态称为一个原子轨道。
原子轨道:
知识回顾
p能级的原子轨道是________形的,每个p能级有_______个轨道,它们互相垂直,分别以_____、______、_______为符号。p原子轨道的平均半径也随能层序数增大而_____。
哑铃
3
px
py
pz
增大
知识回顾
一、共价键
H
H
H
H
用原子轨道描述氢原子形成氢分子的过程
1s1
1s1
相互靠拢
原子轨道相互重叠
形成氢分子的共价键(H-H)
① σ键
特征
s-s σ键
以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称
1.定义:
原子间通共用电子对所形成的相互作用叫做共价键。
2.本质:原子间通过共用电子对 (即原子轨道重叠)产生的强烈作用
3 分类
H
Cl
H-Cl
H―Cl的s-p σ键形成
Cl
Cl
Cl
Cl
Cl―Cl的p-p σ键形成
s-p σ键
p-p σ键
一、共价键
② π键
σ键是有两个原子的p轨道“头碰头”
π键是有两个原子的p轨道“肩并肩”
每个π键的电子云有两块组成,它们互为镜像,这种特征称为镜面对称
特征
一、共价键
N2中p-pσ键和p-pπ键的形成过程
z
z
y
y
x
一、共价键
特别提醒
两个自旋方向相反的s电子或s电子与p电子只能形成σ键不能形成π键,而两个自旋方向相反的p电子既可形成σ键,又可形成π键,但是首先要形成σ键。因为形成σ键时原子轨道重叠的程度比形成π键时原子轨道重叠的程度大,电子在核间出现的概率大,共价键强,形成的分子更稳定。
关于如何判断是 σ键 或是 π键
规律:
共价单键是 σ键;
双键中一个σ键,另一个是 π键;
三键中一个是 σ键,另两个是π键
σ键可以单独存在;π键不能单独存在!
一、共价键
2.共价键的特征
(1)饱和性
按照共价键的共用电子对理论,一个原子有几个 ,便可和几个 电子配对成键,这就是共价键的饱和性
未成对电子
自旋状态相反的
例如只能有H2、HCl、Cl2等,不可能H3、H2Cl和Cl3等
共价键的饱和性决定了共价化合物的分子组成。
(2)方向性
原子轨道重叠的越多
电子出现的概率越大
共价键越牢固
一、共价键
头碰头;
轴对称;
形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性
肩并肩;
镜面对称;
π键不如σ键牢固
比较容易断裂;
2.共价键的特征
一、共价键
乙烷、乙烯和乙炔分子中的共价键分别有几个 σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
探究~~共价键
乙烷分子中由7个σ键组成;
2.共价键的特征
一、共价键
【思考】CO2、CO 、HCN(氢氰酸) 、苯分子中的共价键有几个σ键和几个π键组成?
注意:苯分子中含有12 个σ键和1个大π键!
CO2:含有______个σ键;______个π键;
CO:含有______个σ键;______个π键;
HCN:含有______个σ键;______个π键;
苯:含有______个σ键;______个π键;
C≡O
1
2
2
O=C=O
2
H-C≡N
2
2
12
1
对点练习
归纳:共价键的分类方法
单键、双键、三键
极性键、非极性键
σ键、π键
二、键参数
1.键能
键能指气态分子中1mol化学键解离成气态原子所吸收的能量
298.15K、101kPa条件下的标准值
共价键的强弱可用键能来衡量,键能越大,化学键越牢固,分子越稳定。
2.应用:
(1)判断分子的稳定性;
稳定性:
HF ﹥ HCl ﹥ HBr﹥HI
应用:(2)计算化学反应的反应热。
根据表中数据,计算1molH2跟1molCl2反应的反应热
Q吸=(436+242.7)kJ/mol=678.7kJ/mol
H2 + Cl2 = 2HCl
Q放= 2×428.0kJ/mol=856kJ/mol
H= (678.7- 856) kJ/mol= - 177.3kJ/mol
二、键参数
衡量共价键的强弱的另一个参数
定义:是构成化学键的两个原子的核间距
2 键长
只是振动着的原子处于平衡位置时的核间距
一般情况下,键长越短,键能越大,共价键越牢固
特殊情况
如F-F键
二、键参数
从以下数据中可以得到什么结论:
③ 相同的成键原子:单键键长 > 双键键长 >叁键键长
① 通常,键能越大,键长越短,共价键越稳定。
② 同种类型的键,成键原子半径越小,键长越短,
键能越大,键越牢固。
H-F H-Cl H-Br H-I
键长(pm) 92 128 141 161
键能(kJ/mol) 567 431 366 298
C-C C=C C C
键长(pm) 154 134 120
键能(kJ/mol) 347 598 820
二、键参数
3.键角
描述分子空间结构的重要参数
在多原子分子中,两个相邻共价键之间的夹角为键角
CO2 的结构式为 O=C=O
H2 O 的结构式为 H-O-H
180°
直线形
105°
V形(或称角形)
CH4
109°28′
二、键参数
3.键角
多原子分子的键角一定,表明共价键具有方向性
键长和键角的数值可通过晶体的X射线衍射实验获得
4 总结
键参数对分子性质的影响
二、键参数
练习 1 下列事实不能用键能的大小来解释的是( )
A.氮元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.HF比H2O稳定
B
(1)由原子半径和共用电子对数判断:成键原子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
(2)由键能判断:共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
(3)由键长判断:共价键的键长越短,共价键越牢固,破坏共价键消耗的能量越多。
(4)由电负性判断:元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键越稳定。
三 共价键强弱的判断方法
[例1]从实验测得不同物质中氧—氧之间的键长和键能数据(如下表):其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。该规律性是( )
成键时电子数越多,键能越大
键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键的电子对越偏移,键能越大
氧氧键数据 O22- O2- O2 O2+
键长/10-12m 149 128 121 112
键能(kJ·mol-1) X Y Z=494 W=628
B
当堂练习
练习 2 下列说法中正确的是( )
A.在分子中,两个原子间的距离叫键长
B.非极性键的键能大于极性键的键能
C.键能越大,表示该分子越容易受热分解
D.H—Cl的键能为431.8 kJ·mol-1,H—I的键能为298.7 kJ·mol-1,这可说明HCl分子比HI分子稳定
D
当堂练习
