2.2.3.氯气的制备 课件(共13张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.3.氯气的制备 课件(共13张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 21:07:35 | ||
图片预览


文档简介
(共13张PPT)
第二节 氯及其化合物
第三课时氯气的制备
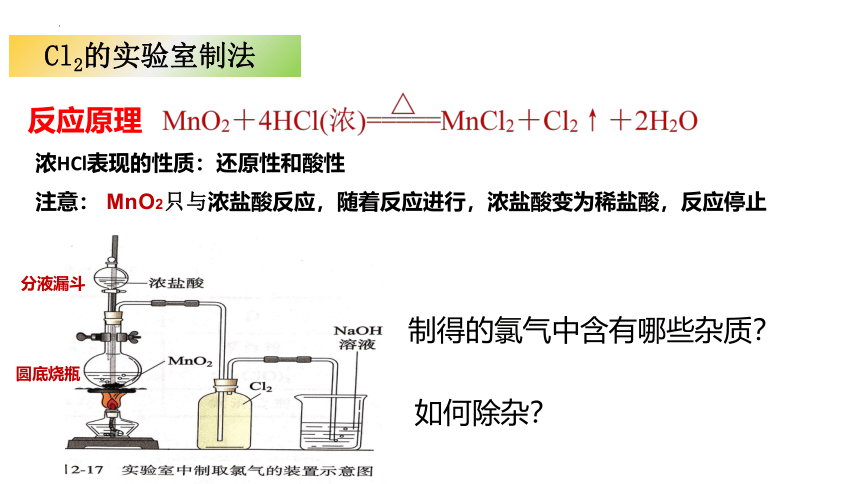
Cl2的实验室制法
舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热来发现氯气的方法至今还是实验室制取氯气的主要方法之一。
反应原理
Cl2的实验室制法
浓HCl表现的性质:还原性和酸性
注意: MnO2只与浓盐酸反应,随着反应进行,浓盐酸变为稀盐酸,反应停止
制得的氯气中含有哪些杂质?
如何除杂?
圆底烧瓶
分液漏斗
气体
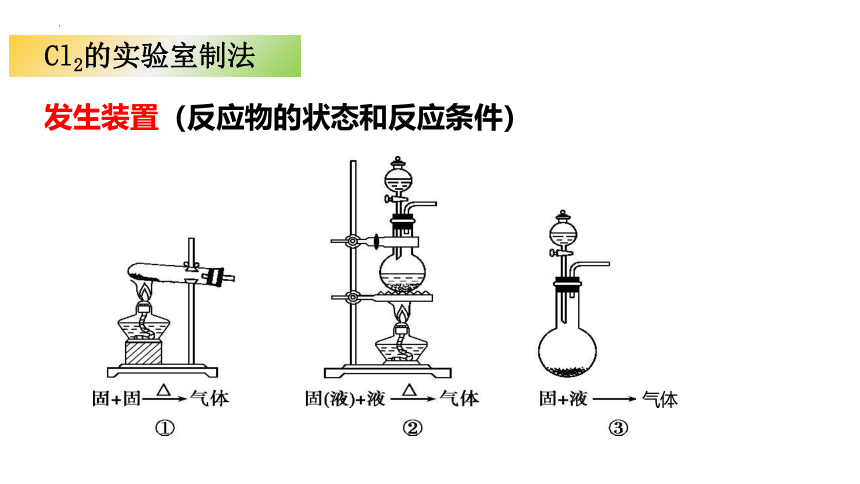
Cl2的实验室制法
发生装置(反应物的状态和反应条件)
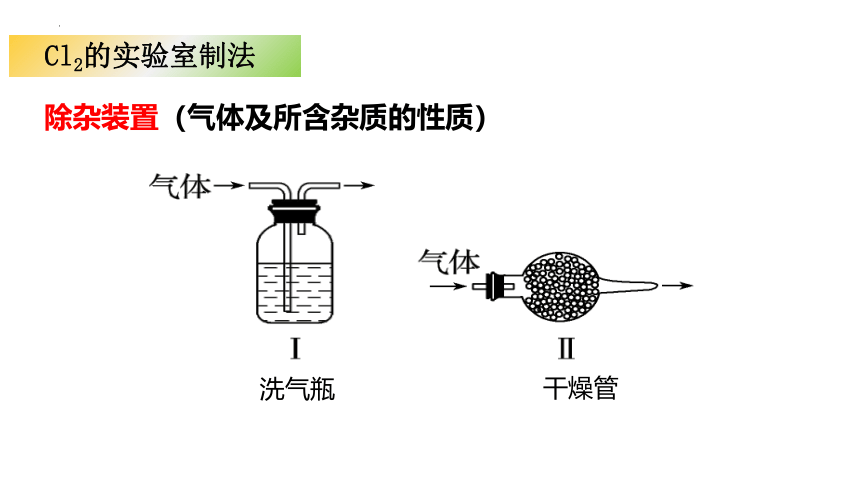
Cl2的实验室制法
除杂装置(气体及所含杂质的性质)
洗气瓶
干燥管
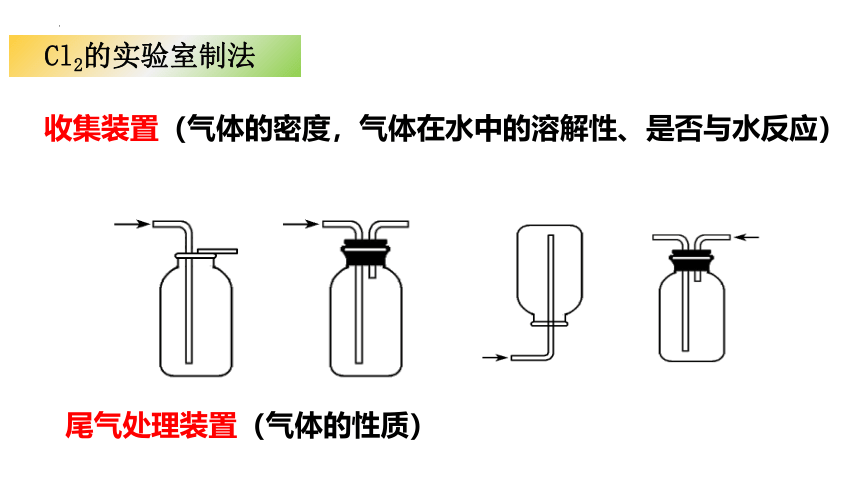
Cl2的实验室制法
收集装置(气体的密度,气体在水中的溶解性、是否与水反应)
尾气处理装置(气体的性质)
Cl2的实验室制法
发生装置:
净化装置:
饱和食盐水(除Cl2中的HCl气体)
固+ 液 气
△
饱和食盐水
Cl2的实验室制法
收集装置:
向上排空气法
(或排饱和食盐水法)
干燥装置:
浓硫酸(除Cl2中的H2O)
尾气处理:
NaOH溶液吸收
(Cl2 +2NaOH NaCl+NaClO+H2O)
浓硫酸
收集的Cl2如何检验?
(1)将湿润的淀粉KI试纸伸入集气瓶内,观察到试纸变蓝
注意
其它制法:
KMnO4 、KClO3、NaClO、K2Cr2O7、Ca(ClO)2等强氧化剂与浓盐酸反应,生成氯气
(2)将湿润的蓝色石蕊试纸伸入集气瓶内,试纸先变红最后褪色
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O
Cl2的其它制法
小组讨论:据台湾媒体报道,北县中和市锦和中学的部分学生,在清扫厕所时误以为洁厕灵(主要成分是盐酸)与漂白液混合,清洁效果会更强,结果混合后产生氯气,并冒出大量浓烟,九名学生疑似氯气吸入过多,身体不适被送往双和医院,诊治后幸无大碍。请尝试写出产生氯气的化学方程式?
2HCl+ NaClO = NaCl+H2O+ Cl2↑
课堂练习
(1)连接上述仪器的正确顺序(填各接口处的字母):___接___;___接___;___接___;___接___。
2、二氧化锰跟浓盐酸反应制备干燥纯净的氯气。
E
C
D
A
B
H
G
F
(2)装置中,饱和食盐水的作用是____________;NaOH溶液的作用是_______________。
除Cl2中的HCl
吸收过量的氯气
(3)化学实验中常用湿润的淀粉 -KI
试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应的化学方程式为___________________。
试纸变蓝
2KI+Cl2=2KCl+I2
(4)写出下列化学反应的化学方程式:
①气体发生装置中:________________________。
②NaOH溶液中:__________________________。
MnO2+4HCl(浓) MnCl2+Cl2↑
+2H2O
2NaOH+Cl2=NaCl+NaClO+H2O
浓盐酸
课堂小结
氯气的实验室制法
反应原理:MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
发生装置:固 + 固 气
△
除杂装置:饱和食盐水除HCl,浓硫酸除水蒸气
收集装置:向上排空气法、排饱和食盐水法
尾气处理:Cl2 +2NaOH NaCl+NaClO+H2O
检验:将湿润的淀粉KI试纸伸入集气瓶内,试纸变蓝;将湿润的蓝色石蕊试纸伸入集气瓶内,试纸先变红最后褪色
谢谢聆听!
第二节 氯及其化合物
第三课时氯气的制备
Cl2的实验室制法
舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热来发现氯气的方法至今还是实验室制取氯气的主要方法之一。
反应原理
Cl2的实验室制法
浓HCl表现的性质:还原性和酸性
注意: MnO2只与浓盐酸反应,随着反应进行,浓盐酸变为稀盐酸,反应停止
制得的氯气中含有哪些杂质?
如何除杂?
圆底烧瓶
分液漏斗
气体
Cl2的实验室制法
发生装置(反应物的状态和反应条件)
Cl2的实验室制法
除杂装置(气体及所含杂质的性质)
洗气瓶
干燥管
Cl2的实验室制法
收集装置(气体的密度,气体在水中的溶解性、是否与水反应)
尾气处理装置(气体的性质)
Cl2的实验室制法
发生装置:
净化装置:
饱和食盐水(除Cl2中的HCl气体)
固+ 液 气
△
饱和食盐水
Cl2的实验室制法
收集装置:
向上排空气法
(或排饱和食盐水法)
干燥装置:
浓硫酸(除Cl2中的H2O)
尾气处理:
NaOH溶液吸收
(Cl2 +2NaOH NaCl+NaClO+H2O)
浓硫酸
收集的Cl2如何检验?
(1)将湿润的淀粉KI试纸伸入集气瓶内,观察到试纸变蓝
注意
其它制法:
KMnO4 、KClO3、NaClO、K2Cr2O7、Ca(ClO)2等强氧化剂与浓盐酸反应,生成氯气
(2)将湿润的蓝色石蕊试纸伸入集气瓶内,试纸先变红最后褪色
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O
Cl2的其它制法
小组讨论:据台湾媒体报道,北县中和市锦和中学的部分学生,在清扫厕所时误以为洁厕灵(主要成分是盐酸)与漂白液混合,清洁效果会更强,结果混合后产生氯气,并冒出大量浓烟,九名学生疑似氯气吸入过多,身体不适被送往双和医院,诊治后幸无大碍。请尝试写出产生氯气的化学方程式?
2HCl+ NaClO = NaCl+H2O+ Cl2↑
课堂练习
(1)连接上述仪器的正确顺序(填各接口处的字母):___接___;___接___;___接___;___接___。
2、二氧化锰跟浓盐酸反应制备干燥纯净的氯气。
E
C
D
A
B
H
G
F
(2)装置中,饱和食盐水的作用是____________;NaOH溶液的作用是_______________。
除Cl2中的HCl
吸收过量的氯气
(3)化学实验中常用湿润的淀粉 -KI
试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应的化学方程式为___________________。
试纸变蓝
2KI+Cl2=2KCl+I2
(4)写出下列化学反应的化学方程式:
①气体发生装置中:________________________。
②NaOH溶液中:__________________________。
MnO2+4HCl(浓) MnCl2+Cl2↑
+2H2O
2NaOH+Cl2=NaCl+NaClO+H2O
浓盐酸
课堂小结
氯气的实验室制法
反应原理:MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
发生装置:固 + 固 气
△
除杂装置:饱和食盐水除HCl,浓硫酸除水蒸气
收集装置:向上排空气法、排饱和食盐水法
尾气处理:Cl2 +2NaOH NaCl+NaClO+H2O
检验:将湿润的淀粉KI试纸伸入集气瓶内,试纸变蓝;将湿润的蓝色石蕊试纸伸入集气瓶内,试纸先变红最后褪色
谢谢聆听!
