3.3.2 从海水中提取镁 从海带中提取碘 课件(共27张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.3.2 从海水中提取镁 从海带中提取碘 课件(共27张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 89.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 21:20:08 | ||
图片预览






文档简介
(共27张PPT)
3.3.2 从海水中提取镁
从海带中提取碘
一、从海水中提取镁
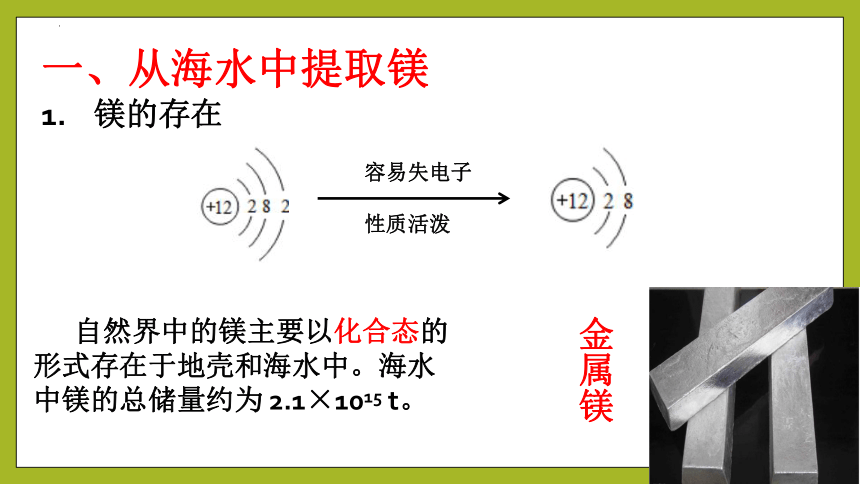
镁的存在
金属镁
自然界中的镁主要以化合态的形式存在于地壳和海水中。海水中镁的总储量约为 2.1×1015 t。
容易失电子
性质活泼
2、镁的用途
镁被称为为“国防金属”,密度较小,有良好的延展性,导电性,镁合金被广泛用于制造火箭和飞机的部件等。
镁燃烧发出耀眼的白光,可以作于制作信号弹。
氧化镁的熔点高达2800℃,是优质的耐高温材料。
思考以下问题:
1.如何把海水中的Mg2+离子分离出来?
2.我们选择什么样的沉淀剂?
将Mg2+转化为沉淀,再进行分离
沉淀剂选择成本较低的Ca(OH)2
3.直接向海水中加沉淀剂吗?
取晒盐后浓缩的苦卤
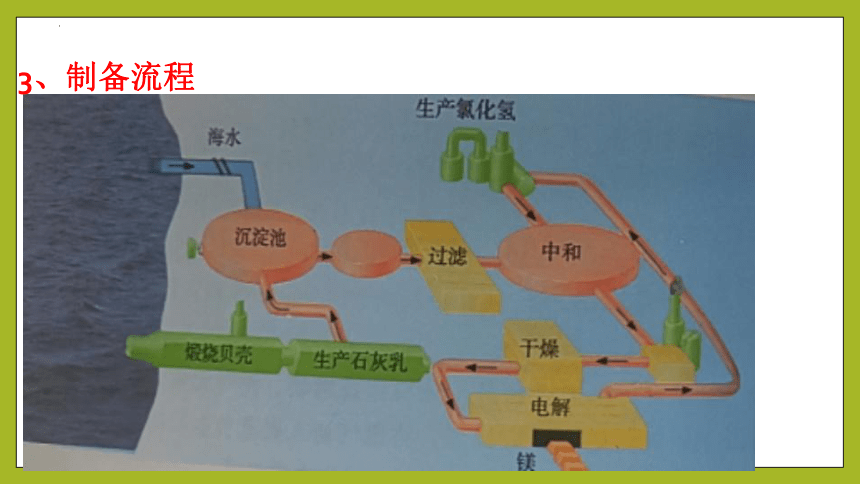
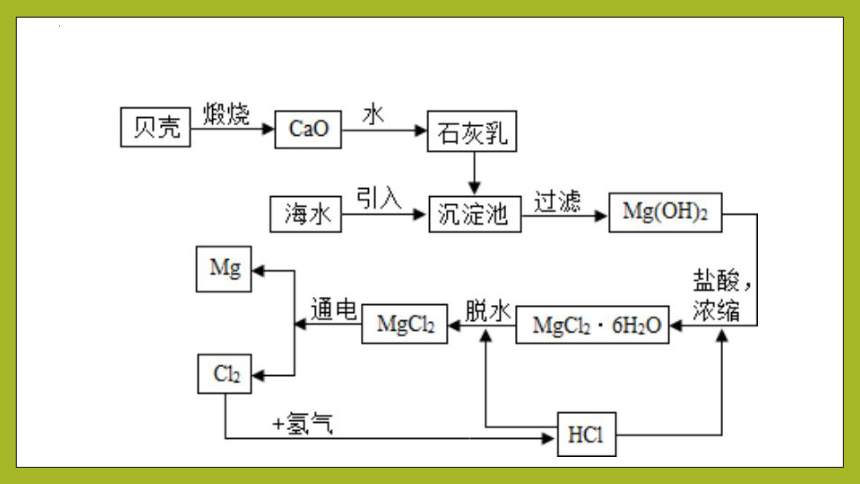
3、制备流程
(1)利用贝壳制备石灰乳
CaCO3 CaO + CO2↑ CaO + H2O == Ca(OH)2
(2) 沉淀Mg2+得到Mg(OH)2:
MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
(3) 提取无水氯化镁:
Mg(OH)2+2HCl===MgCl2+2H2O MgCl2·6H2O===MgCl2+6H2O
(4) 电解无水氯化镁制取镁:
MgCl2 Mg + Cl2↑
2Mg + O2 === 2MgO
点燃
剧烈燃烧,发出刺眼的白光,放出大量的热,产生白色物质。
MgO的熔点高达2800℃,是优质的耐高温材料。
1
与氧气反应
4、镁的化学性质
2
与水反应
Mg + 2H2O === Mg(OH)2+ H2↑
镁与冷水不反应,与热水反应,生成氢气。
3
与酸反应
Mg + 2HCl === MgCl2+ H2↑
镁与盐酸反应较剧烈。
从海水中提取镁
3Mg + N2 === Mg3N2
点燃
剧烈燃烧,产生白烟
4
与氮气反应
从海水中提取镁
5
与CO2反应
发出耀眼的白光,产生大量的白烟,有黑色物质生成。
1.碘的物理性质
颜色状态:紫黑色固体
密度:比水大。
溶解度:在水中溶解度很小;易溶于酒精、四氯化碳等有机溶剂。
熔沸点:易升华;
碘(I2)单质
碘蒸气
特性:碘(I2)能使淀粉变蓝。
二、从海带中提取碘
海带
海藻
3.碘的提取
从海带中提取碘的工业生产过程
干海带
浸泡液
滤液
粗碘
水
H2SO4溶液
过滤
浸泡
NaOH溶液
碱化
碘单质
结晶
过滤
提纯
有机物沉淀
氧化
实验室海带提碘
3.碘的用途
实验探究——加碘盐中碘元素的检验
碘在加碘盐中以IO3-的形式存在。已知在酸性条件下IO3-会和I-发生如下反应:IO3-+5I-+6H+=3I2+3H2O.
实验可选用的物质有:自来水、碘化钾淀粉试纸、白糖、白醋、白酒。
请根据以上信息,设计实验方案,检验加碘盐中碘的存在。
方法1:实验室常用硝酸银溶液和稀硝酸来检验
4、Cl-、 Br-、I-的鉴别
Cl-、Br-、I-的鉴别:
实验现象和化学方程式
NaCl溶液
NaBr溶液
NaI溶液
生成不溶于稀硝酸的白色沉淀
生成不溶于稀硝酸的淡黄色沉淀
生成不溶于稀硝酸的黄色沉淀
NaCl + AgNO3 ====AgCl ↓ + NaNO3
NaBr + AgNO3 ==== AgBr↓+ NaNO3
NaI + AgNO3 ==== AgI↓ + NaNO3
方法二:氯水和CCl4
实验体系 氯水+含Br-溶液 氯水+含I-溶液
现象
溶液变为橙黄色;
加入CCl4,
下层变橙红色。
溶液变为棕黄色;
加入CCl4
下层变紫红色
课堂小结
1. 下列有关镁的叙述正确的是 ( )
A.镁条燃烧的火灾可以用二氧化碳扑灭
B.镁不能跟水反应释放出氢气
C.镁与氮气不能反应
D.镁在空气中燃烧的产物并不全是MgO
课堂练习
D
2、海水是镁的主要来源之一,从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)燃烧成石灰;②在引有海水的渠中加入石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解获得产物。根据上述提取镁的全过程,没有涉及的反应类型是( )
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
C
3、下列说法中错误的是( )
A.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞
B.氯气,浓氯和氯水是同一种物质
C.从海水中提取溴,一般要经历浓缩,氧化和提取三个步骤,氧化剂一般选择氯气
D.向盛有碘水的试管中加入适量CCl4,振荡静置,溶液分层,上层无色下层紫红色
B
苏教版必修第一册
3.3.2 从海水中提取镁
从海带中提取碘
一、从海水中提取镁
镁的存在
金属镁
自然界中的镁主要以化合态的形式存在于地壳和海水中。海水中镁的总储量约为 2.1×1015 t。
容易失电子
性质活泼
2、镁的用途
镁被称为为“国防金属”,密度较小,有良好的延展性,导电性,镁合金被广泛用于制造火箭和飞机的部件等。
镁燃烧发出耀眼的白光,可以作于制作信号弹。
氧化镁的熔点高达2800℃,是优质的耐高温材料。
思考以下问题:
1.如何把海水中的Mg2+离子分离出来?
2.我们选择什么样的沉淀剂?
将Mg2+转化为沉淀,再进行分离
沉淀剂选择成本较低的Ca(OH)2
3.直接向海水中加沉淀剂吗?
取晒盐后浓缩的苦卤
3、制备流程
(1)利用贝壳制备石灰乳
CaCO3 CaO + CO2↑ CaO + H2O == Ca(OH)2
(2) 沉淀Mg2+得到Mg(OH)2:
MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
(3) 提取无水氯化镁:
Mg(OH)2+2HCl===MgCl2+2H2O MgCl2·6H2O===MgCl2+6H2O
(4) 电解无水氯化镁制取镁:
MgCl2 Mg + Cl2↑
2Mg + O2 === 2MgO
点燃
剧烈燃烧,发出刺眼的白光,放出大量的热,产生白色物质。
MgO的熔点高达2800℃,是优质的耐高温材料。
1
与氧气反应
4、镁的化学性质
2
与水反应
Mg + 2H2O === Mg(OH)2+ H2↑
镁与冷水不反应,与热水反应,生成氢气。
3
与酸反应
Mg + 2HCl === MgCl2+ H2↑
镁与盐酸反应较剧烈。
从海水中提取镁
3Mg + N2 === Mg3N2
点燃
剧烈燃烧,产生白烟
4
与氮气反应
从海水中提取镁
5
与CO2反应
发出耀眼的白光,产生大量的白烟,有黑色物质生成。
1.碘的物理性质
颜色状态:紫黑色固体
密度:比水大。
溶解度:在水中溶解度很小;易溶于酒精、四氯化碳等有机溶剂。
熔沸点:易升华;
碘(I2)单质
碘蒸气
特性:碘(I2)能使淀粉变蓝。
二、从海带中提取碘
海带
海藻
3.碘的提取
从海带中提取碘的工业生产过程
干海带
浸泡液
滤液
粗碘
水
H2SO4溶液
过滤
浸泡
NaOH溶液
碱化
碘单质
结晶
过滤
提纯
有机物沉淀
氧化
实验室海带提碘
3.碘的用途
实验探究——加碘盐中碘元素的检验
碘在加碘盐中以IO3-的形式存在。已知在酸性条件下IO3-会和I-发生如下反应:IO3-+5I-+6H+=3I2+3H2O.
实验可选用的物质有:自来水、碘化钾淀粉试纸、白糖、白醋、白酒。
请根据以上信息,设计实验方案,检验加碘盐中碘的存在。
方法1:实验室常用硝酸银溶液和稀硝酸来检验
4、Cl-、 Br-、I-的鉴别
Cl-、Br-、I-的鉴别:
实验现象和化学方程式
NaCl溶液
NaBr溶液
NaI溶液
生成不溶于稀硝酸的白色沉淀
生成不溶于稀硝酸的淡黄色沉淀
生成不溶于稀硝酸的黄色沉淀
NaCl + AgNO3 ====AgCl ↓ + NaNO3
NaBr + AgNO3 ==== AgBr↓+ NaNO3
NaI + AgNO3 ==== AgI↓ + NaNO3
方法二:氯水和CCl4
实验体系 氯水+含Br-溶液 氯水+含I-溶液
现象
溶液变为橙黄色;
加入CCl4,
下层变橙红色。
溶液变为棕黄色;
加入CCl4
下层变紫红色
课堂小结
1. 下列有关镁的叙述正确的是 ( )
A.镁条燃烧的火灾可以用二氧化碳扑灭
B.镁不能跟水反应释放出氢气
C.镁与氮气不能反应
D.镁在空气中燃烧的产物并不全是MgO
课堂练习
D
2、海水是镁的主要来源之一,从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)燃烧成石灰;②在引有海水的渠中加入石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解获得产物。根据上述提取镁的全过程,没有涉及的反应类型是( )
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
C
3、下列说法中错误的是( )
A.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞
B.氯气,浓氯和氯水是同一种物质
C.从海水中提取溴,一般要经历浓缩,氧化和提取三个步骤,氧化剂一般选择氯气
D.向盛有碘水的试管中加入适量CCl4,振荡静置,溶液分层,上层无色下层紫红色
B
苏教版必修第一册
