4.1.2 硫酸的工业制备 浓硫酸的性质 课件(共28张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 4.1.2 硫酸的工业制备 浓硫酸的性质 课件(共28张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 93.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 21:25:29 | ||
图片预览







文档简介
(共28张PPT)
4.1.2 硫酸的工业制备
浓硫酸的性质
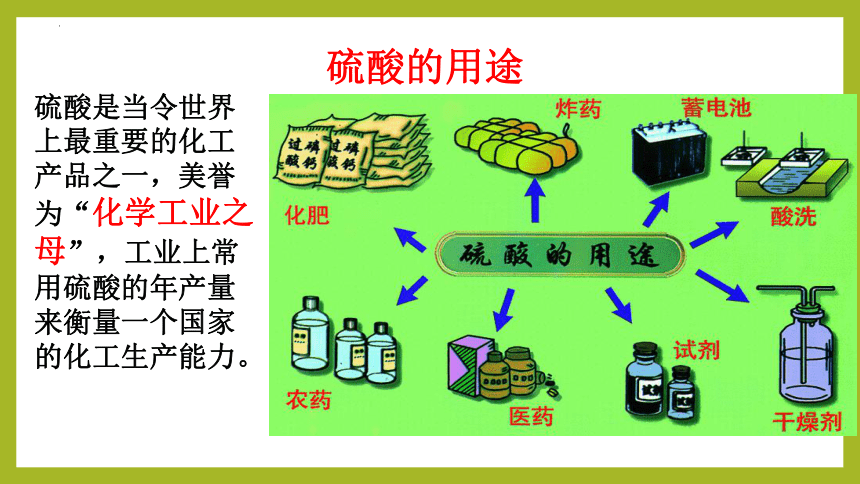
硫酸的用途
硫酸是当令世界上最重要的化工产品之一,美誉为“化学工业之母”,工业上常用硫酸的年产量来衡量一个国家的化工生产能力。
早在1000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制硫酸,如:《黄帝九鼎神丹经诀》——“炼石胆取精华法”。
硫酸的应用史
CuSO4·5H2O==CuO+SO3↑+5H2O
SO3 + H2O==H2SO4
胆矾
绿矾
2FeSO4·7H2O==Fe2O3+SO2↑+SO3↑+14 H2O
SO3+H2O==H2SO4
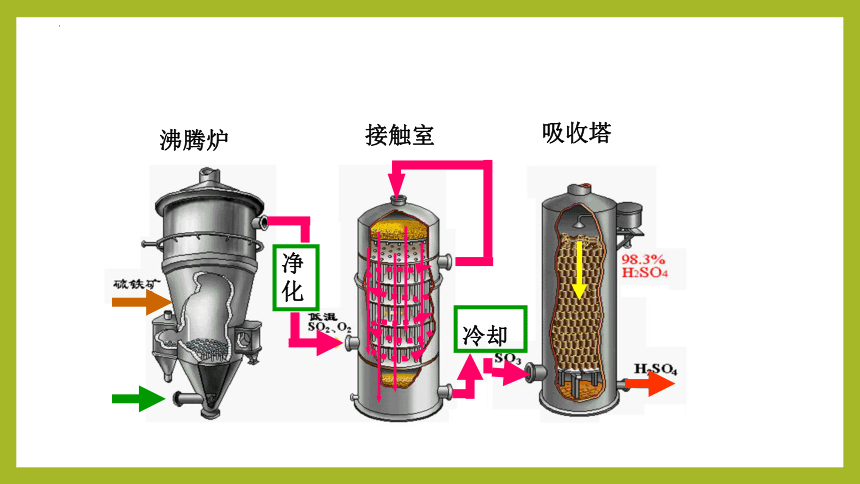
一、硫酸的工业制备——接触法
H2SO4
S
SO3
SO2
(1)
(2)
(3)
FeS2
沸腾炉
接触室
吸收塔
净化
冷却
三原料
三阶段
三设备
三反应(均放热)
硫黄或含硫矿石(硫铁矿)
空气
98.3%的浓H2SO4
造气(生成SO2)
接触氧化
(生成SO3)
SO3吸收
(生成H2SO4)
沸腾炉
接触室
吸收塔
4FeS2 + 11O2 =△= 2Fe2O3 + 8SO2
S + O2 =△= SO2
SO3+H2O===H2SO4
2SO2 + O2 2SO3
思考并回答下列问题:
(1)硫铁矿为什么要粉碎?
(2)热交换器起什么作用?
(3)为什么用98.3%的浓硫酸吸收而不用水吸收?
增加空气和硫铁矿的接触面积,加快反应速率,提高硫铁矿的利用率
反应物SO2与O2被预热,热的SO3气体被冷却,这种方式能够节约能源
SO3与H2O反应放出大量热,形成酸雾,不利于SO3的进一步吸收,
98.3%的浓硫酸吸收更完全
(1)原料廉价且稳定,降低运输成本。
(2)从环保、成本等角度选择合适的化学反应,保证在反应中能充分接触。
(3)制备流程简单高效,能耗低,反应放出的热量质尽可能加以循环利用,生副产物较少。
(4)制备过程绿色,环保,不使用或生成对环境有害的物质。
化学工业制备的要求
二、硫酸的性质
1、稀硫酸的性质(酸的通性)
1.使酸碱指示剂变色
3.与碱发生中和反应
2.与活泼金属反应生成氢气
4.与碱性氧化物反应
5.与某些盐反应(如BaCl2)
(一) 物理性质
无色
油状液体
338℃
难挥发
比水大
与水任意比混溶, 稀释时释放大量热
1.颜色:
2.状态:
3.沸点:
4.密度:
5.水溶性:
2、浓硫酸的性质
实验室常用的浓硫酸de质量分数98%, 密度1.84 g·cm-3。
稀释浓硫酸时应该如何操作
“酸入水, 沿杯壁,
慢慢注, 及时搅”
入水中, 并用玻璃棒及时搅拌。
将浓硫酸沿烧杯内壁慢慢注
正确操作:
(二)浓硫酸的特性
实验1、向表面皿中加入少量胆矾,
再加入约3mL浓硫酸,搅拌,观察实验现象。
实验现象:
蓝色的胆矾(CuSO4·5H2O)变成白色(CuSO4)
1、吸水性
实验2、取2g蔗糖,放入大试管中,加2-3滴水,再加入约3mL的浓硫酸,迅速搅拌,然后塞紧带玻璃导管的橡皮塞,将玻璃导管的另一端插入盛有品红溶液的试管中,观察实验现象。
实验现象:
①蔗糖由白变黑
②体积膨胀,形成疏松的海绵状,产生的气体能使品红和高锰酸钾褪色。
2.脱水性
浓硫酸按照水的组成比,夺取某些有机物中的氢、氧元素形成水分子,可使蔗糖、纤维素等物质脱水,这叫脱水性。
C12H22O11 12C + 11H2O
蔗糖结构
蔗糖结构
C + 2H2SO4(浓)
△
CO2↑+ 2SO2↑+2H2O
浓硫酸表现氧化性。
+6
+4
氧化剂
3、氧化性
实验结论:铜与浓硫酸在加热条件发生反应,生成硫酸铜、二氧化硫和水,浓硫酸表现强氧化性。
实验3、将一小片铜片放入试管中,然后加入2mL浓硫酸,加热,观察实验现象。
实验现象:
①铜丝表面变黑,产生气泡,有无色刺激性气体生成。
②该气体可以使品红溶液褪色。
③紫色石蕊试液变红。
④溶液变成灰黑色,停止加热后,将溶液倒入蒸馏水中,溶液变蓝。
化学反应
在总反应中浓硫酸表现氧化性和酸性。
Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
△
①Cu+H2SO4(浓)==CuO+SO2↑+H2O
②CuO +H2SO4(浓)==CuSO4+H2O
△
分步反应
氧化性
酸性
+6
+6
+4
△
0
+2
总反应:
在工业上浓硫酸都是用铁罐或铝罐来储存和运输。这是为什么?
铁、铝表面被浓硫酸氧化为致密的氧化膜,从而阻止了酸与内层金属的进一步反应。-----钝化
与金属反应
活泼金属:
较不活泼金属:浓硫酸可以与除金、铂之外的Cu、Ag、Hg等在加热条件下反应。
常温下与活泼金属反应,Fe、Al常温下遇浓硫酸发生钝化.
不生成H2,生成SO2,
思考:为什么锌与稀硫酸反应生成的是H2,与浓硫酸反应生成SO2?
Zn+H2SO4==ZnSO4+H2↑
硫酸分子
硫酸根
Zn+2H2SO4(浓)==ZnSO4+SO2↑+2H2O
课堂小结
是指浓硫酸吸收水、水蒸气或结晶水的性质。
是指浓硫酸把有机物中的氢氧元素按原子个数比2:1脱去水的性质。
吸水性和脱水性有何区别 ?
吸水性
脱水性
关键看:是否有“现成”的水。
思考:
浓硫酸能干燥所有气体吗?不能干燥哪些气体?
不能用来干燥:
碱性气体(如氨气);还原性气体(H2S、HI、HBr)
① 浓硫酸常温使纸片变黑: ;
② 浓硫酸与铜共热产生气体: ;
③ 浓硫酸使蔗糖变成“黑面包”: ;
④ 浓硫酸常温下使铁铝钝化: ;
⑤ 浓硫酸使胆矾变成白色粉末: ;
⑥ 浓硫酸与NaCl固体制HCl气体: 。
D
B E
CDE
E
C
A
A.高沸点 B. 酸性 C.吸水性 D.脱水性 E.强氧化性
1,硫酸在下列用途或现象中所表现的性质是:
2.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜晶体 B.木材炭化
C.红热木炭 D.氧化铝
3.下列关于浓硫酸的叙述不正确的是( )
A.浓硫酸能与金属、非金属单质反应,作氧化剂,被还原为二氧化硫
B.浓硫酸可将铜、汞等金属氧化,生成高价态金属的硫酸盐
C.浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸
D.浓硫酸具有强氧化性,加热时浓硫酸能将铁、铝钝化
C
D
苏教版必修第一册
4.1.2 硫酸的工业制备
浓硫酸的性质
硫酸的用途
硫酸是当令世界上最重要的化工产品之一,美誉为“化学工业之母”,工业上常用硫酸的年产量来衡量一个国家的化工生产能力。
早在1000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制硫酸,如:《黄帝九鼎神丹经诀》——“炼石胆取精华法”。
硫酸的应用史
CuSO4·5H2O==CuO+SO3↑+5H2O
SO3 + H2O==H2SO4
胆矾
绿矾
2FeSO4·7H2O==Fe2O3+SO2↑+SO3↑+14 H2O
SO3+H2O==H2SO4
一、硫酸的工业制备——接触法
H2SO4
S
SO3
SO2
(1)
(2)
(3)
FeS2
沸腾炉
接触室
吸收塔
净化
冷却
三原料
三阶段
三设备
三反应(均放热)
硫黄或含硫矿石(硫铁矿)
空气
98.3%的浓H2SO4
造气(生成SO2)
接触氧化
(生成SO3)
SO3吸收
(生成H2SO4)
沸腾炉
接触室
吸收塔
4FeS2 + 11O2 =△= 2Fe2O3 + 8SO2
S + O2 =△= SO2
SO3+H2O===H2SO4
2SO2 + O2 2SO3
思考并回答下列问题:
(1)硫铁矿为什么要粉碎?
(2)热交换器起什么作用?
(3)为什么用98.3%的浓硫酸吸收而不用水吸收?
增加空气和硫铁矿的接触面积,加快反应速率,提高硫铁矿的利用率
反应物SO2与O2被预热,热的SO3气体被冷却,这种方式能够节约能源
SO3与H2O反应放出大量热,形成酸雾,不利于SO3的进一步吸收,
98.3%的浓硫酸吸收更完全
(1)原料廉价且稳定,降低运输成本。
(2)从环保、成本等角度选择合适的化学反应,保证在反应中能充分接触。
(3)制备流程简单高效,能耗低,反应放出的热量质尽可能加以循环利用,生副产物较少。
(4)制备过程绿色,环保,不使用或生成对环境有害的物质。
化学工业制备的要求
二、硫酸的性质
1、稀硫酸的性质(酸的通性)
1.使酸碱指示剂变色
3.与碱发生中和反应
2.与活泼金属反应生成氢气
4.与碱性氧化物反应
5.与某些盐反应(如BaCl2)
(一) 物理性质
无色
油状液体
338℃
难挥发
比水大
与水任意比混溶, 稀释时释放大量热
1.颜色:
2.状态:
3.沸点:
4.密度:
5.水溶性:
2、浓硫酸的性质
实验室常用的浓硫酸de质量分数98%, 密度1.84 g·cm-3。
稀释浓硫酸时应该如何操作
“酸入水, 沿杯壁,
慢慢注, 及时搅”
入水中, 并用玻璃棒及时搅拌。
将浓硫酸沿烧杯内壁慢慢注
正确操作:
(二)浓硫酸的特性
实验1、向表面皿中加入少量胆矾,
再加入约3mL浓硫酸,搅拌,观察实验现象。
实验现象:
蓝色的胆矾(CuSO4·5H2O)变成白色(CuSO4)
1、吸水性
实验2、取2g蔗糖,放入大试管中,加2-3滴水,再加入约3mL的浓硫酸,迅速搅拌,然后塞紧带玻璃导管的橡皮塞,将玻璃导管的另一端插入盛有品红溶液的试管中,观察实验现象。
实验现象:
①蔗糖由白变黑
②体积膨胀,形成疏松的海绵状,产生的气体能使品红和高锰酸钾褪色。
2.脱水性
浓硫酸按照水的组成比,夺取某些有机物中的氢、氧元素形成水分子,可使蔗糖、纤维素等物质脱水,这叫脱水性。
C12H22O11 12C + 11H2O
蔗糖结构
蔗糖结构
C + 2H2SO4(浓)
△
CO2↑+ 2SO2↑+2H2O
浓硫酸表现氧化性。
+6
+4
氧化剂
3、氧化性
实验结论:铜与浓硫酸在加热条件发生反应,生成硫酸铜、二氧化硫和水,浓硫酸表现强氧化性。
实验3、将一小片铜片放入试管中,然后加入2mL浓硫酸,加热,观察实验现象。
实验现象:
①铜丝表面变黑,产生气泡,有无色刺激性气体生成。
②该气体可以使品红溶液褪色。
③紫色石蕊试液变红。
④溶液变成灰黑色,停止加热后,将溶液倒入蒸馏水中,溶液变蓝。
化学反应
在总反应中浓硫酸表现氧化性和酸性。
Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
△
①Cu+H2SO4(浓)==CuO+SO2↑+H2O
②CuO +H2SO4(浓)==CuSO4+H2O
△
分步反应
氧化性
酸性
+6
+6
+4
△
0
+2
总反应:
在工业上浓硫酸都是用铁罐或铝罐来储存和运输。这是为什么?
铁、铝表面被浓硫酸氧化为致密的氧化膜,从而阻止了酸与内层金属的进一步反应。-----钝化
与金属反应
活泼金属:
较不活泼金属:浓硫酸可以与除金、铂之外的Cu、Ag、Hg等在加热条件下反应。
常温下与活泼金属反应,Fe、Al常温下遇浓硫酸发生钝化.
不生成H2,生成SO2,
思考:为什么锌与稀硫酸反应生成的是H2,与浓硫酸反应生成SO2?
Zn+H2SO4==ZnSO4+H2↑
硫酸分子
硫酸根
Zn+2H2SO4(浓)==ZnSO4+SO2↑+2H2O
课堂小结
是指浓硫酸吸收水、水蒸气或结晶水的性质。
是指浓硫酸把有机物中的氢氧元素按原子个数比2:1脱去水的性质。
吸水性和脱水性有何区别 ?
吸水性
脱水性
关键看:是否有“现成”的水。
思考:
浓硫酸能干燥所有气体吗?不能干燥哪些气体?
不能用来干燥:
碱性气体(如氨气);还原性气体(H2S、HI、HBr)
① 浓硫酸常温使纸片变黑: ;
② 浓硫酸与铜共热产生气体: ;
③ 浓硫酸使蔗糖变成“黑面包”: ;
④ 浓硫酸常温下使铁铝钝化: ;
⑤ 浓硫酸使胆矾变成白色粉末: ;
⑥ 浓硫酸与NaCl固体制HCl气体: 。
D
B E
CDE
E
C
A
A.高沸点 B. 酸性 C.吸水性 D.脱水性 E.强氧化性
1,硫酸在下列用途或现象中所表现的性质是:
2.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜晶体 B.木材炭化
C.红热木炭 D.氧化铝
3.下列关于浓硫酸的叙述不正确的是( )
A.浓硫酸能与金属、非金属单质反应,作氧化剂,被还原为二氧化硫
B.浓硫酸可将铜、汞等金属氧化,生成高价态金属的硫酸盐
C.浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸
D.浓硫酸具有强氧化性,加热时浓硫酸能将铁、铝钝化
C
D
苏教版必修第一册
