3.2.2 碳酸钠的性质及应用 课件(共25张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.2.2 碳酸钠的性质及应用 课件(共25张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 63.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 21:33:00 | ||
图片预览







文档简介
(共25张PPT)
第二课时 碳酸钠 碳酸氢钠
第二单元 金属钠及钠的化合物
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
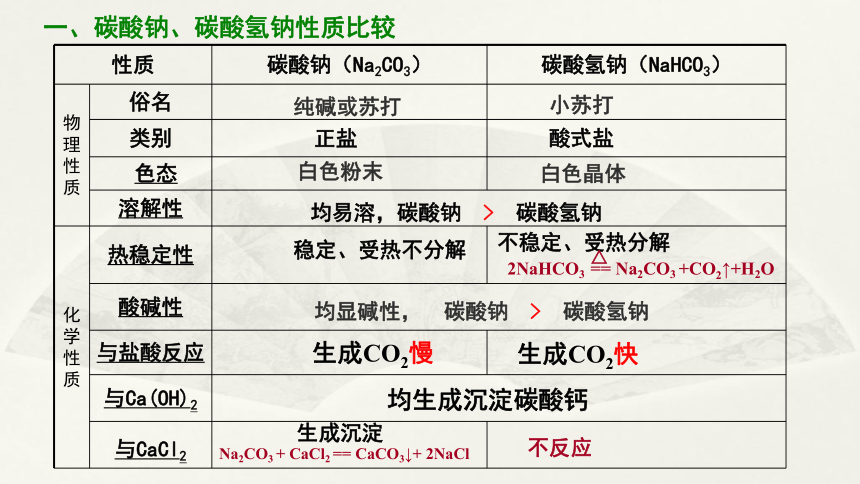
性质 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
物理性质 俗名
类别
色态
溶解性 化学性质 热稳定性
酸碱性 与盐酸反应
与Ca(OH)2 与CaCl2
纯碱或苏打
小苏打
白色粉末
白色晶体
一、碳酸钠、碳酸氢钠性质比较
正盐
酸式盐
稳定、受热不分解
不稳定、受热分解
2NaHCO3 == Na2CO3 +CO2↑+H2O
△
均显碱性, 碳酸钠 > 碳酸氢钠
Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl
不反应
生成CO2慢
生成CO2快
均易溶,碳酸钠 > 碳酸氢钠
均生成沉淀碳酸钙
生成沉淀
碳酸钠、碳酸氢钠溶解性比较
实验1:取两支试管,分别加入1gNa2CO3、NaHCO3固体,再向其中加入5mL蒸馏水,观察现象。
现象: Na2CO3完全溶解,溶解过程中放热明显,NaHCO3部分溶解
结论:碳酸钠的溶解度大于碳酸氢钠
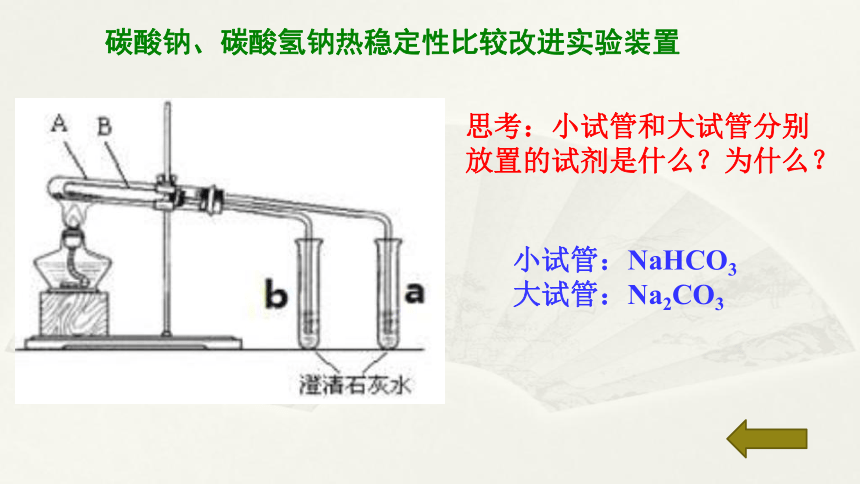
碳酸钠、碳酸氢钠热稳定性比较
实验2:分别加热Na2CO3、NaHCO3固体,并将导管末端,并观察现象
现象: Na2CO3加热后澄清石灰水无明显现象,NaHCO3粉末加热后,试管口有水珠生成澄清石灰水变浑浊。
结论:碳酸钠热稳定性好,碳酸氢钠受热易分解。
碳酸钠、碳酸氢钠热稳定性比较改进实验装置
思考:小试管和大试管分别放置的试剂是什么?为什么?
小试管:NaHCO3
大试管:Na2CO3
实验3:用酚酞试剂检验等物质的量浓度的Na2CO3、NaHCO3溶液
现象:Na2CO3溶液中滴加酚酞后红色更深。
结论:溶液均呈碱性。
碱性:Na2CO3>NaHCO3
应用:用热碳酸钠溶液洗涤油污
碳酸钠、碳酸氢钠溶液的酸碱性
Na2CO3
NaHCO3
实验4:向盛有等质量碳酸钠和碳酸氢钠粉末的试管中同时加入相同体积盐酸。
碳酸钠、碳酸氢钠与盐酸反应
第一步:Na2CO3 + HCl = NaCl+ NaHCO3
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
现象:碳酸钠产生气泡慢,碳酸氢钠产生气泡快
碳酸钠与HCl反应:
碳酸氢钠与HCl反应:
第二歩:NaHCO3 + HCl = NaCl + H2O + CO2 ↑
实验5:在两支试管中分别加入碳酸钠溶液和碳酸氢钠溶液,再滴加澄清石灰水。
碳酸钠、碳酸氢钠与Ca(OH)2的反应
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
NaHCO3 + Ca(OH)2 = CaCO3↓+NaOH+H2O
2NaHCO3 + Ca(OH)2 = CaCO3↓+Na2CO3+2H2O
现象:两溶液中均产生白色沉淀
碳酸钠、碳酸氢钠与CaCl2的反应
实验6:向等物质的量浓度的碳酸钠和碳酸氢钠溶液中滴加CaCl2溶液
现象: Na2CO3溶液产生沉淀, NaHCO3溶液无现象
结论:碳酸钠与氯化钙反应,而碳酸氢钠与氯化钙不反应
交流与讨论
实验室两瓶碳酸钠和碳酸氢钠的标签掉了,请同学们设计实验方案区分这两种固体粉末。
2NaHCO3 === Na2CO3+H2O+CO2↑
△
二. Na2CO3与NaHCO3的相互转化
Na2CO3+H2O+CO2 == 2NaHCO3
NaHCO3 +NaOH ==Na2CO3+H2O
固体:
溶液:
Na2CO3 固体(NaHCO3)
Na2CO3溶液(NaHCO3)
加热
加入适量氢氧化钠溶液
NaHCO3溶液(Na2CO3)
通入足量CO2
三. Na2CO3与NaHCO3的分离与提纯
四. Na2CO3与NaHCO3的用途
侯氏制碱法(联合制碱法)
原理:
NH3+CO2+H2O +NaCl = NaHCO3↓+NH4Cl
2NaHCO3 = Na2CO3+H2O+CO2↑
将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
侯德榜
C
课堂巩固
C
D
开始有气泡冒出,后无明显现象
有气泡产生,澄清石灰水变浑浊
先将导气管从A、B烧杯中取出,再停止加热
弱于
不能
关闭分液漏斗活塞,将导气管末端伸入盛水的烧杯中,用酒精灯稍稍加热圆底烧瓶,
若导气管末端有气泡产生,移走酒精灯后,导气管中形成一段稳定的水柱,则装置
气密性良好
实验前后碱石灰的质量
在C后再接一个盛有碱石灰的干燥管
平衡压强,便于分液漏斗中的液体顺利流下
把反应产生的气体全部赶入C中从而被碱石灰吸收
NaOH
偏低
第二课时 碳酸钠 碳酸氢钠
第二单元 金属钠及钠的化合物
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
性质 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
物理性质 俗名
类别
色态
溶解性 化学性质 热稳定性
酸碱性 与盐酸反应
与Ca(OH)2 与CaCl2
纯碱或苏打
小苏打
白色粉末
白色晶体
一、碳酸钠、碳酸氢钠性质比较
正盐
酸式盐
稳定、受热不分解
不稳定、受热分解
2NaHCO3 == Na2CO3 +CO2↑+H2O
△
均显碱性, 碳酸钠 > 碳酸氢钠
Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl
不反应
生成CO2慢
生成CO2快
均易溶,碳酸钠 > 碳酸氢钠
均生成沉淀碳酸钙
生成沉淀
碳酸钠、碳酸氢钠溶解性比较
实验1:取两支试管,分别加入1gNa2CO3、NaHCO3固体,再向其中加入5mL蒸馏水,观察现象。
现象: Na2CO3完全溶解,溶解过程中放热明显,NaHCO3部分溶解
结论:碳酸钠的溶解度大于碳酸氢钠
碳酸钠、碳酸氢钠热稳定性比较
实验2:分别加热Na2CO3、NaHCO3固体,并将导管末端,并观察现象
现象: Na2CO3加热后澄清石灰水无明显现象,NaHCO3粉末加热后,试管口有水珠生成澄清石灰水变浑浊。
结论:碳酸钠热稳定性好,碳酸氢钠受热易分解。
碳酸钠、碳酸氢钠热稳定性比较改进实验装置
思考:小试管和大试管分别放置的试剂是什么?为什么?
小试管:NaHCO3
大试管:Na2CO3
实验3:用酚酞试剂检验等物质的量浓度的Na2CO3、NaHCO3溶液
现象:Na2CO3溶液中滴加酚酞后红色更深。
结论:溶液均呈碱性。
碱性:Na2CO3>NaHCO3
应用:用热碳酸钠溶液洗涤油污
碳酸钠、碳酸氢钠溶液的酸碱性
Na2CO3
NaHCO3
实验4:向盛有等质量碳酸钠和碳酸氢钠粉末的试管中同时加入相同体积盐酸。
碳酸钠、碳酸氢钠与盐酸反应
第一步:Na2CO3 + HCl = NaCl+ NaHCO3
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
现象:碳酸钠产生气泡慢,碳酸氢钠产生气泡快
碳酸钠与HCl反应:
碳酸氢钠与HCl反应:
第二歩:NaHCO3 + HCl = NaCl + H2O + CO2 ↑
实验5:在两支试管中分别加入碳酸钠溶液和碳酸氢钠溶液,再滴加澄清石灰水。
碳酸钠、碳酸氢钠与Ca(OH)2的反应
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
NaHCO3 + Ca(OH)2 = CaCO3↓+NaOH+H2O
2NaHCO3 + Ca(OH)2 = CaCO3↓+Na2CO3+2H2O
现象:两溶液中均产生白色沉淀
碳酸钠、碳酸氢钠与CaCl2的反应
实验6:向等物质的量浓度的碳酸钠和碳酸氢钠溶液中滴加CaCl2溶液
现象: Na2CO3溶液产生沉淀, NaHCO3溶液无现象
结论:碳酸钠与氯化钙反应,而碳酸氢钠与氯化钙不反应
交流与讨论
实验室两瓶碳酸钠和碳酸氢钠的标签掉了,请同学们设计实验方案区分这两种固体粉末。
2NaHCO3 === Na2CO3+H2O+CO2↑
△
二. Na2CO3与NaHCO3的相互转化
Na2CO3+H2O+CO2 == 2NaHCO3
NaHCO3 +NaOH ==Na2CO3+H2O
固体:
溶液:
Na2CO3 固体(NaHCO3)
Na2CO3溶液(NaHCO3)
加热
加入适量氢氧化钠溶液
NaHCO3溶液(Na2CO3)
通入足量CO2
三. Na2CO3与NaHCO3的分离与提纯
四. Na2CO3与NaHCO3的用途
侯氏制碱法(联合制碱法)
原理:
NH3+CO2+H2O +NaCl = NaHCO3↓+NH4Cl
2NaHCO3 = Na2CO3+H2O+CO2↑
将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
侯德榜
C
课堂巩固
C
D
开始有气泡冒出,后无明显现象
有气泡产生,澄清石灰水变浑浊
先将导气管从A、B烧杯中取出,再停止加热
弱于
不能
关闭分液漏斗活塞,将导气管末端伸入盛水的烧杯中,用酒精灯稍稍加热圆底烧瓶,
若导气管末端有气泡产生,移走酒精灯后,导气管中形成一段稳定的水柱,则装置
气密性良好
实验前后碱石灰的质量
在C后再接一个盛有碱石灰的干燥管
平衡压强,便于分液漏斗中的液体顺利流下
把反应产生的气体全部赶入C中从而被碱石灰吸收
NaOH
偏低
