3.2.1金属钠及氧化物的性质 第一课时 课件(共19张PPT) 2022-2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.2.1金属钠及氧化物的性质 第一课时 课件(共19张PPT) 2022-2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 105.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 21:42:36 | ||
图片预览






文档简介
第二单元
第1课时 金属钠的性质与应用
学习目标
1.了解钠在自然界的存在形式及原因。
2.掌握钠的物理性质及化学性质。
3.了解钠在生活中的应用。
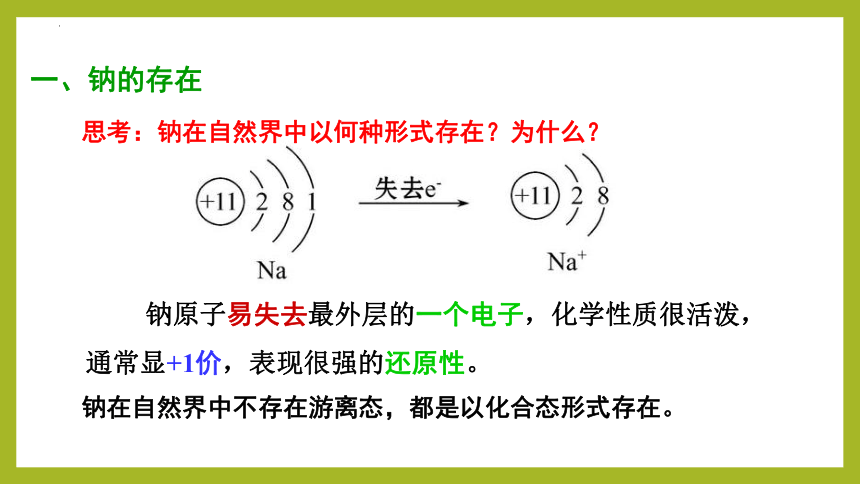
钠原子易失去最外层的一个电子,化学性质很活泼,通常显+1价,表现很强的还原性。
一、钠的存在
钠在自然界中不存在游离态,都是以化合态形式存在。
思考:钠在自然界中以何种形式存在?为什么?
初中我们探究过金属铁的性质,根据金属铁能发生的化学反应我们可以从那些方面探究钠的化学性质呢?
1.探究钠与氧气的反应
2.探究钠与酸的反应
3.探究钠能否置换其他金苏
二、钠的性质
实验1:取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察现象。
实验现象:
钠的切面失去金属光泽,表面变暗
探究一 钠与氧气的反应
实验2:将一小块金属钠放在石棉网上加热,观察现象。
① 钠块熔化
② 火焰呈黄色
③ 生成淡黄色固体
一、物理性质
颜色
状态
密度
硬度
熔点
_______
_____
比水___,比煤油___
_____
______
银白色
固体
质软
二、化学性质
1.与氧气反应:
4Na + O2 == 2Na2O
常温下
大
点燃后
2Na + O2 Na2O2
点燃
====
(淡黄色)
(白 色)
2Na + 2HCl == 2NaCl + H2↑
钠与酸反应更加剧烈
探究二、钠与酸的性质
钠的性质很活泼,那么钠是否能从水中置换出氢气呢?
实验3.钠与盐酸反应
实验4:向一只盛有水的小烧杯中滴加几滴酚酞溶液,然后投入一小块(约绿豆大小)金属钠,观察现象。
现 象
分 析 原 因
钠的密度比水小
产生气体,推动钠四处游动
产生气体的声音
溶液呈碱性
反应放热,钠的熔点低
钠浮在水面上
钠在水面上游动
发出嘶嘶响声
钠熔成闪亮小球
溶液变红
浮
熔
游
响
红
二、物理性质
颜色
状态
密度
硬度
熔点
_______
_____
比水___,比煤油___
_____
______
银白色
固体
质软
三、化学性质
1.与氧气反应:
4Na + O2 == 2Na2O
常温下
大
点燃后
2Na + O2 Na2O2
点燃
====
(淡黄色)
(白 色)
较低
2Na + 2H2O == 2NaOH + H2↑
2.与水和酸反应:
小
2Na + 2HCl == 2NaCl + H2↑
思考:钠能不能置换较不活泼的金属(如铜),如果能如何设计实验,并有什么现象呢?
钠的性质非常活泼,与金属盐溶液反应时,先与水反应生成氢氧化钠后,再与盐发生复分解反应。
探究三 钠与其他金属的置换反应
(1)与硫酸铜溶液的反应
2Na + 2H2O == 2NaOH + H2↑
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
3.与盐的反应:(先水后盐)
(2)与氯化铁溶液的反应
2Na + 2H2O == 2NaOH + H2↑
3NaOH + FeCl3 == Fe(OH)3↓+ 3NaCl
TiCl4+4Na Ti+4NaCl
700~800℃
(3)钠的置换反应(熔融态盐)
2NaCl ==== 2Na + Cl2↑
电解
电解熔融的氯化钠:
四、钠的制备
五、钠的用途
1. 冶炼稀有金属:
2. 高压钠灯:黄光射程远,透雾能力强
3. 钠钾合金:常温下是液体,用于快中子反应堆作热交换剂
TiCl4+4Na Ti+4NaCl
700~800℃
物理性质
化学性质
钠的制备
钠的用途
总 结
氧化钠和过氧化钠性质比较
{F5AB1C69-6EDB-4FF4-983F-18BD219EF322}物质
Na2O
Na2O2
类别
颜色状态
阴阳离子比
氧元素化合价
生成条件
与水反应
与CO2反应
碱性氧化物
过氧化物
白色固体
淡黄色固体
-2
1:2
1:2
-1
常温
点燃
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
练习:用双线桥标出以下化学方程式中的电子转移
第1课时 金属钠的性质与应用
学习目标
1.了解钠在自然界的存在形式及原因。
2.掌握钠的物理性质及化学性质。
3.了解钠在生活中的应用。
钠原子易失去最外层的一个电子,化学性质很活泼,通常显+1价,表现很强的还原性。
一、钠的存在
钠在自然界中不存在游离态,都是以化合态形式存在。
思考:钠在自然界中以何种形式存在?为什么?
初中我们探究过金属铁的性质,根据金属铁能发生的化学反应我们可以从那些方面探究钠的化学性质呢?
1.探究钠与氧气的反应
2.探究钠与酸的反应
3.探究钠能否置换其他金苏
二、钠的性质
实验1:取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察现象。
实验现象:
钠的切面失去金属光泽,表面变暗
探究一 钠与氧气的反应
实验2:将一小块金属钠放在石棉网上加热,观察现象。
① 钠块熔化
② 火焰呈黄色
③ 生成淡黄色固体
一、物理性质
颜色
状态
密度
硬度
熔点
_______
_____
比水___,比煤油___
_____
______
银白色
固体
质软
二、化学性质
1.与氧气反应:
4Na + O2 == 2Na2O
常温下
大
点燃后
2Na + O2 Na2O2
点燃
====
(淡黄色)
(白 色)
2Na + 2HCl == 2NaCl + H2↑
钠与酸反应更加剧烈
探究二、钠与酸的性质
钠的性质很活泼,那么钠是否能从水中置换出氢气呢?
实验3.钠与盐酸反应
实验4:向一只盛有水的小烧杯中滴加几滴酚酞溶液,然后投入一小块(约绿豆大小)金属钠,观察现象。
现 象
分 析 原 因
钠的密度比水小
产生气体,推动钠四处游动
产生气体的声音
溶液呈碱性
反应放热,钠的熔点低
钠浮在水面上
钠在水面上游动
发出嘶嘶响声
钠熔成闪亮小球
溶液变红
浮
熔
游
响
红
二、物理性质
颜色
状态
密度
硬度
熔点
_______
_____
比水___,比煤油___
_____
______
银白色
固体
质软
三、化学性质
1.与氧气反应:
4Na + O2 == 2Na2O
常温下
大
点燃后
2Na + O2 Na2O2
点燃
====
(淡黄色)
(白 色)
较低
2Na + 2H2O == 2NaOH + H2↑
2.与水和酸反应:
小
2Na + 2HCl == 2NaCl + H2↑
思考:钠能不能置换较不活泼的金属(如铜),如果能如何设计实验,并有什么现象呢?
钠的性质非常活泼,与金属盐溶液反应时,先与水反应生成氢氧化钠后,再与盐发生复分解反应。
探究三 钠与其他金属的置换反应
(1)与硫酸铜溶液的反应
2Na + 2H2O == 2NaOH + H2↑
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
3.与盐的反应:(先水后盐)
(2)与氯化铁溶液的反应
2Na + 2H2O == 2NaOH + H2↑
3NaOH + FeCl3 == Fe(OH)3↓+ 3NaCl
TiCl4+4Na Ti+4NaCl
700~800℃
(3)钠的置换反应(熔融态盐)
2NaCl ==== 2Na + Cl2↑
电解
电解熔融的氯化钠:
四、钠的制备
五、钠的用途
1. 冶炼稀有金属:
2. 高压钠灯:黄光射程远,透雾能力强
3. 钠钾合金:常温下是液体,用于快中子反应堆作热交换剂
TiCl4+4Na Ti+4NaCl
700~800℃
物理性质
化学性质
钠的制备
钠的用途
总 结
氧化钠和过氧化钠性质比较
{F5AB1C69-6EDB-4FF4-983F-18BD219EF322}物质
Na2O
Na2O2
类别
颜色状态
阴阳离子比
氧元素化合价
生成条件
与水反应
与CO2反应
碱性氧化物
过氧化物
白色固体
淡黄色固体
-2
1:2
1:2
-1
常温
点燃
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
练习:用双线桥标出以下化学方程式中的电子转移
