2.3人类对原子结构的认识 课件(共27张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.3人类对原子结构的认识 课件(共27张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-04 00:00:00 | ||
图片预览






文档简介
(共27张PPT)
苏教版必修第一册
2.3 人类对原子结构的认识
思考:
化学是一门以什么为研究对象的基础学科?
物质
准确的说,化学是研究物质的组成、结构、性质、转化及其应用的一门自然科学。
”原子“的提出
公元前5世纪,古希腊哲学家德谟克利特提出,每样东西都是由最小的部分组成的,而这最小的部分不能再分。他认为物体可以不断的切割直到其最小部分,这最小的部分称为“atomos”。atom(原子)这个单词来源于此。
人类认识原子结构的历程
道尔顿与他的“实心球”模型
1803年,英国道尔顿阐述了他的化学原子学说,主要观点有:
所有物质都是由非常微小的,不可再分的实心体即原子组成;
同种物质的原子其质量、大小和形状都相同,同元素的原子不同,主要表现为质量的不同;
原子不能被分割
人类认识原子结构的历程
汤姆逊的电子与“葡萄干面包”模型
1.汤姆逊通过阴极射线发现金属中都存在带负电荷的粒子,即“电子”。
2.用实验证明电子质量不及氢原子质量的千分之一。
3.他推测这种粒子是均匀地嵌在云状的正电荷球体中的。
人类认识原子结构的历程
卢瑟福的α衍射实验与“行星”模型
α衍射实验的结果:
1.大部分α粒子直线穿过金箔
2.少部分发生一定的偏移
3.极少数反弹回来
知识之窗:α粒子的质量是电子的7000多倍!
卢瑟福的推测:原子的内部结构并不是均匀的,而是存在一个中心的”核“,称为原子核。原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。
同时,在1920年,他预言了原子核中带有一定的中性粒子,即”中子“。1932年由他的学生查德威克验证了中子的存在。
人类认识原子结构的历程
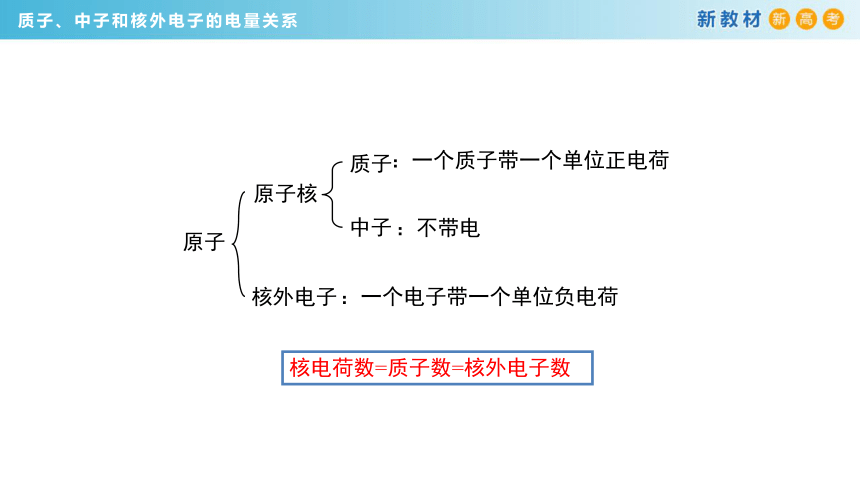
核电荷数=质子数=核外电子数
原子
原子核
核外电子
质子
中子
:一个质子带一个单位正电荷
:不带电
:一个电子带一个单位负电荷
新知讲解
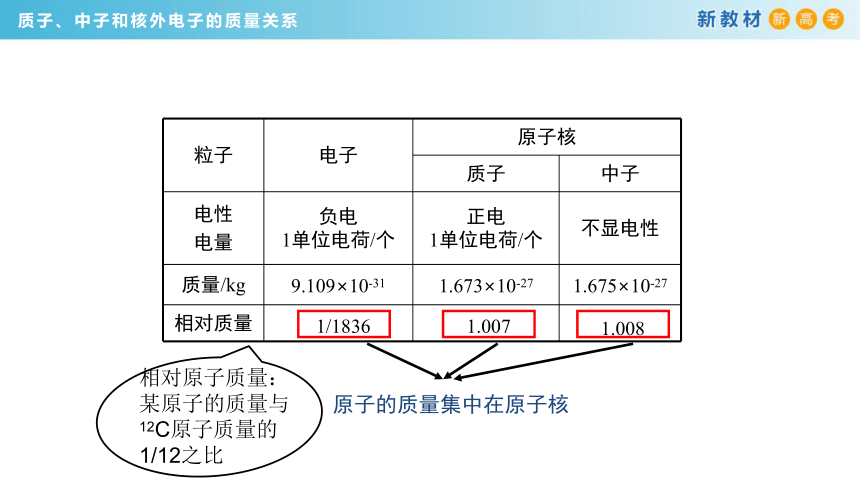
质子、中子和核外电子的电量关系
粒子 电子 原子核
质子 中子
电性 电量 负电 1单位电荷/个 正电 1单位电荷/个 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量
原子的质量集中在原子核
1/1836
1.007
1.008
相对原子质量:某原子的质量与12C原子质量的1/12之比
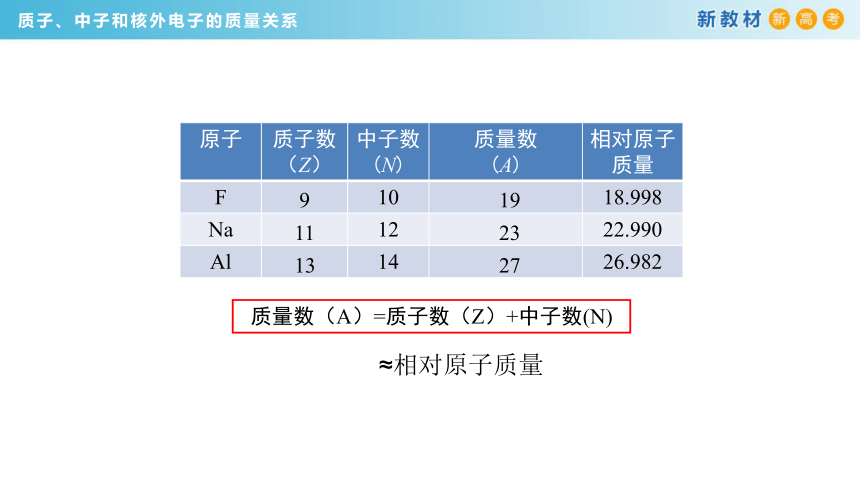
质子、中子和核外电子的质量关系
质量数(A)=质子数(Z)+中子数(N)
原子 质子数 (Z) 中子数 (N) 质量数 (A) 相对原子质量
F 10 18.998
Na 12 22.990
Al 14 26.982
9
11
13
19
23
27
新知讲解
≈相对原子质量
质子、中子和核外电子的质量关系
X表示元素符号
Z表示质子数
A表示质量数
练习:写出下列微粒的质子数、中子数、电子数、质量数。
新知讲解
原子的表示
ZX
A
核素的定义
具有一定质子数和一定中子数的一种原子称为一种核素。
质子数 中子数 电子数 质量数
1 0 1 1
1 1 1 2
1 2 1 3
6 6 6 12
6 7 6 13
6 8 6 14
同位素的定义
在元素周期表中的位置?
同位素:质子数相同、质量数(或中子数)不同的核素互称为同位素。
核电荷数
质子
中子
质子数
中子数
小结
1、正误判断
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )
(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同( )
(4)中子数不同而质子数相同的微粒一定互为同位素( )
(5)通过化学变化可以实现16O与18O间的相互转化( )
√
√
×
×
×
不同核素之间的转化属于核反应,不属于化学反应!
课堂练习
波尔的量子论结构模型——原子结构示意图的来源
卢瑟福的学生、丹麦物理学家玻尔将诞生不久的量子论运用到原子结构模型中。
他提出:原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不吸收能量,也不放出能量;当电子从较高轨道落到较低轨道时才产生辐射。
人类认识原子结构的历程
核外电子是在一系列稳定轨道上运动的,每个轨道的能量都是确定的
各电子层由内向外,能量依次递增
电子层数用序数 n 表示,依次为1、2、3、4、6、7...分别称为K、L、M、N、O、P、Q…电子层
核外电子层的排布
(1) 核外电子总是尽量先排布在能量最低的电子层,然后由内向外依次排布。
核外电子排布规律
能量规律
(1) 原子核外各电子层最多容纳2n2个电子(n表示电子层数)。
数量规律
(2) 原子最外层电子数目不能超过8个(K层不能超过2个)。
稀有气体元素的原子核外电子排布
元素 各电子层的电子数
K L M N O P
2He 2
10Ne 2 8
18Ar 2 8 8
36Kr 2 8 18 8
54Xe 2 8 18 18 8
86Rn 2 8 18 32 18 8
结构决定性质:稀有气体化学性质稳定——
稀有气体元素原子中最外层电子都已经填满,形成了稳定的电子层结构。
(3) 次外层电子数目不能超过18个(第一层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
镁离子的形成
Mg
Mg2+
氧离子的形成
失去2e-
O2-
得到2e-
O
Mg2+
+12
2 8
O2-
+8
2
8
MgO
氧化镁的形成
新知讲解
1.活泼金属元素原子,最外层电子数较少,与活泼非金属反应时,易失电子,形成稳定的电子层结构。表现正化合价。
2.活泼非金属元素的原子,最外层电子数较多,与活泼金属反应时,易得电子,形成稳定的电子层结构。表现负化合价。
故事仍在继续......
拓展延伸:至今已知的最小微粒——夸克
课后作业:名校学案32-34页,校本作业35-36页。
3、铁-60同位素的现身,揭秘了超新星爆炸历史真相。下列说法中正确的是( )
A.铁元素的质量数为60
D
1、现有下列9种微粒:11H、12H、613C、614C、714N、2656Fe2+、2656Fe3+、816O2、816O3。按要求完成以下各题:
(1)11H、12H、13H分别是氢元素的一种________,它们互称为________。
(2)2656Fe2+的中子数为________,核外电子数为__________。
(3)上述9种微粒中有________种核素,含有________种元素。
课堂练习
苏教版必修第一册
苏教版必修第一册
2.3 人类对原子结构的认识
思考:
化学是一门以什么为研究对象的基础学科?
物质
准确的说,化学是研究物质的组成、结构、性质、转化及其应用的一门自然科学。
”原子“的提出
公元前5世纪,古希腊哲学家德谟克利特提出,每样东西都是由最小的部分组成的,而这最小的部分不能再分。他认为物体可以不断的切割直到其最小部分,这最小的部分称为“atomos”。atom(原子)这个单词来源于此。
人类认识原子结构的历程
道尔顿与他的“实心球”模型
1803年,英国道尔顿阐述了他的化学原子学说,主要观点有:
所有物质都是由非常微小的,不可再分的实心体即原子组成;
同种物质的原子其质量、大小和形状都相同,同元素的原子不同,主要表现为质量的不同;
原子不能被分割
人类认识原子结构的历程
汤姆逊的电子与“葡萄干面包”模型
1.汤姆逊通过阴极射线发现金属中都存在带负电荷的粒子,即“电子”。
2.用实验证明电子质量不及氢原子质量的千分之一。
3.他推测这种粒子是均匀地嵌在云状的正电荷球体中的。
人类认识原子结构的历程
卢瑟福的α衍射实验与“行星”模型
α衍射实验的结果:
1.大部分α粒子直线穿过金箔
2.少部分发生一定的偏移
3.极少数反弹回来
知识之窗:α粒子的质量是电子的7000多倍!
卢瑟福的推测:原子的内部结构并不是均匀的,而是存在一个中心的”核“,称为原子核。原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。
同时,在1920年,他预言了原子核中带有一定的中性粒子,即”中子“。1932年由他的学生查德威克验证了中子的存在。
人类认识原子结构的历程
核电荷数=质子数=核外电子数
原子
原子核
核外电子
质子
中子
:一个质子带一个单位正电荷
:不带电
:一个电子带一个单位负电荷
新知讲解
质子、中子和核外电子的电量关系
粒子 电子 原子核
质子 中子
电性 电量 负电 1单位电荷/个 正电 1单位电荷/个 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量
原子的质量集中在原子核
1/1836
1.007
1.008
相对原子质量:某原子的质量与12C原子质量的1/12之比
质子、中子和核外电子的质量关系
质量数(A)=质子数(Z)+中子数(N)
原子 质子数 (Z) 中子数 (N) 质量数 (A) 相对原子质量
F 10 18.998
Na 12 22.990
Al 14 26.982
9
11
13
19
23
27
新知讲解
≈相对原子质量
质子、中子和核外电子的质量关系
X表示元素符号
Z表示质子数
A表示质量数
练习:写出下列微粒的质子数、中子数、电子数、质量数。
新知讲解
原子的表示
ZX
A
核素的定义
具有一定质子数和一定中子数的一种原子称为一种核素。
质子数 中子数 电子数 质量数
1 0 1 1
1 1 1 2
1 2 1 3
6 6 6 12
6 7 6 13
6 8 6 14
同位素的定义
在元素周期表中的位置?
同位素:质子数相同、质量数(或中子数)不同的核素互称为同位素。
核电荷数
质子
中子
质子数
中子数
小结
1、正误判断
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )
(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同( )
(4)中子数不同而质子数相同的微粒一定互为同位素( )
(5)通过化学变化可以实现16O与18O间的相互转化( )
√
√
×
×
×
不同核素之间的转化属于核反应,不属于化学反应!
课堂练习
波尔的量子论结构模型——原子结构示意图的来源
卢瑟福的学生、丹麦物理学家玻尔将诞生不久的量子论运用到原子结构模型中。
他提出:原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不吸收能量,也不放出能量;当电子从较高轨道落到较低轨道时才产生辐射。
人类认识原子结构的历程
核外电子是在一系列稳定轨道上运动的,每个轨道的能量都是确定的
各电子层由内向外,能量依次递增
电子层数用序数 n 表示,依次为1、2、3、4、6、7...分别称为K、L、M、N、O、P、Q…电子层
核外电子层的排布
(1) 核外电子总是尽量先排布在能量最低的电子层,然后由内向外依次排布。
核外电子排布规律
能量规律
(1) 原子核外各电子层最多容纳2n2个电子(n表示电子层数)。
数量规律
(2) 原子最外层电子数目不能超过8个(K层不能超过2个)。
稀有气体元素的原子核外电子排布
元素 各电子层的电子数
K L M N O P
2He 2
10Ne 2 8
18Ar 2 8 8
36Kr 2 8 18 8
54Xe 2 8 18 18 8
86Rn 2 8 18 32 18 8
结构决定性质:稀有气体化学性质稳定——
稀有气体元素原子中最外层电子都已经填满,形成了稳定的电子层结构。
(3) 次外层电子数目不能超过18个(第一层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
镁离子的形成
Mg
Mg2+
氧离子的形成
失去2e-
O2-
得到2e-
O
Mg2+
+12
2 8
O2-
+8
2
8
MgO
氧化镁的形成
新知讲解
1.活泼金属元素原子,最外层电子数较少,与活泼非金属反应时,易失电子,形成稳定的电子层结构。表现正化合价。
2.活泼非金属元素的原子,最外层电子数较多,与活泼金属反应时,易得电子,形成稳定的电子层结构。表现负化合价。
故事仍在继续......
拓展延伸:至今已知的最小微粒——夸克
课后作业:名校学案32-34页,校本作业35-36页。
3、铁-60同位素的现身,揭秘了超新星爆炸历史真相。下列说法中正确的是( )
A.铁元素的质量数为60
D
1、现有下列9种微粒:11H、12H、613C、614C、714N、2656Fe2+、2656Fe3+、816O2、816O3。按要求完成以下各题:
(1)11H、12H、13H分别是氢元素的一种________,它们互称为________。
(2)2656Fe2+的中子数为________,核外电子数为__________。
(3)上述9种微粒中有________种核素,含有________种元素。
课堂练习
苏教版必修第一册
