人教版(2019) 选择性必修1 第三章 水溶液中的离子反应与平衡 酸碱中和滴定(共23张PPT)
文档属性
| 名称 | 人教版(2019) 选择性必修1 第三章 水溶液中的离子反应与平衡 酸碱中和滴定(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 13.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-05 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
酸碱中和滴定
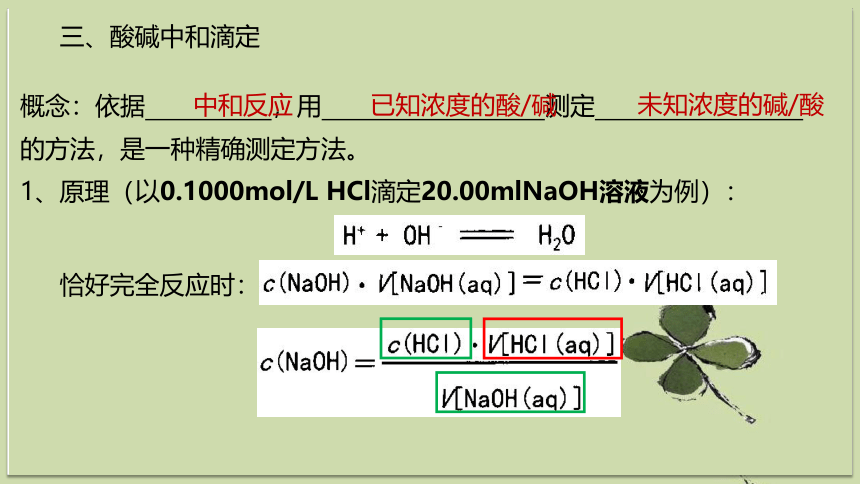
三、酸碱中和滴定
概念:依据 ,用 测定
的方法,是一种精确测定方法。
中和反应
已知浓度的酸/碱
未知浓度的碱/酸
1、原理(以0.1000mol/L HCl滴定20.00mlNaOH溶液为例):
恰好完全反应时:
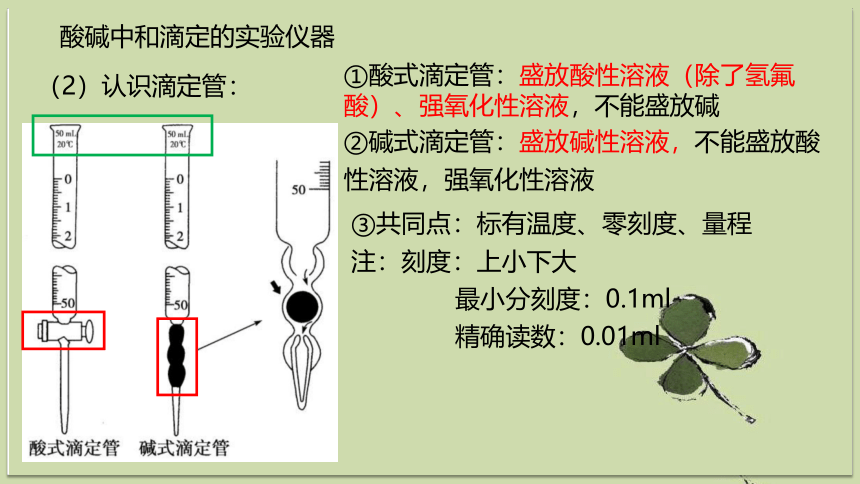
酸碱中和滴定的实验仪器
(1)主要仪器:滴定管、滴定管夹、铁架台、锥形瓶、烧杯等
2、操作
酸碱中和滴定的实验仪器
(2)认识滴定管:
①酸式滴定管:盛放酸性溶液(除了氢氟酸)、强氧化性溶液,不能盛放碱
②碱式滴定管:盛放碱性溶液,不能盛放酸性溶液,强氧化性溶液
③共同点:标有温度、零刻度、量程
注:刻度:上小下大
最小分刻度:0.1ml
精确读数:0.01ml
酸碱中和滴定的实验仪器
(2)滴定管的使用:
①检漏:观察活塞或橡胶管处是否漏水
不润洗碱式滴定管(装待测液):氢氧化钠溶液浓度偏小
,若漏水,则更换
②水洗:用清水洗涤滴定管2-3次
③润洗:用待盛装的液体洗涤2-3次
以0.1000mol/L HCl滴定NaOH溶液为例
不润洗酸式滴定管(装已知液):氢氧化钠溶液浓度偏大
④注液:将溶液加入相应滴定管中,页面位于0刻度以上2-3cm处
目的:调液面
酸碱中和滴定的实验仪器
(3)滴定管的使用:
⑤排气泡:酸式滴定管:迅速旋开活塞冲走气泡然后迅速关闭活塞
碱式滴定管:把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,
使溶液从尖嘴快速喷出
以0.1000mol/L HCl滴定NaOH溶液为例
碱式滴定管不排气泡(装待测液):氢氧化钠溶液浓度偏小
酸式滴定管不排气泡(装待测液):氢氧化钠溶液浓度偏大
⑥调节起始液面:使得起始液面位于0刻度或0刻度以下
酸碱中和滴定的实验仪器
2、滴定管的使用:
以0.1000mol/L HCl滴定NaOH溶液为例
⑦读数:视线与凹液面最低处相平
实验操作
滴定准备:
①滴定管:检漏、水洗、润洗、注液、排气泡
以0.1000mol/L HCl滴定20.00mlNaOH溶液为例
②锥形瓶:水洗、装入一定体积的待测液
【思考】锥形瓶是否需要润洗?
不需要,润洗锥形瓶导致测得的浓度偏大
③读取酸式滴定管的初始体积
【思考】如何确定反应达到终点?
使用适当的指示剂
,加入指示剂
注:锥形瓶不需要润洗
反应终点(滴定终点)的确定
3、指示剂
①酸碱指示剂
粉红色
无色
红色
——— 8.2 ——— 10.0 ———
——— 3.1 ——— 4.4 ———
甲基橙
酚 酞
红色 橙色
黄色
石蕊
②指示剂选择原则⑴滴定终点时颜色变化要明显,指示剂变色范围要窄(不用石蕊)
⑵指示剂变色范围尽量接近终点时溶液的pH。
酚 酞 甲基橙
强碱滴定强酸
强酸滴定强碱
红色→无色
橙色→黄色
无色→浅红色
黄色→橙色
强酸滴定弱碱:
强碱滴定弱酸:
滴定终点为酸性,选酸性范围内变色甲基橙
滴定终点为碱性,选碱性范围内变色的酚酞
③滴定终点的判断:当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。
4、计算
滴定
终点判断:当滴入最后一滴标准液时,刚好使锥形瓶中的溶液变色,且在半分钟内不变色,即到滴定终点。读数并记录。
滴速:先快后慢,当接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
控制滴定管胶头滴管
强酸滴定弱碱:
强碱滴定弱酸:
滴定终点为酸性,选酸性范围内变色甲基橙
滴定终点为碱性,选碱性范围内变色的酚酞
③滴定终点的判断:当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。
4、计算
4、中和滴定曲线
向20.00mL 0.10mol/L HCl中滴加0.10mol/L NaOH溶液过程中,溶液的pH变化如下,你发现了什么现象与规律?
问题1:滴定终点消耗碱多少 PH等于多少
问题2:滴定终点时多一滴和少一滴溶液的PH发生怎样改变
0.04 mL约1滴
pH=10
pH=3.9
在NaOH体积为20mL时pH出现突变
强碱滴定强酸
反应终点
加入NaOH(ml)
突变范围
pH
酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以较小的误差指示出滴定终点的到达。
颜色突变范围
指示剂选择
PH
12
10
8
6
4
2
10
20
30
40
0
7
酚 酞
8
10
颜色突变范围
7
PH
12
10
8
6
4
2
10
20
30
40
0
甲基橙
3.1
4.4
指示剂选择
原理:在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
强碱滴定强酸
强酸滴定强碱
酸碱中和滴定实验的误差分析
酸碱中和滴定实验的误差分析
c(HCl) 和 V[NaOH(aq)] 均为定值
c(HCl)
·V[HCl(aq)]
c (NaOH)
=
V[NaOH(aq)]
误差分析
c待测的误差主要来自 V[HCl(aq)]
在定量分析中,实验误差是客观存在的,所以需要对所得的数据进行处理和评价
酸碱中和滴定实验的误差分析
V标准
c待测
(1)洗涤
酸式滴定管未用标准溶液润洗
碱式滴定管未用标准溶液润洗
变大
偏高
变小
偏低
锥形瓶留有蒸馏水
不变
无影响
误差分析
放碱液(待测液)的滴定管开始有气泡,放液后气泡消失
变小
偏低
(2)取液
c(HCl)
·V[HCl(aq)]
c (NaOH)
=
V[NaOH(aq)]
锥形瓶用待测夜润洗
变大
变大
酸碱中和滴定实验的误差分析
(4)读数
滴定前仰视读数,滴定后俯视读数
变小
偏低
滴定前俯视读数,滴定后仰视读数
变大
偏高
(3)滴定
酸式滴定管滴定前有气泡,终点时气泡消失
变大
偏高
V标准
c待测
误差分析
振荡锥形瓶有液体溅出
变小
变小
1、下列关于酸碱中和滴定的叙述中,正确的是( )
A.进行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗
B.滴定前应排除尖嘴部分的气泡
C.滴定结束时仰视标准液读数会使测定结果偏小
D.锥形瓶内溶液颜色突变说明到达滴定终点
B
2、用NaOH标准溶液滴定未知浓度的盐酸(盐酸放置于锥形瓶),若测定结果偏低,原因可能是( )
A.锥形瓶洗净后残留少量蒸馏水
B.滴定前滴定管内有气泡,滴定后气泡消失
C.滴定过程中锥形瓶中溶液变色后立即停止滴定
D.标准液读数时,滴定前俯视,滴定后仰视
C
酸碱中和滴定
三、酸碱中和滴定
概念:依据 ,用 测定
的方法,是一种精确测定方法。
中和反应
已知浓度的酸/碱
未知浓度的碱/酸
1、原理(以0.1000mol/L HCl滴定20.00mlNaOH溶液为例):
恰好完全反应时:
酸碱中和滴定的实验仪器
(1)主要仪器:滴定管、滴定管夹、铁架台、锥形瓶、烧杯等
2、操作
酸碱中和滴定的实验仪器
(2)认识滴定管:
①酸式滴定管:盛放酸性溶液(除了氢氟酸)、强氧化性溶液,不能盛放碱
②碱式滴定管:盛放碱性溶液,不能盛放酸性溶液,强氧化性溶液
③共同点:标有温度、零刻度、量程
注:刻度:上小下大
最小分刻度:0.1ml
精确读数:0.01ml
酸碱中和滴定的实验仪器
(2)滴定管的使用:
①检漏:观察活塞或橡胶管处是否漏水
不润洗碱式滴定管(装待测液):氢氧化钠溶液浓度偏小
,若漏水,则更换
②水洗:用清水洗涤滴定管2-3次
③润洗:用待盛装的液体洗涤2-3次
以0.1000mol/L HCl滴定NaOH溶液为例
不润洗酸式滴定管(装已知液):氢氧化钠溶液浓度偏大
④注液:将溶液加入相应滴定管中,页面位于0刻度以上2-3cm处
目的:调液面
酸碱中和滴定的实验仪器
(3)滴定管的使用:
⑤排气泡:酸式滴定管:迅速旋开活塞冲走气泡然后迅速关闭活塞
碱式滴定管:把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,
使溶液从尖嘴快速喷出
以0.1000mol/L HCl滴定NaOH溶液为例
碱式滴定管不排气泡(装待测液):氢氧化钠溶液浓度偏小
酸式滴定管不排气泡(装待测液):氢氧化钠溶液浓度偏大
⑥调节起始液面:使得起始液面位于0刻度或0刻度以下
酸碱中和滴定的实验仪器
2、滴定管的使用:
以0.1000mol/L HCl滴定NaOH溶液为例
⑦读数:视线与凹液面最低处相平
实验操作
滴定准备:
①滴定管:检漏、水洗、润洗、注液、排气泡
以0.1000mol/L HCl滴定20.00mlNaOH溶液为例
②锥形瓶:水洗、装入一定体积的待测液
【思考】锥形瓶是否需要润洗?
不需要,润洗锥形瓶导致测得的浓度偏大
③读取酸式滴定管的初始体积
【思考】如何确定反应达到终点?
使用适当的指示剂
,加入指示剂
注:锥形瓶不需要润洗
反应终点(滴定终点)的确定
3、指示剂
①酸碱指示剂
粉红色
无色
红色
——— 8.2 ——— 10.0 ———
——— 3.1 ——— 4.4 ———
甲基橙
酚 酞
红色 橙色
黄色
石蕊
②指示剂选择原则⑴滴定终点时颜色变化要明显,指示剂变色范围要窄(不用石蕊)
⑵指示剂变色范围尽量接近终点时溶液的pH。
酚 酞 甲基橙
强碱滴定强酸
强酸滴定强碱
红色→无色
橙色→黄色
无色→浅红色
黄色→橙色
强酸滴定弱碱:
强碱滴定弱酸:
滴定终点为酸性,选酸性范围内变色甲基橙
滴定终点为碱性,选碱性范围内变色的酚酞
③滴定终点的判断:当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。
4、计算
滴定
终点判断:当滴入最后一滴标准液时,刚好使锥形瓶中的溶液变色,且在半分钟内不变色,即到滴定终点。读数并记录。
滴速:先快后慢,当接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
控制滴定管胶头滴管
强酸滴定弱碱:
强碱滴定弱酸:
滴定终点为酸性,选酸性范围内变色甲基橙
滴定终点为碱性,选碱性范围内变色的酚酞
③滴定终点的判断:当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。
4、计算
4、中和滴定曲线
向20.00mL 0.10mol/L HCl中滴加0.10mol/L NaOH溶液过程中,溶液的pH变化如下,你发现了什么现象与规律?
问题1:滴定终点消耗碱多少 PH等于多少
问题2:滴定终点时多一滴和少一滴溶液的PH发生怎样改变
0.04 mL约1滴
pH=10
pH=3.9
在NaOH体积为20mL时pH出现突变
强碱滴定强酸
反应终点
加入NaOH(ml)
突变范围
pH
酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以较小的误差指示出滴定终点的到达。
颜色突变范围
指示剂选择
PH
12
10
8
6
4
2
10
20
30
40
0
7
酚 酞
8
10
颜色突变范围
7
PH
12
10
8
6
4
2
10
20
30
40
0
甲基橙
3.1
4.4
指示剂选择
原理:在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
强碱滴定强酸
强酸滴定强碱
酸碱中和滴定实验的误差分析
酸碱中和滴定实验的误差分析
c(HCl) 和 V[NaOH(aq)] 均为定值
c(HCl)
·V[HCl(aq)]
c (NaOH)
=
V[NaOH(aq)]
误差分析
c待测的误差主要来自 V[HCl(aq)]
在定量分析中,实验误差是客观存在的,所以需要对所得的数据进行处理和评价
酸碱中和滴定实验的误差分析
V标准
c待测
(1)洗涤
酸式滴定管未用标准溶液润洗
碱式滴定管未用标准溶液润洗
变大
偏高
变小
偏低
锥形瓶留有蒸馏水
不变
无影响
误差分析
放碱液(待测液)的滴定管开始有气泡,放液后气泡消失
变小
偏低
(2)取液
c(HCl)
·V[HCl(aq)]
c (NaOH)
=
V[NaOH(aq)]
锥形瓶用待测夜润洗
变大
变大
酸碱中和滴定实验的误差分析
(4)读数
滴定前仰视读数,滴定后俯视读数
变小
偏低
滴定前俯视读数,滴定后仰视读数
变大
偏高
(3)滴定
酸式滴定管滴定前有气泡,终点时气泡消失
变大
偏高
V标准
c待测
误差分析
振荡锥形瓶有液体溅出
变小
变小
1、下列关于酸碱中和滴定的叙述中,正确的是( )
A.进行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗
B.滴定前应排除尖嘴部分的气泡
C.滴定结束时仰视标准液读数会使测定结果偏小
D.锥形瓶内溶液颜色突变说明到达滴定终点
B
2、用NaOH标准溶液滴定未知浓度的盐酸(盐酸放置于锥形瓶),若测定结果偏低,原因可能是( )
A.锥形瓶洗净后残留少量蒸馏水
B.滴定前滴定管内有气泡,滴定后气泡消失
C.滴定过程中锥形瓶中溶液变色后立即停止滴定
D.标准液读数时,滴定前俯视,滴定后仰视
C
