化学人教版(2019)选择性必修2 2.3.1 共价键和分子的极性(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.1 共价键和分子的极性(共31张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-05 16:17:43 | ||
图片预览





文档简介
(共31张PPT)
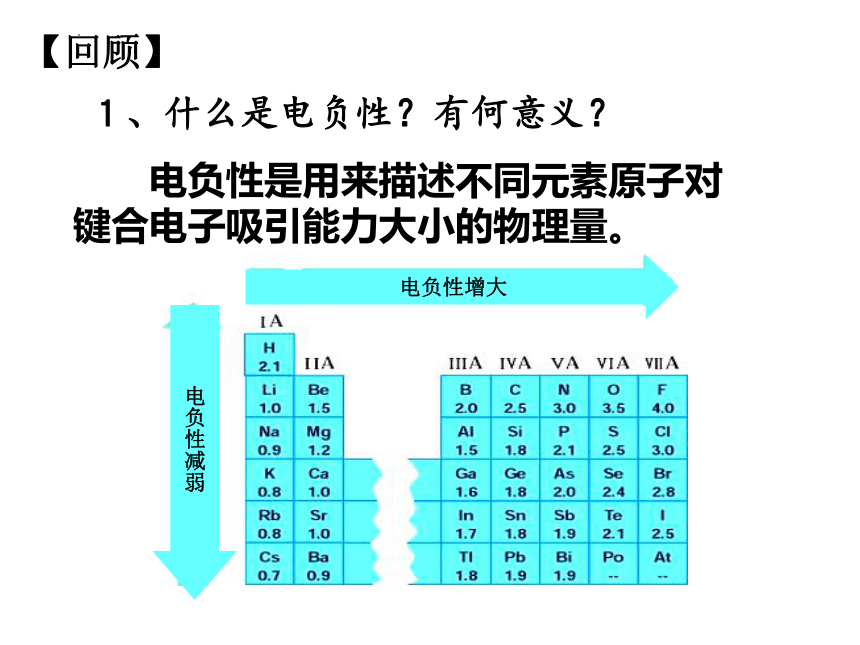
1、什么是电负性?有何意义?
电负性是用来描述不同元素原子对键合电子吸引能力大小的物理量。
电负性增大
电负性减弱
【回顾】
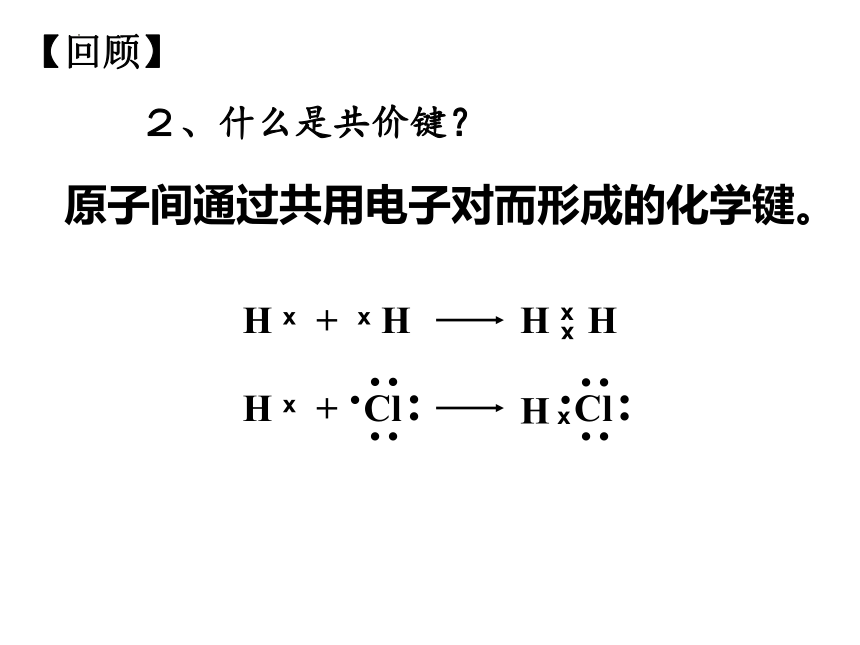
2、什么是共价键?
原子间通过共用电子对而形成的化学键。
+
Cl
H
Cl
x
H
x
+
H
x
H
x
H
x
x
H
【回顾】
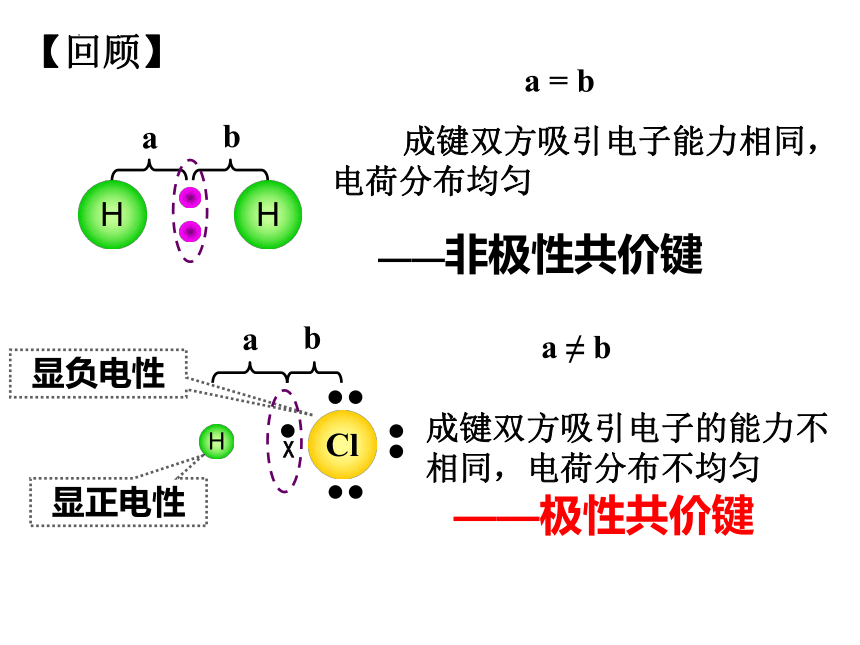
成键双方吸引电子能力相同,电荷分布均匀
——非极性共价键
成键双方吸引电子的能力不相同,电荷分布不均匀
——极性共价键
H
H
a
b
a = b
a ≠ b
显正电性
显负电性
H
Cl
X
a
b
【回顾】
第三节
分子结构与物质的性质
一、共价键的极性
第二章 分子结构与性质
非极性键
极性键
成键原子
同种元素的原子
不同种元素的原子
举例
H—H、C=C、
N≡N等
H-Cl、N-H 、
B-F等
成键原子电性
原子对电子对的吸引能力
共用电子对位置
相同
不同
不偏向任何一个原子
偏向电负性大的原子
不显电性
显电性
1、非极性共价键:
同种元素的原子形成的共价键
2、极性共价键:
不同种元素的原子形成的共价键
成键元素电负性差异越大,极性越强
一、共价键的极性
1.下列物质中,含有非极性共价键的化合物是( )
A. Na2O2 B. Cl2 C. Na2SO4 D. HI
2.下列共价键中,极性最强的是( )
A. H-F B. H-Cl C. H-Br D. H-I
A
A
【练习】
二、分子的极性
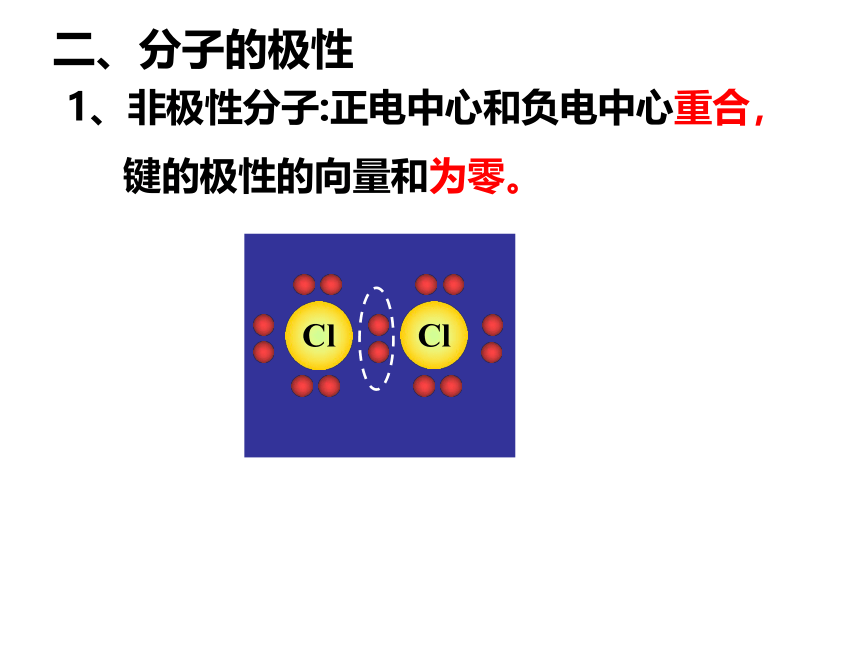
1、非极性分子:正电中心和负电中心重合,
键的极性的向量和为零。
Cl
Cl
二、分子的极性
δ-
δ
+
H
O
H
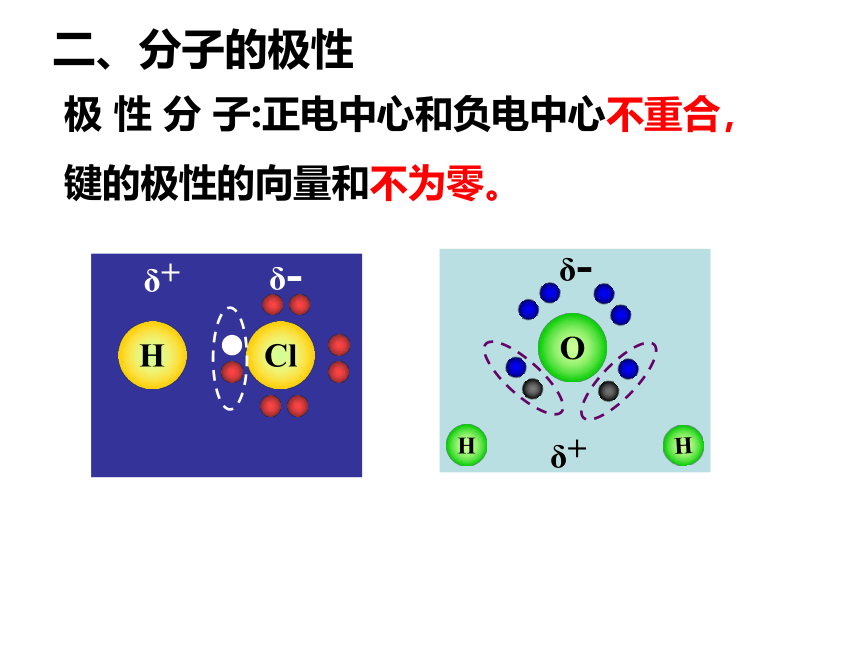
极 性 分 子:正电中心和负电中心不重合,
键的极性的向量和不为零。
H
Cl
δ-
δ
+
常见的极性分子和非极性分子
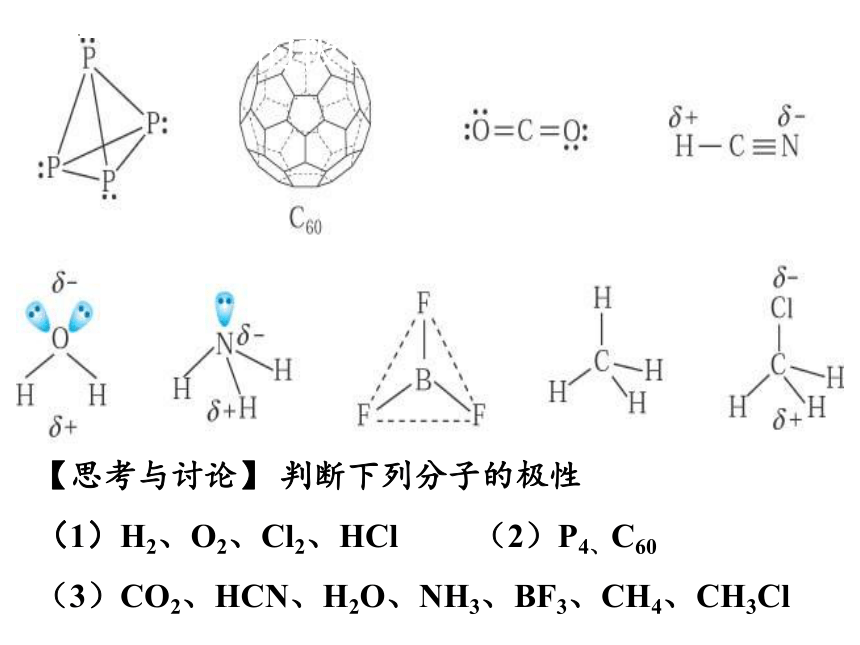
【思考与讨论】 判断下列分子的极性
(1)H2、O2、Cl2、HCl (2)P4、C60
(3)CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
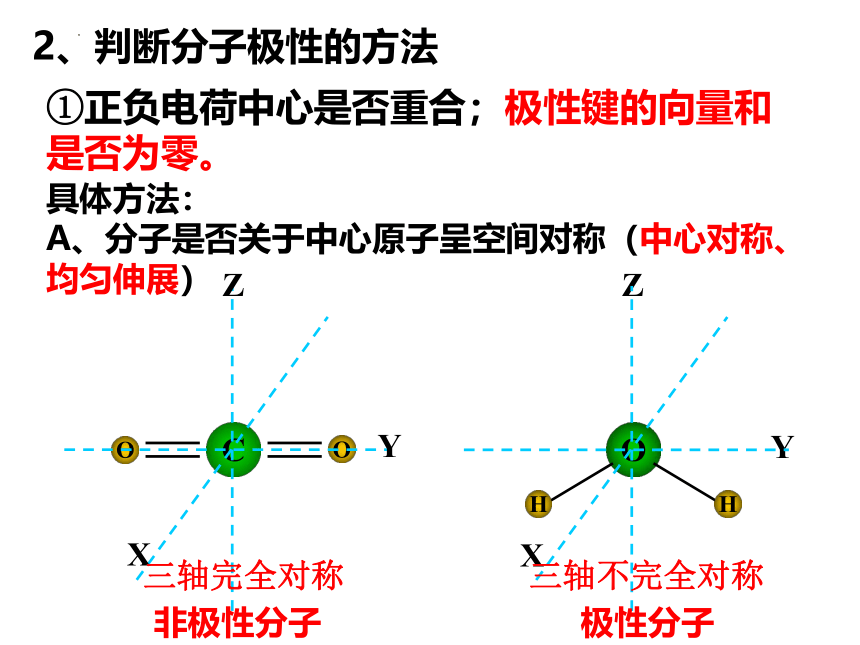
2、判断分子极性的方法
①正负电荷中心是否重合;极性键的向量和是否为零。
具体方法:
A、分子是否关于中心原子呈空间对称(中心对称、均匀伸展)
C
O
O
O
H
H
X
Y
Z
X
Y
Z
三轴完全对称
三轴不完全对称
非极性分子
极性分子
具体方法:
B、分中心原子所受合力是否为零(我们把ABn型分子中,A-B键看成是A、B原子间的相互作用力,从力的角度分析,根据中心原子A所受合力是否为零来判断)
C
O
O
O
H
H
F1
F2
合力为0,为非极性分子
合力不为0,为极性分子
F1
F2
②ABn型分子常用判断方法:
B.中心原子有无孤对电子
有——极性分子 (NH3 )
无——非极性分子(BF3)
A.中心原子化合价的绝对值是否等于价电子数
等于—— 非极性分子(SO3)
不等于---极性分子(SO2)
【思考】分析下列各分子中心元素化合价,寻找中心元素化合价与分子极性的关系。
BeCl2、SO2、NH3、BF3、CH4
非
非
非
极
极
分子的极性与哪些因素有关?
3、分子的极性不仅与化学键的极性有关,还与分子的立体结构(即键的空间位置)有关。
【思考】
常见分子构型分析:
双原子分子
AA型
AB型
常见分子构型分析:
三原子分子
H2O
CO2
常见分子构型分析:
四原子分子
NH3
BF3
常见分子构型分析:
五原子分子
CH4
1、分子有极性与非极性之分,下列对于极性分子和非极性分子的认识,其中正确的是( )
A、只含非极性键的分子一定是非极性分子
B、含有极性键的分子一定是极性分子
C、非极性分子中一定含有非极性键
D、极性分子中一定含有极性键
AD
【练习】
2、你认为CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的是( )
A. CH4、NH3、H2O、HF
C. H2O、HF 、 CH4、NH3
B. HF 、 H2O、 NH3、CH4
D. HF 、 H2O、 CH4 、 NH3
B
3、下列各组物质中,都是有极性键构成极性分子的一组是( )
A、CH4 和 Br2
B、NH3 和 H2O
C、H2S 和 CCl4
D、CO2 和 HCl
B
【资料卡片】 臭氧是极性分子 P53
O3是极性分子;臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
等电子原理
SO2
O
O
O
δ
+
δ-
δ-
科学·技术·社会——表面活性剂
表面活性剂:是指由亲水的极性基团和亲油的非极性
基团组成的,能改变表面性质的化合物。
单分子膜,降低水的表面张力
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的。
由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团,所以,双分子膜以头向外而尾向内的方式排列。
练习4.回答下列问题。
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2
⑦CH2==CH2 ⑧HCN ⑨H2O ⑩NH3 BF3
CH4 SO3 CH3Cl Ar H2O2
(1)只含非极性键的是_________(填序号,下同);只含极性键的是____ _______ ____,既含极性键又含非极性键的是______。
(2)属于非极性分子的是______________________,属于极性分子的是_____________。
①②④⑤
③⑥⑧⑨⑩
⑦
①②④⑤⑥⑦
③⑧⑨⑩
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=-lg Ka)的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?
酸性:三氟乙酸>三氯乙酸
原因:氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
2.甲酸和乙酸哪个酸性强?原因是什么?
酸性:甲酸>乙酸
原因:烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
练习5、试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
答案 ①>②>③>④>⑤>⑥
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
1.键的极性对物质的化学性质有重要影响
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
三、键的极性对化学性质影响
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=-lg Ka)的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2.规律:羧酸的酸性强弱与分子组成和结构的关系
(1)含卤素原子的一元羧酸的酸性(越多越强越酸)
①含相同个数的不同卤素原子的羧酸:
卤素原子的电负性数值越大,酸性越强。
②含不同数目的同种卤素原子的羧酸:
卤素原子的数目越多,羧酸的酸性越强。
(2)只含烃基的一元羧酸的酸性:烃基含碳原子越多(碳链越长)、推电子效应越强的酸性越弱。
随着烃基加长,酸性的差异越来越小。
(3)只含烃基的多元羧酸的酸性:
烃基所含碳原子数越少,羧基个数越多,酸性越强。
【小结】
只含非极性键——非极性分子
含极性键
立体结构呈空间对称
——非极性分子
立体结构呈空间不对称
——极性分子
科学·技术·社会
——分子结构修饰与分子的性质 P55
蔗糖与三氯蔗糖
布洛芬的成酯修饰
1、什么是电负性?有何意义?
电负性是用来描述不同元素原子对键合电子吸引能力大小的物理量。
电负性增大
电负性减弱
【回顾】
2、什么是共价键?
原子间通过共用电子对而形成的化学键。
+
Cl
H
Cl
x
H
x
+
H
x
H
x
H
x
x
H
【回顾】
成键双方吸引电子能力相同,电荷分布均匀
——非极性共价键
成键双方吸引电子的能力不相同,电荷分布不均匀
——极性共价键
H
H
a
b
a = b
a ≠ b
显正电性
显负电性
H
Cl
X
a
b
【回顾】
第三节
分子结构与物质的性质
一、共价键的极性
第二章 分子结构与性质
非极性键
极性键
成键原子
同种元素的原子
不同种元素的原子
举例
H—H、C=C、
N≡N等
H-Cl、N-H 、
B-F等
成键原子电性
原子对电子对的吸引能力
共用电子对位置
相同
不同
不偏向任何一个原子
偏向电负性大的原子
不显电性
显电性
1、非极性共价键:
同种元素的原子形成的共价键
2、极性共价键:
不同种元素的原子形成的共价键
成键元素电负性差异越大,极性越强
一、共价键的极性
1.下列物质中,含有非极性共价键的化合物是( )
A. Na2O2 B. Cl2 C. Na2SO4 D. HI
2.下列共价键中,极性最强的是( )
A. H-F B. H-Cl C. H-Br D. H-I
A
A
【练习】
二、分子的极性
1、非极性分子:正电中心和负电中心重合,
键的极性的向量和为零。
Cl
Cl
二、分子的极性
δ-
δ
+
H
O
H
极 性 分 子:正电中心和负电中心不重合,
键的极性的向量和不为零。
H
Cl
δ-
δ
+
常见的极性分子和非极性分子
【思考与讨论】 判断下列分子的极性
(1)H2、O2、Cl2、HCl (2)P4、C60
(3)CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
2、判断分子极性的方法
①正负电荷中心是否重合;极性键的向量和是否为零。
具体方法:
A、分子是否关于中心原子呈空间对称(中心对称、均匀伸展)
C
O
O
O
H
H
X
Y
Z
X
Y
Z
三轴完全对称
三轴不完全对称
非极性分子
极性分子
具体方法:
B、分中心原子所受合力是否为零(我们把ABn型分子中,A-B键看成是A、B原子间的相互作用力,从力的角度分析,根据中心原子A所受合力是否为零来判断)
C
O
O
O
H
H
F1
F2
合力为0,为非极性分子
合力不为0,为极性分子
F1
F2
②ABn型分子常用判断方法:
B.中心原子有无孤对电子
有——极性分子 (NH3 )
无——非极性分子(BF3)
A.中心原子化合价的绝对值是否等于价电子数
等于—— 非极性分子(SO3)
不等于---极性分子(SO2)
【思考】分析下列各分子中心元素化合价,寻找中心元素化合价与分子极性的关系。
BeCl2、SO2、NH3、BF3、CH4
非
非
非
极
极
分子的极性与哪些因素有关?
3、分子的极性不仅与化学键的极性有关,还与分子的立体结构(即键的空间位置)有关。
【思考】
常见分子构型分析:
双原子分子
AA型
AB型
常见分子构型分析:
三原子分子
H2O
CO2
常见分子构型分析:
四原子分子
NH3
BF3
常见分子构型分析:
五原子分子
CH4
1、分子有极性与非极性之分,下列对于极性分子和非极性分子的认识,其中正确的是( )
A、只含非极性键的分子一定是非极性分子
B、含有极性键的分子一定是极性分子
C、非极性分子中一定含有非极性键
D、极性分子中一定含有极性键
AD
【练习】
2、你认为CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的是( )
A. CH4、NH3、H2O、HF
C. H2O、HF 、 CH4、NH3
B. HF 、 H2O、 NH3、CH4
D. HF 、 H2O、 CH4 、 NH3
B
3、下列各组物质中,都是有极性键构成极性分子的一组是( )
A、CH4 和 Br2
B、NH3 和 H2O
C、H2S 和 CCl4
D、CO2 和 HCl
B
【资料卡片】 臭氧是极性分子 P53
O3是极性分子;臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
等电子原理
SO2
O
O
O
δ
+
δ-
δ-
科学·技术·社会——表面活性剂
表面活性剂:是指由亲水的极性基团和亲油的非极性
基团组成的,能改变表面性质的化合物。
单分子膜,降低水的表面张力
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的。
由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团,所以,双分子膜以头向外而尾向内的方式排列。
练习4.回答下列问题。
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2
⑦CH2==CH2 ⑧HCN ⑨H2O ⑩NH3 BF3
CH4 SO3 CH3Cl Ar H2O2
(1)只含非极性键的是_________(填序号,下同);只含极性键的是____ _______ ____,既含极性键又含非极性键的是______。
(2)属于非极性分子的是______________________,属于极性分子的是_____________。
①②④⑤
③⑥⑧⑨⑩
⑦
①②④⑤⑥⑦
③⑧⑨⑩
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=-lg Ka)的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?
酸性:三氟乙酸>三氯乙酸
原因:氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
2.甲酸和乙酸哪个酸性强?原因是什么?
酸性:甲酸>乙酸
原因:烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
练习5、试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
答案 ①>②>③>④>⑤>⑥
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
1.键的极性对物质的化学性质有重要影响
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
三、键的极性对化学性质影响
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=-lg Ka)的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2.规律:羧酸的酸性强弱与分子组成和结构的关系
(1)含卤素原子的一元羧酸的酸性(越多越强越酸)
①含相同个数的不同卤素原子的羧酸:
卤素原子的电负性数值越大,酸性越强。
②含不同数目的同种卤素原子的羧酸:
卤素原子的数目越多,羧酸的酸性越强。
(2)只含烃基的一元羧酸的酸性:烃基含碳原子越多(碳链越长)、推电子效应越强的酸性越弱。
随着烃基加长,酸性的差异越来越小。
(3)只含烃基的多元羧酸的酸性:
烃基所含碳原子数越少,羧基个数越多,酸性越强。
【小结】
只含非极性键——非极性分子
含极性键
立体结构呈空间对称
——非极性分子
立体结构呈空间不对称
——极性分子
科学·技术·社会
——分子结构修饰与分子的性质 P55
蔗糖与三氯蔗糖
布洛芬的成酯修饰
