化学人教版(2019)选择性必修1 4.1.2.原电池的应用(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.2.原电池的应用(共26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-05 11:09:27 | ||
图片预览





文档简介
(共26张PPT)
第四章 化学反应与电能
第一节 原电池
第二课时 原电池应用
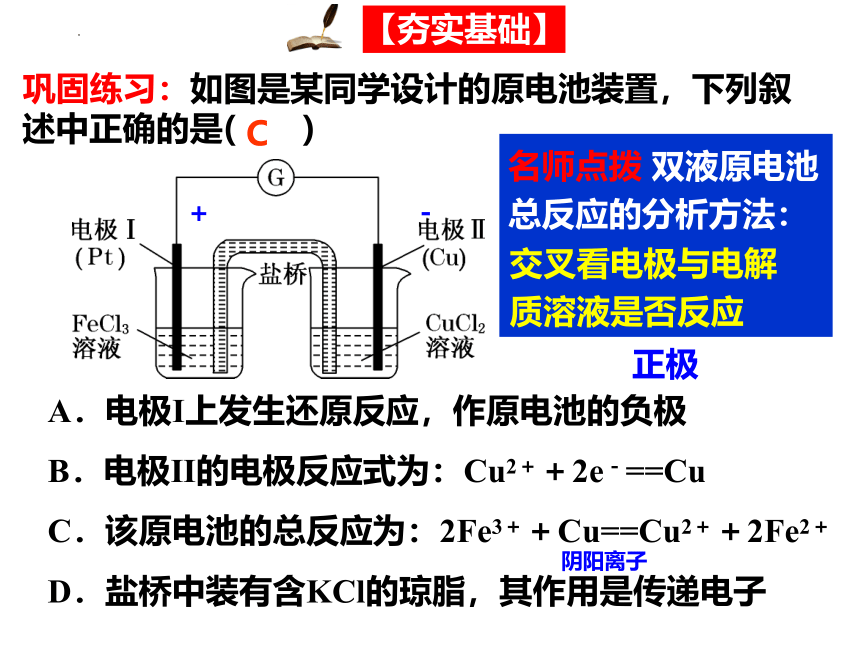
巩固练习:如图是某同学设计的原电池装置,下列叙述中正确的是( )
A.电极Ⅰ上发生还原反应,作原电池的负极
B.电极Ⅱ的电极反应式为:Cu2++2e-==Cu
C.该原电池的总反应为:2Fe3++Cu==Cu2++2Fe2+
D.盐桥中装有含KCl的琼脂,其作用是传递电子
C
-
+
名师点拨 双液原电池总反应的分析方法:
交叉看电极与电解质溶液是否反应
正极
阴阳离子
【夯实基础】
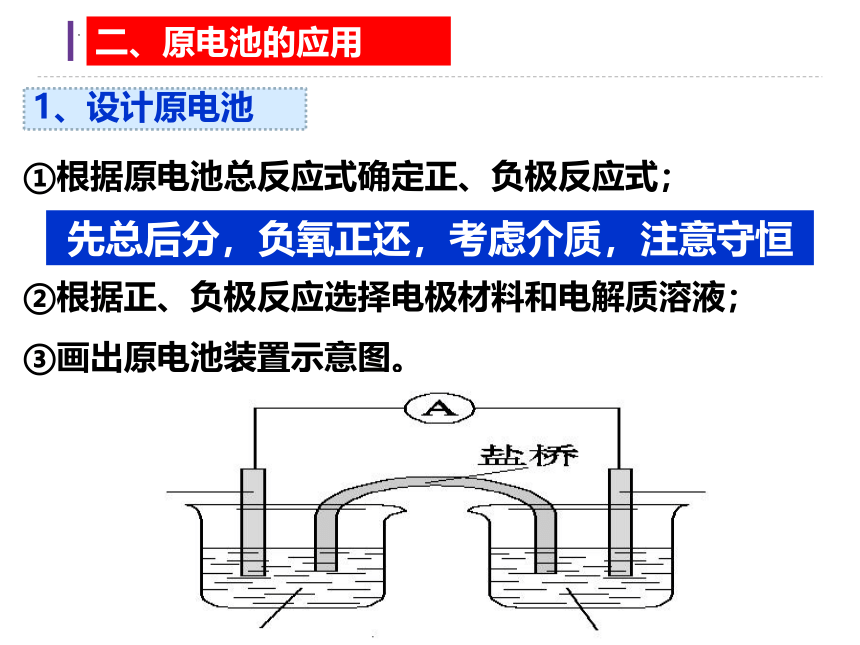
①根据原电池总反应式确定正、负极反应式;
②根据正、负极反应选择电极材料和电解质溶液;
③画出原电池装置示意图。
1、设计原电池
二、原电池的应用
先总后分,负氧正还,考虑介质,注意守恒
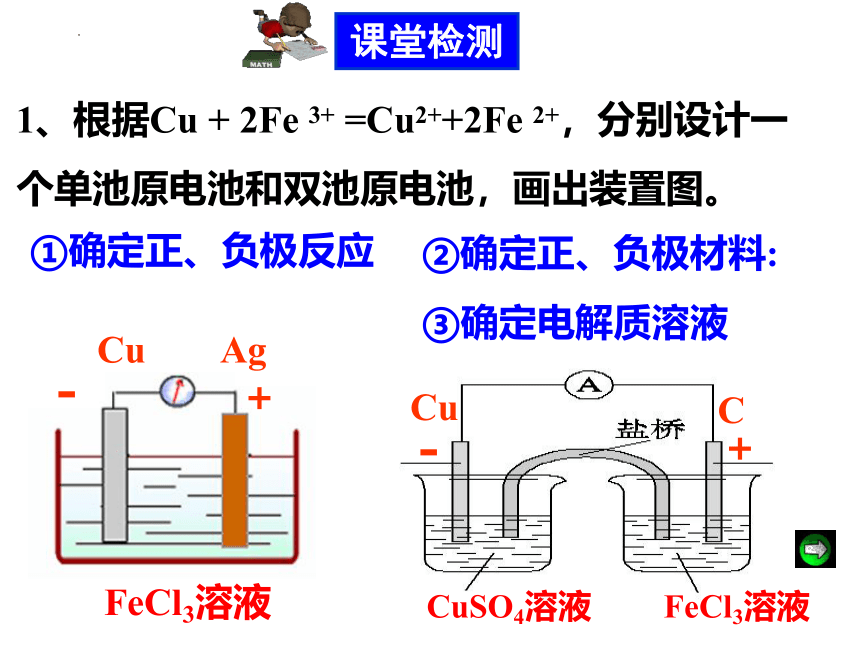
1、根据Cu + 2Fe 3+ =Cu2++2Fe 2+,分别设计一个单池原电池和双池原电池,画出装置图。
①确定正、负极反应
③确定电解质溶液
FeCl3溶液
课堂检测
-
Cu
②确定正、负极材料:
Ag
-
+
Cu
C
CuSO4溶液
FeCl3溶液
+
练习:试将下列氧化还原反应分别设计成原电池,画出相应的装置图。1、Fe +2 FeCl3= 3FeCl22、3Cu + 8HNO3= 3Cu(NO3)2+2NO↑+4H2O3、2H2+ O2= 2H2O课堂检测电极反应的书写1、写氧化、还原反应2、变价原子的配平3、不变价原子的配平(考虑电解质溶液的环境)Pb + PbO2 + 4H++2SO42- = 2PbSO4 + 2H2O
Cd + 2NiO(OH) + 2H2O=Cd(OH)2 + 2Ni(OH)2
电极反应的书写
1、写氧化、还原反应
2、变价原子的配平
3、不变价原子的配平(考虑电解质溶液的环境)
2、加快氧化还原反应的速率
二、原电池的应用
一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率加快。
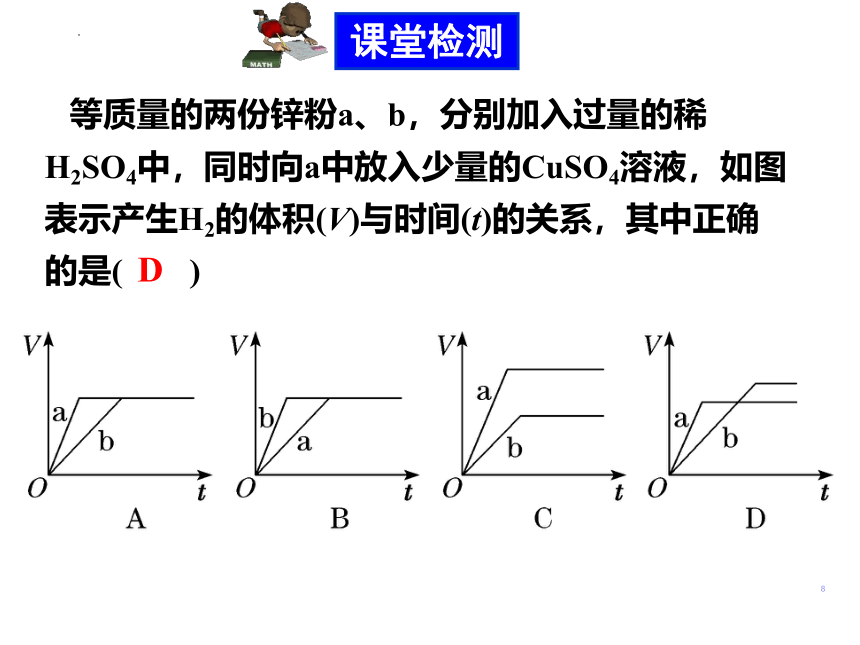
等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )D课堂检测一定量的稀HCl跟过量纯铁反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施有( )
A.加热
B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体
D.加入少量CuSO4溶液
E、将纯铁改为生铁
D E
课堂检测
3、比较金属活动性强弱
二、原电池的应用
如有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A溶解,而B上有气体放出,则说明A作负极,B作正极,即可以断定金属活动性:A > B。
C
【新课标卷】根据下图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
A
课堂检测
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【天津卷】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
C
【夯实基础】
CuSO4溶液
Zn
Cu
A
CuSO4溶液
Zn
ZnSO4溶液
A
Cu
缺点:
优点:
缺点:
优点:
CuSO4溶液
Zn
Cu
ZnSO4溶液
A
小结
基础型
盐桥型
隔膜型
盐桥
电流不稳定
电流稳定
电流小(内阻大)
需更换盐桥
不便携带(体积大)
电流大且稳定
便于携带(体积小)
1、用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片侵入AgNO3溶液中发生的化学反应与该原电池反应相同
C
A.①② B.②③ C.②④ D.③④
课堂检测
2.已知:AsO43-+2I-+2H+ AsO33-+I2+H2O。
(Ⅰ)若向B中逐滴加入浓盐酸,发现电流表指针偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现电流表指针与(Ⅰ)中偏转方向相反。
试回答下列问题:
(1)两次操作中电流表
指针为什么会发生偏转
___________________。
课堂检测
两次操作中均发生原电池反应,所以电流表指针均发生偏转
2.已知:AsO43-+2I-+2H+ AsO33-+I2+H2O。
(Ⅰ)若向B中逐滴加入浓盐酸,发现电流表指针偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现电流表指针与(Ⅰ)中偏转方向相反。
试回答下列问题:
(2)两次操作过程中电流表
指针偏转方向为什么相反?
_____________________。
课堂检测
滴加40%的NaOH(aq),将H+中和,溶液中c(H+)减小,题给可逆反应平衡逆向移动,电子在C2棒上产生,并沿外电路流向C1棒,I2得电子变为I-, AsO33-变为AsO43- 。
两次操作中,电极相反,电子流向相反,因而电流表指针偏转方向相反
2.已知:AsO43-+2I-+2H+ AsO33-+I2+H2O。
(Ⅰ)若向B中逐滴加入浓盐酸,发现电流表指针偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现电流表指针与(Ⅰ)中偏转方向相反。
试回答下列问题:
(3)操作(Ⅰ)中,C1棒上的
反应为_________ _______。
(4)操作(Ⅱ)中,C2棒上的
反应为____________________。
课堂检测
2I--2e- =I2
AsO33- +2OH--2e-==AsO43- +H2O
学以致用
【生活中的膜电池】
电解质膜
氢气
氧气
氢氧燃料电池
隔
离
膜
负极
正极
锂电池
走进生活
正极材料
负极材料
隔膜
电解液
包装外壳
浸了KOH(aq)的隔板
纽扣式银锌电池
设计水果(橘子)电池
实验仪器和药品:
实验内容:
灵敏电流计、铜片、锌片、导线、培养皿、橘子
注意:铜片、锌片较尖锐,使用时小心。
1、请利用所给材料设计橘子电池
(基础型、盐桥型、隔膜型);
2、观察实验现象并提炼出原电池模型。
实践活动
方案一
方案三
方案二
电极插入单瓣橘子
电极插入两瓣未分开的橘子
电极插入两瓣分开的橘子
设计水果(橘子)电池
实践活动
方案一
电极插入单瓣橘子
提炼
模型
果汁(含电解质溶液)
Zn
Cu
G
基础型原电池
设计水果(橘子)电池
实践活动
方案二
电极插入两瓣分开的橘子
——改进产生电流
2.“连隧道”
3.“搭桥”
1.加电解质溶液
盐桥型原电池
基础型原电池
设计水果(橘子)电池
实践活动
方案三
电极插入两瓣未分开的橘子
提炼
模型
果汁(含电解质溶液)
Zn
Cu
G
膜
分池
隔膜型原电池
设计水果(橘子)电池
实践活动
伏打电堆
1799年
1836年
1839年
丹尼尔电池
W.R.Grove提出氢氧燃料电池
由电池发展史
你想到些什么?
反思感悟
化学—人类进步的关键。
—西博格
第四章 化学反应与电能
第一节 原电池
第二课时 原电池应用
巩固练习:如图是某同学设计的原电池装置,下列叙述中正确的是( )
A.电极Ⅰ上发生还原反应,作原电池的负极
B.电极Ⅱ的电极反应式为:Cu2++2e-==Cu
C.该原电池的总反应为:2Fe3++Cu==Cu2++2Fe2+
D.盐桥中装有含KCl的琼脂,其作用是传递电子
C
-
+
名师点拨 双液原电池总反应的分析方法:
交叉看电极与电解质溶液是否反应
正极
阴阳离子
【夯实基础】
①根据原电池总反应式确定正、负极反应式;
②根据正、负极反应选择电极材料和电解质溶液;
③画出原电池装置示意图。
1、设计原电池
二、原电池的应用
先总后分,负氧正还,考虑介质,注意守恒
1、根据Cu + 2Fe 3+ =Cu2++2Fe 2+,分别设计一个单池原电池和双池原电池,画出装置图。
①确定正、负极反应
③确定电解质溶液
FeCl3溶液
课堂检测
-
Cu
②确定正、负极材料:
Ag
-
+
Cu
C
CuSO4溶液
FeCl3溶液
+
练习:试将下列氧化还原反应分别设计成原电池,画出相应的装置图。1、Fe +2 FeCl3= 3FeCl22、3Cu + 8HNO3= 3Cu(NO3)2+2NO↑+4H2O3、2H2+ O2= 2H2O课堂检测电极反应的书写1、写氧化、还原反应2、变价原子的配平3、不变价原子的配平(考虑电解质溶液的环境)Pb + PbO2 + 4H++2SO42- = 2PbSO4 + 2H2O
Cd + 2NiO(OH) + 2H2O=Cd(OH)2 + 2Ni(OH)2
电极反应的书写
1、写氧化、还原反应
2、变价原子的配平
3、不变价原子的配平(考虑电解质溶液的环境)
2、加快氧化还原反应的速率
二、原电池的应用
一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率加快。
等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )D课堂检测一定量的稀HCl跟过量纯铁反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施有( )
A.加热
B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体
D.加入少量CuSO4溶液
E、将纯铁改为生铁
D E
课堂检测
3、比较金属活动性强弱
二、原电池的应用
如有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A溶解,而B上有气体放出,则说明A作负极,B作正极,即可以断定金属活动性:A > B。
C
【新课标卷】根据下图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
A
课堂检测
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【天津卷】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
C
【夯实基础】
CuSO4溶液
Zn
Cu
A
CuSO4溶液
Zn
ZnSO4溶液
A
Cu
缺点:
优点:
缺点:
优点:
CuSO4溶液
Zn
Cu
ZnSO4溶液
A
小结
基础型
盐桥型
隔膜型
盐桥
电流不稳定
电流稳定
电流小(内阻大)
需更换盐桥
不便携带(体积大)
电流大且稳定
便于携带(体积小)
1、用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片侵入AgNO3溶液中发生的化学反应与该原电池反应相同
C
A.①② B.②③ C.②④ D.③④
课堂检测
2.已知:AsO43-+2I-+2H+ AsO33-+I2+H2O。
(Ⅰ)若向B中逐滴加入浓盐酸,发现电流表指针偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现电流表指针与(Ⅰ)中偏转方向相反。
试回答下列问题:
(1)两次操作中电流表
指针为什么会发生偏转
___________________。
课堂检测
两次操作中均发生原电池反应,所以电流表指针均发生偏转
2.已知:AsO43-+2I-+2H+ AsO33-+I2+H2O。
(Ⅰ)若向B中逐滴加入浓盐酸,发现电流表指针偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现电流表指针与(Ⅰ)中偏转方向相反。
试回答下列问题:
(2)两次操作过程中电流表
指针偏转方向为什么相反?
_____________________。
课堂检测
滴加40%的NaOH(aq),将H+中和,溶液中c(H+)减小,题给可逆反应平衡逆向移动,电子在C2棒上产生,并沿外电路流向C1棒,I2得电子变为I-, AsO33-变为AsO43- 。
两次操作中,电极相反,电子流向相反,因而电流表指针偏转方向相反
2.已知:AsO43-+2I-+2H+ AsO33-+I2+H2O。
(Ⅰ)若向B中逐滴加入浓盐酸,发现电流表指针偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现电流表指针与(Ⅰ)中偏转方向相反。
试回答下列问题:
(3)操作(Ⅰ)中,C1棒上的
反应为_________ _______。
(4)操作(Ⅱ)中,C2棒上的
反应为____________________。
课堂检测
2I--2e- =I2
AsO33- +2OH--2e-==AsO43- +H2O
学以致用
【生活中的膜电池】
电解质膜
氢气
氧气
氢氧燃料电池
隔
离
膜
负极
正极
锂电池
走进生活
正极材料
负极材料
隔膜
电解液
包装外壳
浸了KOH(aq)的隔板
纽扣式银锌电池
设计水果(橘子)电池
实验仪器和药品:
实验内容:
灵敏电流计、铜片、锌片、导线、培养皿、橘子
注意:铜片、锌片较尖锐,使用时小心。
1、请利用所给材料设计橘子电池
(基础型、盐桥型、隔膜型);
2、观察实验现象并提炼出原电池模型。
实践活动
方案一
方案三
方案二
电极插入单瓣橘子
电极插入两瓣未分开的橘子
电极插入两瓣分开的橘子
设计水果(橘子)电池
实践活动
方案一
电极插入单瓣橘子
提炼
模型
果汁(含电解质溶液)
Zn
Cu
G
基础型原电池
设计水果(橘子)电池
实践活动
方案二
电极插入两瓣分开的橘子
——改进产生电流
2.“连隧道”
3.“搭桥”
1.加电解质溶液
盐桥型原电池
基础型原电池
设计水果(橘子)电池
实践活动
方案三
电极插入两瓣未分开的橘子
提炼
模型
果汁(含电解质溶液)
Zn
Cu
G
膜
分池
隔膜型原电池
设计水果(橘子)电池
实践活动
伏打电堆
1799年
1836年
1839年
丹尼尔电池
W.R.Grove提出氢氧燃料电池
由电池发展史
你想到些什么?
反思感悟
化学—人类进步的关键。
—西博格
