10.2 酸和碱的中和反应 课件(共32张PPT)
文档属性
| 名称 | 10.2 酸和碱的中和反应 课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-05 20:24:25 | ||
图片预览









文档简介
(共32张PPT)
第十单元 酸和碱
课题2 酸和碱的中和反应
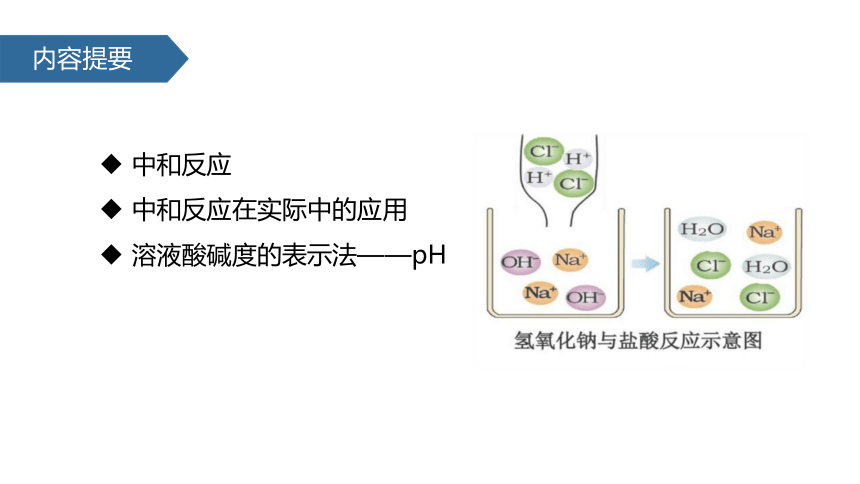
内容提要
中和反应
中和反应在实际中的应用
溶液酸碱度的表示法——pH
学习目标
掌握中和反应的定义,理解酸和碱发生中和反应的本质;
了解中和反应在实际生活中的应用;
会使用PH试纸定量地测定溶液的酸碱性强弱;
了解溶液的酸碱性对于生活、生产以及人类生命的意义。
中和反应
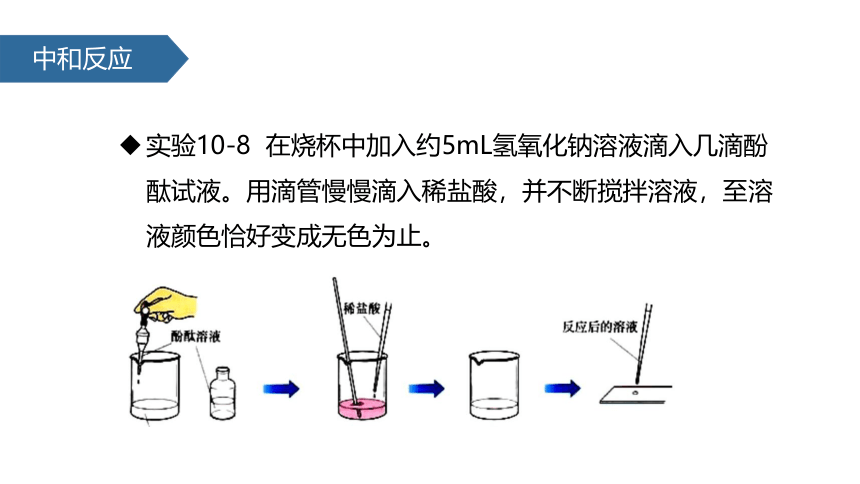
实验10-8 在烧杯中加入约5mL氢氧化钠溶液滴入几滴酚酞试液。用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。
实验
操作步骤 现象和分析
在烧杯中加入5mL稀氢氧化钠溶液,再滴入几滴酚酞 溶液变红色
用滴管慢慢滴入稀盐酸 溶液由红色逐渐变为无色
取反应的无色溶液2滴滴在玻璃片上,置于酒精灯上加热 玻璃片上有白色固体生成
合作讨论
玻璃片上的物质是氢氧化钠吗?为什么?
玻璃片上的物质不是氢氧化钠,因为,氢氧化钠与盐酸反应生成的是氯化钠,玻璃片上的白色固体是氯化钠。
你能写出他们反应的方程式吗?
NaOH+HCl=NaCl+H2O
中和反应
中和反应:酸溶液中的H+和碱溶液中的OH-反应生成水分子的过程。
常见的酸和碱反应
Ca(OH)2+2HCl=CaCl2+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
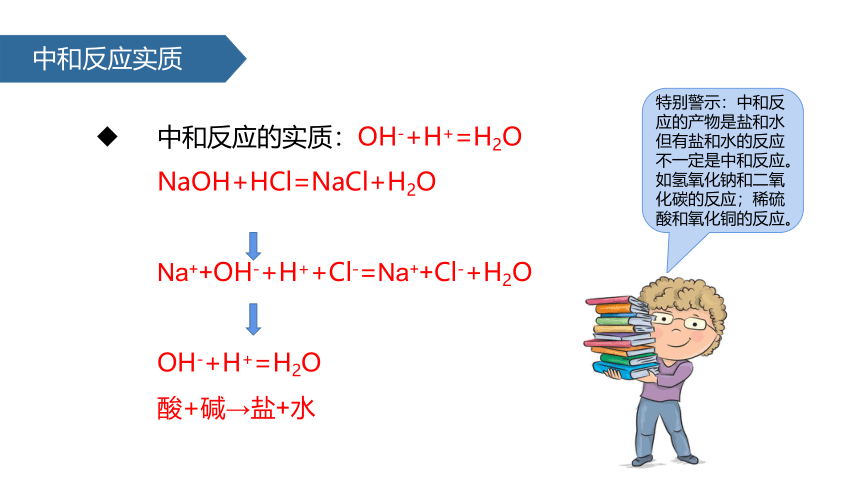
中和反应实质
中和反应的实质:OH-+H+=H2O
NaOH+HCl=NaCl+H2O
Na++OH-+H++Cl-=Na++Cl-+H2O
OH-+H+=H2O
酸+碱→盐+水
特别警示:中和反应的产物是盐和水但有盐和水的反应不一定是中和反应。如氢氧化钠和二氧化碳的反应;稀硫酸和氧化铜的反应。
课堂练习
1.下列反应中属于中和反应的是( )
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4=Na2SO4+2H2O
C. CO2+2NaOH=Na2CO3+H2O
D. Fe+CuSO4=Cu+FeSO4
B
课堂练习
【解析】该反应的反应物是盐和酸,生成物是盐、水和二氧化碳,不属于中和反应,故A错误;该反应是酸与碱反应生成盐和水的反应,属于中和反应。故B正确;该反应的反应物是碱和非金属氧化物,不属于中和反应,故C错误;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故D错误。
课堂练习
2.关于中和反应的说法,错误的是 ( )
A. 一定没有沉淀生成
B. 一定有氧化物生成
C. 一定是放热反应
D. 一定是复分解反应
A
课堂练习
【解析】中和反应是酸和碱反应生成盐和水的反应,盐有可能是沉淀。如氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,故A说法错误;中和反应是酸和碱反应生成盐和水的反应,水就属氧化物,故B说法正确;中和反应会放出热量,故C说法正确;中和反应酸和碱属化合物,生成的盐和水也是化合物,两种化合物相互交换成分生成另外两种化合物的反应是复分解反应,故D说法正确。
中和反应在实际中的应用
1.改变土壤的酸碱性
原理:利用中和反应原理,向土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。
应如何改变酸性土壤?
用熟石灰中和:Ca(OH)2+2HCl=CaCl2+2H2O
中和反应在实际中的应用
2.处理工业废水:工厂生产过程中的污水,需要进行一系列处理。
思考:硫酸厂的污水中含有硫酸,可用什么进行处理,并写出反应方程式?
用熟石灰进行中和:Ca(OH)2+H2SO4=CaSO4+2H2O
中和反应在实际中的应用
3.用于医药卫生
中和胃酸
胃酸的主要成分是盐酸。
胃药的主要成分是氢氧化铝。
氢氧化铝中和酸:Al(OH)3+3HCl=AlCl3+3H2O
被蚊虫叮咬后,涂一些含有碱性物质的药水。
如氨水、肥皂水等。
课堂练习
用你所学过的知识来判断,下列说法不正确的是 ( )
A. 可以用Al(OH)3来中和过多的胃酸
B. 吸烟有害健康,原因之一是烟气中含有一氧化碳
C. 工业酒精中含有极少量有毒的甲醇,不可饮用
D. 所有的盐都可以用作调味剂给食品调味
D
课堂练习
【解析】氢氧化铝属于碱会与胃酸发生中和反应而除去较多的胃酸,故A正确,一氧碳会与人的血红蛋白中的亚铁离子转化为铁离子而失去携氧能力,使人因缺氧而死亡,故B正确。甲醇有毒,饮用后会双目失明,大量饮用会导致死亡,故C正确,亚硝酸钠有毒,不能食用,故D错误。
溶液酸碱度的表示方法——pH
溶液的酸碱度常用pH来表示
pH的数值一般在0~14之间
测定pH的最简便的方法:使用pH试纸
注意酸碱性与酸碱度的区别:溶液的酸碱性指溶液是酸性还是碱性,常用酸碱指示剂来检验溶液的酸碱性;溶液酸碱性的强弱程度叫溶液的酸碱度,测定用pH试纸。
溶液酸碱性与pH的关系
酸性溶液pH<7:pH越小,酸性越强。
碱性溶液pH>7:pH越大,碱性越强。
中性溶液pH=7。
注意事项
要使酸性溶液的pH升高,可向溶液中加入碱性溶液;要使碱性溶液pH降低,可向溶液中加入酸性溶液。
稀释酸性或碱性溶液时,酸性溶液的pH会变大并接近于7,但不会等于或大于7,同理碱性溶液的pH会变小并接近于7,但不会等于或小于7。
pH的测定方法
pH试纸(精度:1)
pH计(精度:0.01)
pH的测定方法
用pH试纸:测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取少量溶液滴到pH试纸上,半分钟后把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
注意事项:
①不能直接把pH试纸浸入待测溶液中,以免带入杂质,污染试液。
②不能用水将pH试纸润湿,再进行测试,因为润湿后的试纸会稀释待测溶液。
实验
实验10-10 pH 酸碱性 pH 酸碱性
橘汁 3 酸 汽水 6 酸
糖水 7 中 自来水 7 中
牛奶 7 中 唾液 7 中
番茄汁 6 酸 草木灰水 11 碱
肥皂水 10 碱 洗洁精 12 碱
苹果汁 3 酸 白醋 2 酸
身边常见物质的pH
溶液酸碱性的意义
化工生产中,许多反应都必须在一定的pH溶液里才能进行。
农业生产中,农作物一般适宜在pH为7或接近7的土壤里生长。
测定雨水的pH,可以了解空气的污染状况。(因为溶解有二氧化碳,正常的雨水的pH约为5.6,酸雨的pH小于5.6)
测定人体液的pH,可以了解人体的健康情况。(碱性越强对头发损伤越大;由于pH越大,碱性越强,故pH=13的溶液对头发损伤最大)
资料
人体内的一些液体和排泄物的正常pH范围
血浆 7.35~7.45
唾液 6.6~7.1
胃液 0.9~1.5
乳汁 6.6~7.6
胆汁 7.1~7.3
胰液 7.5~8.0
尿液 4.7~8.4
课堂练习
1.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A. 用pH试纸直接蘸取待测溶液
B. 先用水润湿pH试纸再测定溶液酸碱度
C. 用pH试纸测得石灰水的pH=5
D. 用pH试纸测得盐酸的pH=1
D
课堂练习
【解析】溶液的酸碱度是指溶液的酸碱性强弱程度。一般用pH值来表示。溶液的酸碱度测定就是使用pH试纸来测定溶液的酸碱度。具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在干燥的玻璃皿或白瓷板上的干燥pH试纸上。再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH。pH值<7为酸性,pH值=7为中性,pH值>7为碱性。只能用玻璃棒蘸取溶液测试pH,故A错误;用水润湿相当于稀释了待测溶液的浓度,测量数据不准确,故B错误;石灰水为碱,常温下pH>7,故C错误;盐酸显酸性,pH值<7,故D正确。
课堂练习
2.将一根健康的头发浸入下列不同酸碱度溶液中,其中碱性越强对头发损伤越大,则下列溶液中对头发损伤最大的是 ( )
A.pH=3 B.pH=5 C.pH=10 D.pH=13
【解析】由题意,碱性越强对头发损伤越大;由于pH越大,碱性越强,故pH=13的溶对头发损伤最大。
D
课堂练习
3.如图(a)所示中甲、乙、丙、丁表示相邻两种物质相互合过程中溶液酸碱度的变化,其中可能符合图(b)所示变化关系的是( )
Ca(OH)2
NaCO3
H2SO4
H2O
甲
乙
丁
丙
pH
加入物质的质量/g
0
A. 甲 B.乙 C.丙 D. 丁
C
7
(a)
(b)
课堂练习
【解析】:由图可以看出,开始时pH小于7,后来pH大于7,说明是将碱性溶液加入酸性溶液中。甲是碱性溶液和中性溶液混合,故A错误;乙是碱性溶液和碱性溶液混合,故B错误;丙是酸性溶液和碱性溶液混合,故C正确;丁是酸性溶液和中性溶液的混合,故D错误。
课堂小结
中和反应的本质:酸和碱反应生成盐和水
盐在水溶液中能解离出金属离子和酸根离子的化合物
了解中和反应在生活中的实际应用
溶液酸碱度的表示方法——pH
第十单元 酸和碱
课题2 酸和碱的中和反应
内容提要
中和反应
中和反应在实际中的应用
溶液酸碱度的表示法——pH
学习目标
掌握中和反应的定义,理解酸和碱发生中和反应的本质;
了解中和反应在实际生活中的应用;
会使用PH试纸定量地测定溶液的酸碱性强弱;
了解溶液的酸碱性对于生活、生产以及人类生命的意义。
中和反应
实验10-8 在烧杯中加入约5mL氢氧化钠溶液滴入几滴酚酞试液。用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。
实验
操作步骤 现象和分析
在烧杯中加入5mL稀氢氧化钠溶液,再滴入几滴酚酞 溶液变红色
用滴管慢慢滴入稀盐酸 溶液由红色逐渐变为无色
取反应的无色溶液2滴滴在玻璃片上,置于酒精灯上加热 玻璃片上有白色固体生成
合作讨论
玻璃片上的物质是氢氧化钠吗?为什么?
玻璃片上的物质不是氢氧化钠,因为,氢氧化钠与盐酸反应生成的是氯化钠,玻璃片上的白色固体是氯化钠。
你能写出他们反应的方程式吗?
NaOH+HCl=NaCl+H2O
中和反应
中和反应:酸溶液中的H+和碱溶液中的OH-反应生成水分子的过程。
常见的酸和碱反应
Ca(OH)2+2HCl=CaCl2+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
中和反应实质
中和反应的实质:OH-+H+=H2O
NaOH+HCl=NaCl+H2O
Na++OH-+H++Cl-=Na++Cl-+H2O
OH-+H+=H2O
酸+碱→盐+水
特别警示:中和反应的产物是盐和水但有盐和水的反应不一定是中和反应。如氢氧化钠和二氧化碳的反应;稀硫酸和氧化铜的反应。
课堂练习
1.下列反应中属于中和反应的是( )
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4=Na2SO4+2H2O
C. CO2+2NaOH=Na2CO3+H2O
D. Fe+CuSO4=Cu+FeSO4
B
课堂练习
【解析】该反应的反应物是盐和酸,生成物是盐、水和二氧化碳,不属于中和反应,故A错误;该反应是酸与碱反应生成盐和水的反应,属于中和反应。故B正确;该反应的反应物是碱和非金属氧化物,不属于中和反应,故C错误;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故D错误。
课堂练习
2.关于中和反应的说法,错误的是 ( )
A. 一定没有沉淀生成
B. 一定有氧化物生成
C. 一定是放热反应
D. 一定是复分解反应
A
课堂练习
【解析】中和反应是酸和碱反应生成盐和水的反应,盐有可能是沉淀。如氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,故A说法错误;中和反应是酸和碱反应生成盐和水的反应,水就属氧化物,故B说法正确;中和反应会放出热量,故C说法正确;中和反应酸和碱属化合物,生成的盐和水也是化合物,两种化合物相互交换成分生成另外两种化合物的反应是复分解反应,故D说法正确。
中和反应在实际中的应用
1.改变土壤的酸碱性
原理:利用中和反应原理,向土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。
应如何改变酸性土壤?
用熟石灰中和:Ca(OH)2+2HCl=CaCl2+2H2O
中和反应在实际中的应用
2.处理工业废水:工厂生产过程中的污水,需要进行一系列处理。
思考:硫酸厂的污水中含有硫酸,可用什么进行处理,并写出反应方程式?
用熟石灰进行中和:Ca(OH)2+H2SO4=CaSO4+2H2O
中和反应在实际中的应用
3.用于医药卫生
中和胃酸
胃酸的主要成分是盐酸。
胃药的主要成分是氢氧化铝。
氢氧化铝中和酸:Al(OH)3+3HCl=AlCl3+3H2O
被蚊虫叮咬后,涂一些含有碱性物质的药水。
如氨水、肥皂水等。
课堂练习
用你所学过的知识来判断,下列说法不正确的是 ( )
A. 可以用Al(OH)3来中和过多的胃酸
B. 吸烟有害健康,原因之一是烟气中含有一氧化碳
C. 工业酒精中含有极少量有毒的甲醇,不可饮用
D. 所有的盐都可以用作调味剂给食品调味
D
课堂练习
【解析】氢氧化铝属于碱会与胃酸发生中和反应而除去较多的胃酸,故A正确,一氧碳会与人的血红蛋白中的亚铁离子转化为铁离子而失去携氧能力,使人因缺氧而死亡,故B正确。甲醇有毒,饮用后会双目失明,大量饮用会导致死亡,故C正确,亚硝酸钠有毒,不能食用,故D错误。
溶液酸碱度的表示方法——pH
溶液的酸碱度常用pH来表示
pH的数值一般在0~14之间
测定pH的最简便的方法:使用pH试纸
注意酸碱性与酸碱度的区别:溶液的酸碱性指溶液是酸性还是碱性,常用酸碱指示剂来检验溶液的酸碱性;溶液酸碱性的强弱程度叫溶液的酸碱度,测定用pH试纸。
溶液酸碱性与pH的关系
酸性溶液pH<7:pH越小,酸性越强。
碱性溶液pH>7:pH越大,碱性越强。
中性溶液pH=7。
注意事项
要使酸性溶液的pH升高,可向溶液中加入碱性溶液;要使碱性溶液pH降低,可向溶液中加入酸性溶液。
稀释酸性或碱性溶液时,酸性溶液的pH会变大并接近于7,但不会等于或大于7,同理碱性溶液的pH会变小并接近于7,但不会等于或小于7。
pH的测定方法
pH试纸(精度:1)
pH计(精度:0.01)
pH的测定方法
用pH试纸:测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取少量溶液滴到pH试纸上,半分钟后把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
注意事项:
①不能直接把pH试纸浸入待测溶液中,以免带入杂质,污染试液。
②不能用水将pH试纸润湿,再进行测试,因为润湿后的试纸会稀释待测溶液。
实验
实验10-10 pH 酸碱性 pH 酸碱性
橘汁 3 酸 汽水 6 酸
糖水 7 中 自来水 7 中
牛奶 7 中 唾液 7 中
番茄汁 6 酸 草木灰水 11 碱
肥皂水 10 碱 洗洁精 12 碱
苹果汁 3 酸 白醋 2 酸
身边常见物质的pH
溶液酸碱性的意义
化工生产中,许多反应都必须在一定的pH溶液里才能进行。
农业生产中,农作物一般适宜在pH为7或接近7的土壤里生长。
测定雨水的pH,可以了解空气的污染状况。(因为溶解有二氧化碳,正常的雨水的pH约为5.6,酸雨的pH小于5.6)
测定人体液的pH,可以了解人体的健康情况。(碱性越强对头发损伤越大;由于pH越大,碱性越强,故pH=13的溶液对头发损伤最大)
资料
人体内的一些液体和排泄物的正常pH范围
血浆 7.35~7.45
唾液 6.6~7.1
胃液 0.9~1.5
乳汁 6.6~7.6
胆汁 7.1~7.3
胰液 7.5~8.0
尿液 4.7~8.4
课堂练习
1.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A. 用pH试纸直接蘸取待测溶液
B. 先用水润湿pH试纸再测定溶液酸碱度
C. 用pH试纸测得石灰水的pH=5
D. 用pH试纸测得盐酸的pH=1
D
课堂练习
【解析】溶液的酸碱度是指溶液的酸碱性强弱程度。一般用pH值来表示。溶液的酸碱度测定就是使用pH试纸来测定溶液的酸碱度。具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在干燥的玻璃皿或白瓷板上的干燥pH试纸上。再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH。pH值<7为酸性,pH值=7为中性,pH值>7为碱性。只能用玻璃棒蘸取溶液测试pH,故A错误;用水润湿相当于稀释了待测溶液的浓度,测量数据不准确,故B错误;石灰水为碱,常温下pH>7,故C错误;盐酸显酸性,pH值<7,故D正确。
课堂练习
2.将一根健康的头发浸入下列不同酸碱度溶液中,其中碱性越强对头发损伤越大,则下列溶液中对头发损伤最大的是 ( )
A.pH=3 B.pH=5 C.pH=10 D.pH=13
【解析】由题意,碱性越强对头发损伤越大;由于pH越大,碱性越强,故pH=13的溶对头发损伤最大。
D
课堂练习
3.如图(a)所示中甲、乙、丙、丁表示相邻两种物质相互合过程中溶液酸碱度的变化,其中可能符合图(b)所示变化关系的是( )
Ca(OH)2
NaCO3
H2SO4
H2O
甲
乙
丁
丙
pH
加入物质的质量/g
0
A. 甲 B.乙 C.丙 D. 丁
C
7
(a)
(b)
课堂练习
【解析】:由图可以看出,开始时pH小于7,后来pH大于7,说明是将碱性溶液加入酸性溶液中。甲是碱性溶液和中性溶液混合,故A错误;乙是碱性溶液和碱性溶液混合,故B错误;丙是酸性溶液和碱性溶液混合,故C正确;丁是酸性溶液和中性溶液的混合,故D错误。
课堂小结
中和反应的本质:酸和碱反应生成盐和水
盐在水溶液中能解离出金属离子和酸根离子的化合物
了解中和反应在生活中的实际应用
溶液酸碱度的表示方法——pH
同课章节目录
