9.3 溶液的浓度 同步练习(含答案) 2022-2023学年人教版九年级下册化学
文档属性
| 名称 | 9.3 溶液的浓度 同步练习(含答案) 2022-2023学年人教版九年级下册化学 |  | |
| 格式 | zip | ||
| 文件大小 | 70.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-05 21:40:19 | ||
图片预览



文档简介
9.3 溶液的浓度 同步练习
一、单选题
1.图为A,B,C三种固体物质(不含结晶水)的溶解度曲线.下列说法错误的是( )
A.t1℃时,三种物质中B的溶解度最大
B.t2℃时,取三种物质各a g分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C.将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,A溶液中析出的晶体质量最大
D.可用降温的方法使接近饱和的C溶液变为饱和溶液
2.A,B,C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A,C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
3.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是( )
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
4.右图为甲、乙两种固体物质在水中的溶解度曲线,下列有关说法正确的是( )
A.降低温度能使乙物质的不饱和溶液变成饱和溶液
B.20℃时,甲、乙两物质的溶解度相等
C.40℃时,乙物质的溶解度为25g
D.0℃~20℃时,可配制出25%的甲物质的溶液
5.一定温度时,某物质饱和溶液溶质的质量分数为20%,则该温度时该物质的溶解度是( )
A.20 g/100g水 B.25 g/100g水
C.30 g/100 g水 D.无法确定
6.有一定质量的质量分数为12%的KCl溶液,当蒸发掉120克水后,溶质的质量分数变为24%,则原溶液中溶质的质量为( )
A.12克 B.14.4克 C.24克 D.28.8克
7.将100g98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
8.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则 ( )
A.溶液中溶质质量分数可能不变
B.溶液的质量一定变小
C.溶液中溶质质量分数一定变大
D.溶液的质量一定变大
9.生活中的下列现象不能说明气体的溶解度随温度升高而减小的是()
A.烧开水时,沸腾前水中有气泡逸出
B.喝了汽水以后,常常爱打嗝
C.启开啤酒瓶盖时,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼常常爱浮出水面
10.KNO3与KCl 的溶解度曲线如图所示。下列说法正确的是( )
A.0℃时,KCl的溶解度为29g
B.t1℃时,KNO3和KCl的溶质质量分数相等
C.t2℃时,KCl的溶解度比的KNO3的溶解度大
D.KCl 的溶解度受温度的影响程度比KNO3 大
11.下列有关溶液的说法正确的是( )
A.饱和溶液一定是浓溶液
B.溶质可以是固体,也可以是液体或气体
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
12.溶液与生产、生活密切相关,下列有关溶液的说法正确的是( )
A.5gNaCl完全溶解于100g水中,所得溶液中溶质的质量分数为5%
B.固体物质的溶解度随温度升高一定增大
C.饱和硝酸钾溶液析出晶体后变为不饱和溶液
D.在其它条件不变时,氮气的溶解度随温度的升高而减小
二、填空题
13.卤水的主要成分及其溶解度曲线如图所示。
(1)t1℃时,MgSO4的溶解度 (选填“>”“<”或“=”)KCl的溶解度。
(2)t2℃时,50g水中最多溶解MgCl2的质量为 g。
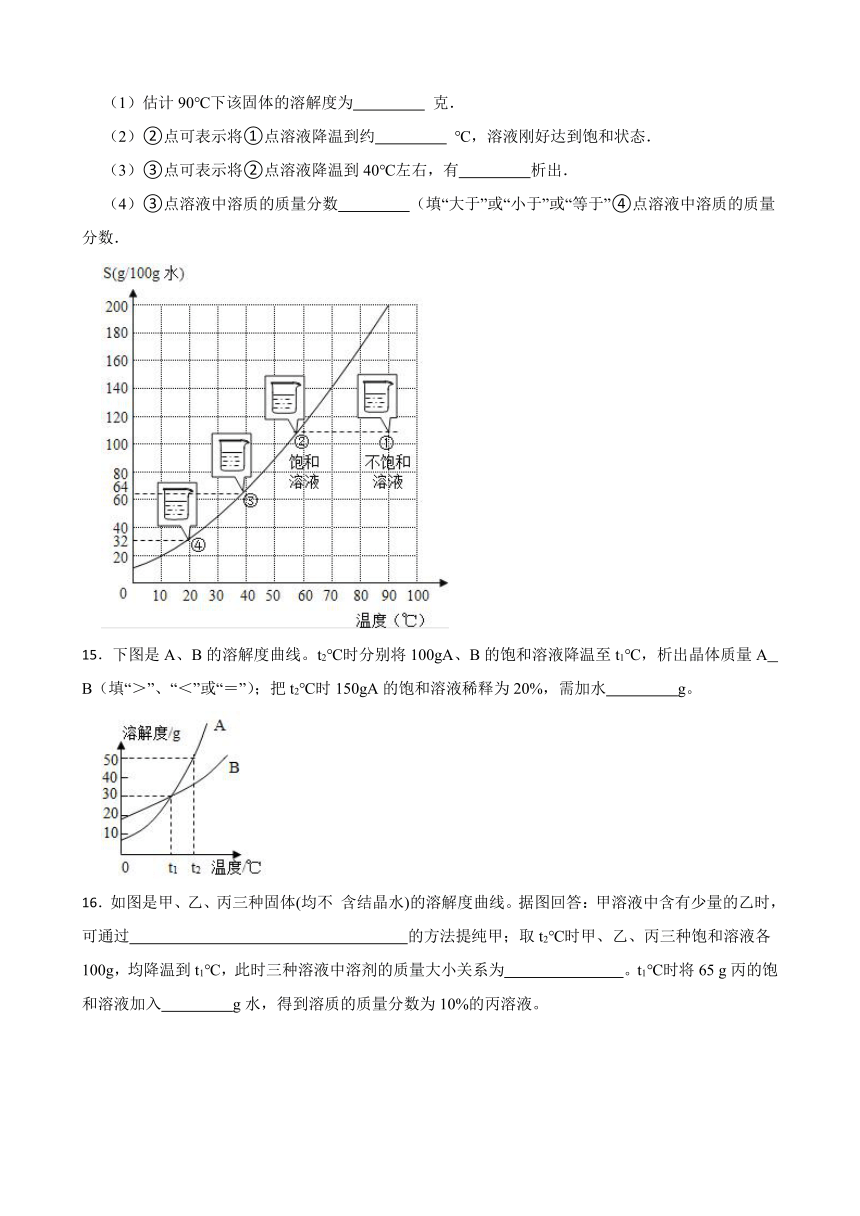
14.某固体物质的溶解度曲线如图所示,试回答有关问题.
(1)估计90℃下该固体的溶解度为 克.
(2)②点可表示将①点溶液降温到约 ℃,溶液刚好达到饱和状态.
(3)③点可表示将②点溶液降温到40℃左右,有 析出.
(4)③点溶液中溶质的质量分数 (填“大于”或“小于”或“等于”④点溶液中溶质的质量分数.
15.下图是A、B的溶解度曲线。t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出晶体质量A B(填“>”、“<”或“=”);把t2℃时150gA的饱和溶液稀释为20%,需加水 g。
16.如图是甲、乙、丙三种固体(均不 含结晶水)的溶解度曲线。据图回答:甲溶液中含有少量的乙时,可通过 的方法提纯甲;取t2℃时甲、乙、丙三种饱和溶液各100g,均降温到t1℃,此时三种溶液中溶剂的质量大小关系为 。t1℃时将65 g丙的饱和溶液加入 g水,得到溶质的质量分数为10%的丙溶液。
17.图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线.在t1℃时,将质量为a g的A、B、C三种物质分别加入100g水中,根据图示回答下列问题:
(1)三种物质中,随温度升高溶解度减小的物质是 ;
(2)t1℃时,所得三种物质的溶液中为不饱溶液的是 ;
(3)若使这三种溶液溶质的质量分数相等,则温度应由t1℃升至 ℃;
(4)若将温度由t1℃升至t4℃时,三种溶液中溶质质量分数的大小关系为 .
18.A、B两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题.
(1)现有常温下B的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有 .
(2)现有一杯t1℃时含A、B两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是 .
(3)下列说法正确的是 .
①t2℃时,A的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
②将t2℃A、B的饱和溶液分别降温至t1℃,此时两溶液中的质量分数相等;
③在t1℃时,用两份等量的水分别配制成A、B的饱和溶液,这两种溶液的质量相等;
④在t2℃时,用等量的A、B分别配制成两种饱和溶液,测得其质量依次为m1g和m2g,则m1<m2.
三、综合题
19.2013年4月20日,我省雅安市芦山县发生了7.0级大地震。为防止灾后疫情发生,防疫人员使用了多种消毒剂进行环境消毒,其中亚氯酸钠(NaClO2)是一种重要的消毒剂。试计算:
(1)亚氯酸钠的相对分子质量为 。
(2)亚氯酸钠中氧元素的质量分数为 。
(3)若要配制质量分数为15%的亚氯酸钠溶液200kg用于环境消毒,则需要亚氯酸钠多少kg,同时需要水多少mL?
20.如图是甲、乙两种物质的溶解度曲线,请回答下列问题。
(1)将接近饱和的乙溶液变成饱和溶液的方法是 。
(2)t2℃时,将50g甲物质加入50g水中,充分搅拌后形成的溶液的溶质质量分数是 。
(3)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,此时甲溶液的溶质质量分数 乙溶液的溶质质量分数。(填“< ”或“=”或“>”)
21.如图是三种物质的溶解度曲线,则
(1)当t2℃<t℃<t3℃时,三种物质的溶解度大小顺序为
(2)将t3℃时,等质量的三种物质饱和溶液降温到t1℃时,析出晶体最多的是
(3)在t2℃时,用50g水配制A的饱和溶液,用100g水配制C的饱和溶液,两种溶液中溶质的质量分数大小关系是 .
22.下图为甲、乙、丙三种物质的溶解度曲线。
(1)t3℃时,甲、乙、丙三种物质中,溶解度由小到大的顺序是 .P点所表示的含义为 。
(2)t3℃时,将40g甲物质加入到50g水中,所得溶液的质量为 ;
(3)t3℃时,将等质量甲和乙的饱和溶液降温到t2℃,所得溶液质量大小关系为:甲 乙(填“<”、“>”或“=”);
(4)将t1℃时丙的不饱和溶液变为饱和溶液可采取的方法为 (填一种即可)。
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】C
4.【答案】B
5.【答案】B
6.【答案】D
7.【答案】A
8.【答案】A
9.【答案】C
10.【答案】A
11.【答案】B
12.【答案】D
13.【答案】(1)>
(2)50
14.【答案】190;60;固体;大于
15.【答案】>;100
16.【答案】冷却热饱和溶液(或降温结晶法);丙>乙>甲;85
17.【答案】C;C;t3;A=B>C
18.【答案】加入溶质;降温结晶;③④
19.【答案】(1)90.5
(2)35.4%
(3)解:要配制质量分数为15%的亚氯酸钠200kg,需要亚硝酸钠的质量为:200kg×15%=30kg,需要水的质量是200kg-30kg=170kg=1.7×105g,由于水的密度是1g/cm3,所以需要水的体积是1.7×105mL= 170000mL.
答:需要亚氯酸钠170kg,同时需要水170000mL.
20.【答案】(1)加溶质(蒸发溶剂、升高温度)
(2)47.4%
(3)>
21.【答案】(1)B>A>C
(2)A
(3)相等
22.【答案】(1)丙<乙<甲;在t2℃时,甲和乙的溶解度相同
(2)80g
(3)<
(4)乙加入丙物质或蒸发水
一、单选题
1.图为A,B,C三种固体物质(不含结晶水)的溶解度曲线.下列说法错误的是( )
A.t1℃时,三种物质中B的溶解度最大
B.t2℃时,取三种物质各a g分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C.将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,A溶液中析出的晶体质量最大
D.可用降温的方法使接近饱和的C溶液变为饱和溶液
2.A,B,C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A,C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
3.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是( )
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
4.右图为甲、乙两种固体物质在水中的溶解度曲线,下列有关说法正确的是( )
A.降低温度能使乙物质的不饱和溶液变成饱和溶液
B.20℃时,甲、乙两物质的溶解度相等
C.40℃时,乙物质的溶解度为25g
D.0℃~20℃时,可配制出25%的甲物质的溶液
5.一定温度时,某物质饱和溶液溶质的质量分数为20%,则该温度时该物质的溶解度是( )
A.20 g/100g水 B.25 g/100g水
C.30 g/100 g水 D.无法确定
6.有一定质量的质量分数为12%的KCl溶液,当蒸发掉120克水后,溶质的质量分数变为24%,则原溶液中溶质的质量为( )
A.12克 B.14.4克 C.24克 D.28.8克
7.将100g98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
8.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则 ( )
A.溶液中溶质质量分数可能不变
B.溶液的质量一定变小
C.溶液中溶质质量分数一定变大
D.溶液的质量一定变大
9.生活中的下列现象不能说明气体的溶解度随温度升高而减小的是()
A.烧开水时,沸腾前水中有气泡逸出
B.喝了汽水以后,常常爱打嗝
C.启开啤酒瓶盖时,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼常常爱浮出水面
10.KNO3与KCl 的溶解度曲线如图所示。下列说法正确的是( )
A.0℃时,KCl的溶解度为29g
B.t1℃时,KNO3和KCl的溶质质量分数相等
C.t2℃时,KCl的溶解度比的KNO3的溶解度大
D.KCl 的溶解度受温度的影响程度比KNO3 大
11.下列有关溶液的说法正确的是( )
A.饱和溶液一定是浓溶液
B.溶质可以是固体,也可以是液体或气体
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
12.溶液与生产、生活密切相关,下列有关溶液的说法正确的是( )
A.5gNaCl完全溶解于100g水中,所得溶液中溶质的质量分数为5%
B.固体物质的溶解度随温度升高一定增大
C.饱和硝酸钾溶液析出晶体后变为不饱和溶液
D.在其它条件不变时,氮气的溶解度随温度的升高而减小
二、填空题
13.卤水的主要成分及其溶解度曲线如图所示。
(1)t1℃时,MgSO4的溶解度 (选填“>”“<”或“=”)KCl的溶解度。
(2)t2℃时,50g水中最多溶解MgCl2的质量为 g。
14.某固体物质的溶解度曲线如图所示,试回答有关问题.
(1)估计90℃下该固体的溶解度为 克.
(2)②点可表示将①点溶液降温到约 ℃,溶液刚好达到饱和状态.
(3)③点可表示将②点溶液降温到40℃左右,有 析出.
(4)③点溶液中溶质的质量分数 (填“大于”或“小于”或“等于”④点溶液中溶质的质量分数.
15.下图是A、B的溶解度曲线。t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出晶体质量A B(填“>”、“<”或“=”);把t2℃时150gA的饱和溶液稀释为20%,需加水 g。
16.如图是甲、乙、丙三种固体(均不 含结晶水)的溶解度曲线。据图回答:甲溶液中含有少量的乙时,可通过 的方法提纯甲;取t2℃时甲、乙、丙三种饱和溶液各100g,均降温到t1℃,此时三种溶液中溶剂的质量大小关系为 。t1℃时将65 g丙的饱和溶液加入 g水,得到溶质的质量分数为10%的丙溶液。
17.图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线.在t1℃时,将质量为a g的A、B、C三种物质分别加入100g水中,根据图示回答下列问题:
(1)三种物质中,随温度升高溶解度减小的物质是 ;
(2)t1℃时,所得三种物质的溶液中为不饱溶液的是 ;
(3)若使这三种溶液溶质的质量分数相等,则温度应由t1℃升至 ℃;
(4)若将温度由t1℃升至t4℃时,三种溶液中溶质质量分数的大小关系为 .
18.A、B两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题.
(1)现有常温下B的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有 .
(2)现有一杯t1℃时含A、B两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是 .
(3)下列说法正确的是 .
①t2℃时,A的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
②将t2℃A、B的饱和溶液分别降温至t1℃,此时两溶液中的质量分数相等;
③在t1℃时,用两份等量的水分别配制成A、B的饱和溶液,这两种溶液的质量相等;
④在t2℃时,用等量的A、B分别配制成两种饱和溶液,测得其质量依次为m1g和m2g,则m1<m2.
三、综合题
19.2013年4月20日,我省雅安市芦山县发生了7.0级大地震。为防止灾后疫情发生,防疫人员使用了多种消毒剂进行环境消毒,其中亚氯酸钠(NaClO2)是一种重要的消毒剂。试计算:
(1)亚氯酸钠的相对分子质量为 。
(2)亚氯酸钠中氧元素的质量分数为 。
(3)若要配制质量分数为15%的亚氯酸钠溶液200kg用于环境消毒,则需要亚氯酸钠多少kg,同时需要水多少mL?
20.如图是甲、乙两种物质的溶解度曲线,请回答下列问题。
(1)将接近饱和的乙溶液变成饱和溶液的方法是 。
(2)t2℃时,将50g甲物质加入50g水中,充分搅拌后形成的溶液的溶质质量分数是 。
(3)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,此时甲溶液的溶质质量分数 乙溶液的溶质质量分数。(填“< ”或“=”或“>”)
21.如图是三种物质的溶解度曲线,则
(1)当t2℃<t℃<t3℃时,三种物质的溶解度大小顺序为
(2)将t3℃时,等质量的三种物质饱和溶液降温到t1℃时,析出晶体最多的是
(3)在t2℃时,用50g水配制A的饱和溶液,用100g水配制C的饱和溶液,两种溶液中溶质的质量分数大小关系是 .
22.下图为甲、乙、丙三种物质的溶解度曲线。
(1)t3℃时,甲、乙、丙三种物质中,溶解度由小到大的顺序是 .P点所表示的含义为 。
(2)t3℃时,将40g甲物质加入到50g水中,所得溶液的质量为 ;
(3)t3℃时,将等质量甲和乙的饱和溶液降温到t2℃,所得溶液质量大小关系为:甲 乙(填“<”、“>”或“=”);
(4)将t1℃时丙的不饱和溶液变为饱和溶液可采取的方法为 (填一种即可)。
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】C
4.【答案】B
5.【答案】B
6.【答案】D
7.【答案】A
8.【答案】A
9.【答案】C
10.【答案】A
11.【答案】B
12.【答案】D
13.【答案】(1)>
(2)50
14.【答案】190;60;固体;大于
15.【答案】>;100
16.【答案】冷却热饱和溶液(或降温结晶法);丙>乙>甲;85
17.【答案】C;C;t3;A=B>C
18.【答案】加入溶质;降温结晶;③④
19.【答案】(1)90.5
(2)35.4%
(3)解:要配制质量分数为15%的亚氯酸钠200kg,需要亚硝酸钠的质量为:200kg×15%=30kg,需要水的质量是200kg-30kg=170kg=1.7×105g,由于水的密度是1g/cm3,所以需要水的体积是1.7×105mL= 170000mL.
答:需要亚氯酸钠170kg,同时需要水170000mL.
20.【答案】(1)加溶质(蒸发溶剂、升高温度)
(2)47.4%
(3)>
21.【答案】(1)B>A>C
(2)A
(3)相等
22.【答案】(1)丙<乙<甲;在t2℃时,甲和乙的溶解度相同
(2)80g
(3)<
(4)乙加入丙物质或蒸发水
同课章节目录
