3.1 物质的聚集状态与晶体的常识 课件(共39张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.1 物质的聚集状态与晶体的常识 课件(共39张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-06 00:00:00 | ||
图片预览








文档简介
(共39张PPT)
第一节
物质的聚集状态与晶体的常识
物质的聚集状态
与晶体的常识
第三章 晶体结构与性质
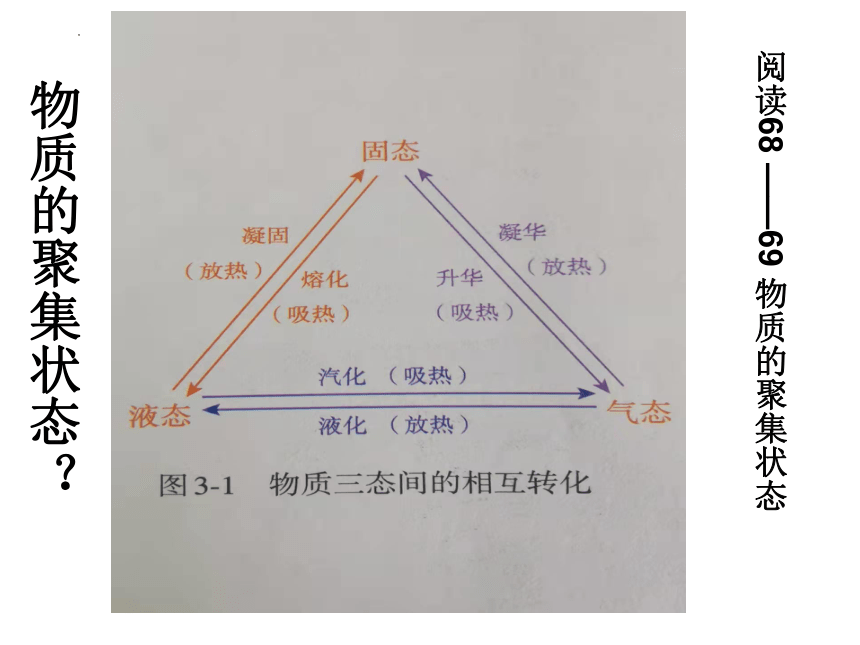
阅读68 ——69 物质的聚集状态
物质的聚集状态?
一、物质的聚集状态
1、物质的聚集状态:
固态、液态(离子液体)、气态(等离子体);
晶态、非晶态;塑晶态、液晶态。
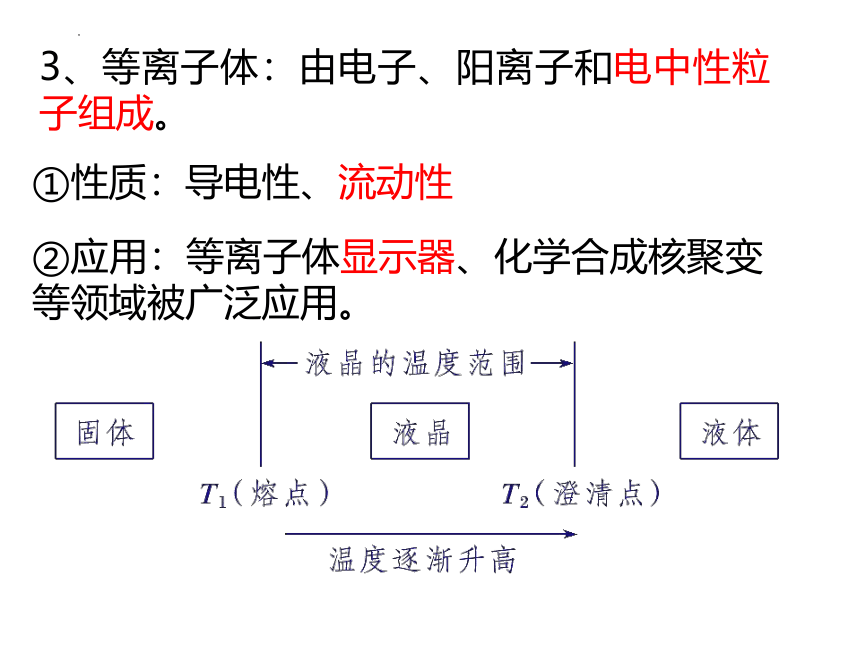
2、液晶:介于液态和晶态之间的物质状态。
①分类:热致液晶和溶致液晶。
②性质:既具有液体的流动性、黏度、形变性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性(P72)。
③应用:液晶显示器、高强度液晶纤维。
3、等离子体:由电子、阳离子和电中性粒子组成。
①性质:导电性、流动性
②应用:等离子体显示器、化学合成核聚变等领域被广泛应用。
胆矾
明矾晶体
冰糖晶体
水晶
水晶石
世界上最大的钻石——“库利南”
绿宝石
紫水晶
黄 水 晶
黄 水 晶
晶体:固态离子化合物、冰、金属、宝石、水晶、大部分矿石
非晶体:玻璃及玻璃态物质、橡胶、松香
二、晶体与非晶体
1.晶体与非晶体的本质差异
固体 自范性 微观结构
晶体 (能自发呈现 外形) 原子在三维空间里呈_______ 有序排列
非晶体 (不能自发呈现多面体外形) 原子排列相对_____
有
多面体
无
周期性
无序
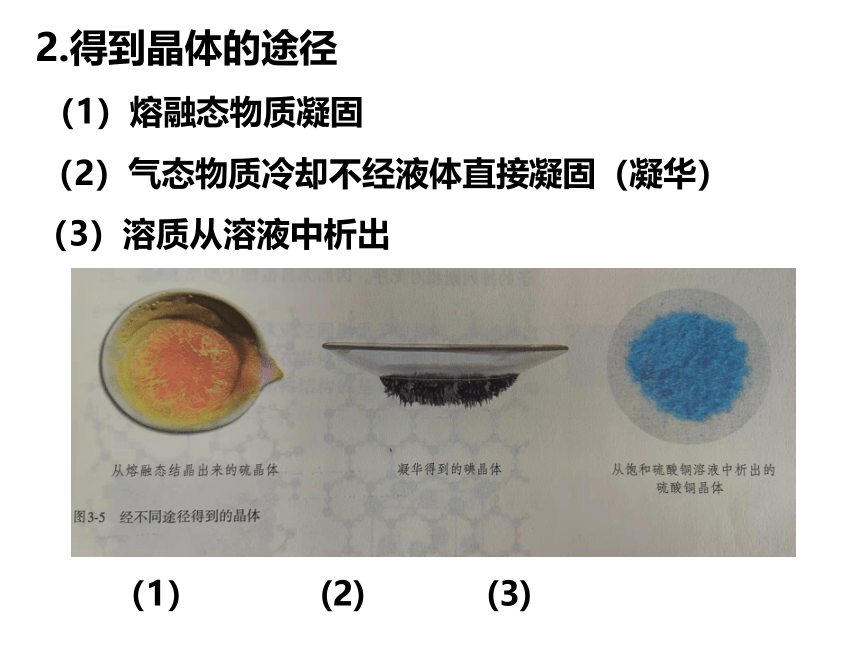
2.得到晶体的途径
(1)熔融态物质凝固
(2)气态物质冷却不经液体直接凝固(凝华)
(3)溶质从溶液中析出
(1) (2) (3)
3.晶体的特性
(1)自范性:晶体能自发地呈现 外形的性质。
(2)各向异性:晶体在不同方向上表现出不同的 。(硬度、熔点、折光率)
(3)固定的 。
多面体
物理性质
熔点
4.晶体与非晶体的区分方法
(1)测熔点(晶体熔点固定)
(4)X射线衍射实验(可靠方法)
(2)测硬度
(3)测折光率
【思考与讨论】 P72
(1)再看玻璃的结构示意图
如图所示,这张图说明
玻璃是不是晶体 为什么
不是,玻璃中粒子质点
排列无序,没有晶体的自范性。
1、各向异性:(1)硬度:刻划玻璃 (2)熔点(3)折光率
(2)根据晶体物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举出一些可能有效的方法鉴别假宝石吗
2、X-射线衍射实验
晶体SiO2和非晶体SiO2的投影示意图
周期性有序有序排列
玻璃结构示意图
B
O
Si
M
粒子排列是否有序
太麻烦
三、晶胞
1.晶胞定义:描述晶体结构的基本单元叫做晶胞
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定。
金刚石的多面体外形、晶体结构和晶胞示意图
NaCl晶体结构和晶胞
思考与交流:上述铜晶体、金刚石、NaCl晶体的晶胞空间构形是怎样的?
平行六面体
无隙并置
2、晶胞结构特点:晶胞一般是平行六面体,整块晶体可看作数量巨大的晶胞“无隙并置”而成(晶胞间无任何间隙,平行排列,取向相同,晶胞可以平移重合)
3、三种典型立方晶体结构
体心立方
简单立方
面心立方
思考:
铜晶胞含有4个铜原子,为什么不是14个?
4、晶胞中原子个数的计算
无隙并置
顶点:八个晶胞共用
无隙并置
棱边:四个晶胞共用
面心:两个晶胞共用
晶胞中原子个数的计算
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
小结:晶胞对质点的占有率
【思考与讨论】P74
图3-11依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子
钠、锌晶胞都是:8×1/8+1=2
碘:(8×1/8+6×1/2)×2=8
金刚石:8×1/8+6×1/2+4=8
小结:晶胞是八个顶角相同,三套各4根平行棱分别相同,三套各两个平行面分别相同的最小平行六面体。(晶胞可以平移重合)
例:判断下列六面体是否是晶胞?
四、晶体结构的测定
——X射线衍射实验
【阅读】P 75-76 图3-12 3-13 3-14
3-15 3-16
1.常用仪器: 。
2.测定过程:当单一波长的X射线通过晶体时,X射线和晶体中的 相互作用,会在记录仪上产生 或者 。
3.作用:根据衍射图,经过计算可以获得晶体结构的有关信息。
X射线衍射仪
电子
明锐的衍射峰
分立的斑点
包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置、化学键及键参数等。
小结:
1、晶体——具有规则几何外形的固体
2、特性:
(1)晶体有自范性(条件:晶体生长速率适当)
(2)晶体具有各向异性
(3)晶体具有固定的熔点
3、晶体与非晶体的本质区别在于——构成固体的粒子在三维空间里是否呈现周期性的有序排列
6、晶体和非晶体的鉴别
7、晶体结构的测定—X射线衍射
4、晶体形成的途径:
5、晶胞中原子个数的计算
练习2、2001年报道的硼和镁形成的化合物刷新了
金属化合物超导温度的最高记录。如图所示的是
该化合物的晶体结构单元:镁原子间形成正六棱
柱,且棱柱的上下底面还各有1个镁原子,6个硼
原子位于棱柱内。则该化合物的化学式可表示为
A、MgB B、MgB2 C、Mg2B D、Mg3B2
典例分析
Mg原子的数目:
12×1/6+2×1/2=3
B原子的数目:6
故化学式可表示为
MgB2
典例分析
练习3、右面图形是石墨晶体的层面结构图,
试分析图形推测层面上每个正六边型拥有的
共价键数和碳原子数是分别:
A、6,6 B、2,4 C、2,3 D、3,2
NaCl晶体结构示意图:
Na+
Cl-
干冰晶体结构
金刚石晶体
结构示意图
第一节
物质的聚集状态与晶体的常识
物质的聚集状态
与晶体的常识
第三章 晶体结构与性质
阅读68 ——69 物质的聚集状态
物质的聚集状态?
一、物质的聚集状态
1、物质的聚集状态:
固态、液态(离子液体)、气态(等离子体);
晶态、非晶态;塑晶态、液晶态。
2、液晶:介于液态和晶态之间的物质状态。
①分类:热致液晶和溶致液晶。
②性质:既具有液体的流动性、黏度、形变性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性(P72)。
③应用:液晶显示器、高强度液晶纤维。
3、等离子体:由电子、阳离子和电中性粒子组成。
①性质:导电性、流动性
②应用:等离子体显示器、化学合成核聚变等领域被广泛应用。
胆矾
明矾晶体
冰糖晶体
水晶
水晶石
世界上最大的钻石——“库利南”
绿宝石
紫水晶
黄 水 晶
黄 水 晶
晶体:固态离子化合物、冰、金属、宝石、水晶、大部分矿石
非晶体:玻璃及玻璃态物质、橡胶、松香
二、晶体与非晶体
1.晶体与非晶体的本质差异
固体 自范性 微观结构
晶体 (能自发呈现 外形) 原子在三维空间里呈_______ 有序排列
非晶体 (不能自发呈现多面体外形) 原子排列相对_____
有
多面体
无
周期性
无序
2.得到晶体的途径
(1)熔融态物质凝固
(2)气态物质冷却不经液体直接凝固(凝华)
(3)溶质从溶液中析出
(1) (2) (3)
3.晶体的特性
(1)自范性:晶体能自发地呈现 外形的性质。
(2)各向异性:晶体在不同方向上表现出不同的 。(硬度、熔点、折光率)
(3)固定的 。
多面体
物理性质
熔点
4.晶体与非晶体的区分方法
(1)测熔点(晶体熔点固定)
(4)X射线衍射实验(可靠方法)
(2)测硬度
(3)测折光率
【思考与讨论】 P72
(1)再看玻璃的结构示意图
如图所示,这张图说明
玻璃是不是晶体 为什么
不是,玻璃中粒子质点
排列无序,没有晶体的自范性。
1、各向异性:(1)硬度:刻划玻璃 (2)熔点(3)折光率
(2)根据晶体物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举出一些可能有效的方法鉴别假宝石吗
2、X-射线衍射实验
晶体SiO2和非晶体SiO2的投影示意图
周期性有序有序排列
玻璃结构示意图
B
O
Si
M
粒子排列是否有序
太麻烦
三、晶胞
1.晶胞定义:描述晶体结构的基本单元叫做晶胞
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定。
金刚石的多面体外形、晶体结构和晶胞示意图
NaCl晶体结构和晶胞
思考与交流:上述铜晶体、金刚石、NaCl晶体的晶胞空间构形是怎样的?
平行六面体
无隙并置
2、晶胞结构特点:晶胞一般是平行六面体,整块晶体可看作数量巨大的晶胞“无隙并置”而成(晶胞间无任何间隙,平行排列,取向相同,晶胞可以平移重合)
3、三种典型立方晶体结构
体心立方
简单立方
面心立方
思考:
铜晶胞含有4个铜原子,为什么不是14个?
4、晶胞中原子个数的计算
无隙并置
顶点:八个晶胞共用
无隙并置
棱边:四个晶胞共用
面心:两个晶胞共用
晶胞中原子个数的计算
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
小结:晶胞对质点的占有率
【思考与讨论】P74
图3-11依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子
钠、锌晶胞都是:8×1/8+1=2
碘:(8×1/8+6×1/2)×2=8
金刚石:8×1/8+6×1/2+4=8
小结:晶胞是八个顶角相同,三套各4根平行棱分别相同,三套各两个平行面分别相同的最小平行六面体。(晶胞可以平移重合)
例:判断下列六面体是否是晶胞?
四、晶体结构的测定
——X射线衍射实验
【阅读】P 75-76 图3-12 3-13 3-14
3-15 3-16
1.常用仪器: 。
2.测定过程:当单一波长的X射线通过晶体时,X射线和晶体中的 相互作用,会在记录仪上产生 或者 。
3.作用:根据衍射图,经过计算可以获得晶体结构的有关信息。
X射线衍射仪
电子
明锐的衍射峰
分立的斑点
包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置、化学键及键参数等。
小结:
1、晶体——具有规则几何外形的固体
2、特性:
(1)晶体有自范性(条件:晶体生长速率适当)
(2)晶体具有各向异性
(3)晶体具有固定的熔点
3、晶体与非晶体的本质区别在于——构成固体的粒子在三维空间里是否呈现周期性的有序排列
6、晶体和非晶体的鉴别
7、晶体结构的测定—X射线衍射
4、晶体形成的途径:
5、晶胞中原子个数的计算
练习2、2001年报道的硼和镁形成的化合物刷新了
金属化合物超导温度的最高记录。如图所示的是
该化合物的晶体结构单元:镁原子间形成正六棱
柱,且棱柱的上下底面还各有1个镁原子,6个硼
原子位于棱柱内。则该化合物的化学式可表示为
A、MgB B、MgB2 C、Mg2B D、Mg3B2
典例分析
Mg原子的数目:
12×1/6+2×1/2=3
B原子的数目:6
故化学式可表示为
MgB2
典例分析
练习3、右面图形是石墨晶体的层面结构图,
试分析图形推测层面上每个正六边型拥有的
共价键数和碳原子数是分别:
A、6,6 B、2,4 C、2,3 D、3,2
NaCl晶体结构示意图:
Na+
Cl-
干冰晶体结构
金刚石晶体
结构示意图
