第九单元实验活动5一定溶质质量分数的氯化钠溶液的配制课件(26页)
文档属性
| 名称 | 第九单元实验活动5一定溶质质量分数的氯化钠溶液的配制课件(26页) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
溶液的配制
一定溶质质量分数的氯化钠溶液的配制
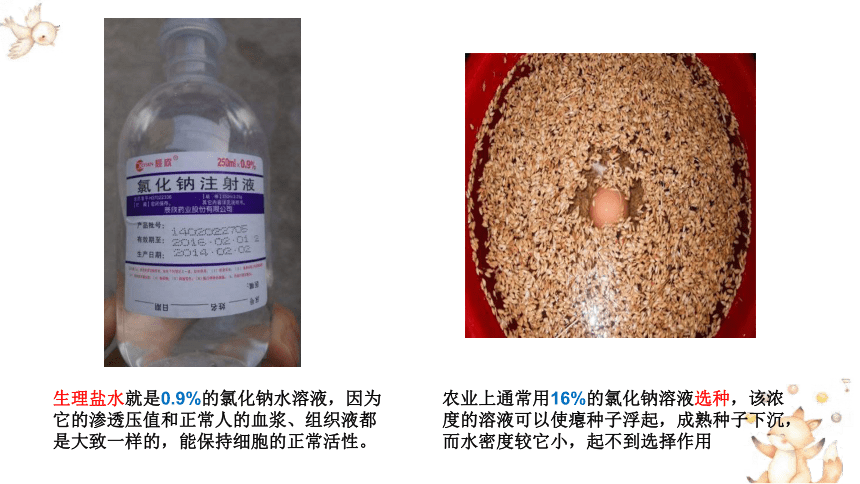
农业上通常用16%的氯化钠溶液选种,该浓度的溶液可以使瘪种子浮起,成熟种子下沉,而水密度较它小,起不到选择作用
生理盐水就是0.9%的氯化钠水溶液,因为它的渗透压值和正常人的血浆、组织液都是大致一样的,能保持细胞的正常活性。
实验步骤
配置质量分数为6%的氯化钠溶液
(1)计算:配制20g质量分数为6%的氯化钠溶液所需的氯化钠和水的质量分别为:氯化钠_____g;水_____g.
依据:
溶质质量 =
溶液质量
溶质的质量分数
×
溶剂质量 = 溶液质量-溶质质量
1.2
18.8
(2)称量:用托盘天平称量所需的氯化钠的质量,放入烧杯中。
左物右码。
左右各放同样的纸片。
防止药品被污染
先调节砝码或游码,再逐渐加入药品直至天平平衡
天平的使用
注:砝码和物品放反(使用游码),
导致称量的药品的质量偏少。
砝码质量-游码质量=固体质量
配得溶液浓度偏小
注:称量一定质量的固体时,若过程中天平不平衡,只能改变固体的质量,不能移动游码或者砝码。
天平的使用
1.砝码和物品放反(使用游码)
2.称量氯化钠含杂质
3.称量时使用的砝码生锈
4.称量固体时,左盘放了纸片,右盘没有
浓度偏小
浓度偏小
浓度偏大
浓度偏小
误差分析
(3)量取:用量筒量取所需的水(水的密度近似看作1g/cm3),倒入盛有氯化钠的烧杯中。(需用水47g)
① 计算需要水的体积:
溶剂体积 = 溶剂质量÷溶剂密度
② 用量筒量取一定体积的水
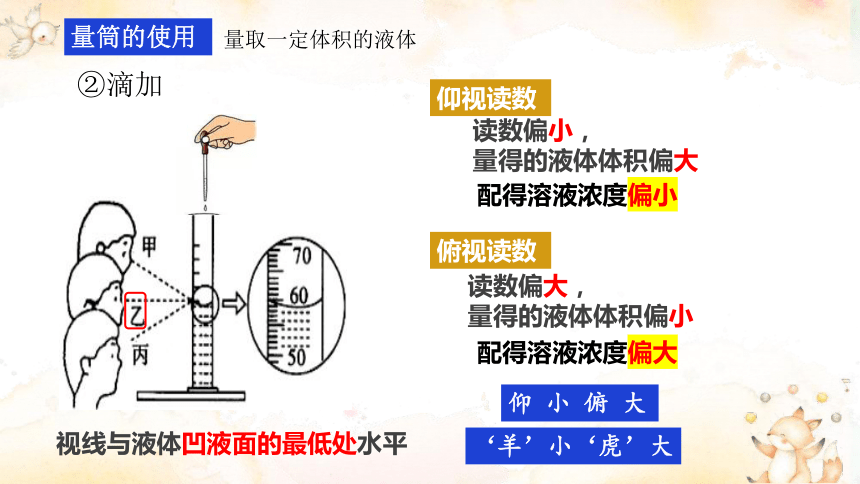
量筒的使用
① 倾倒
量取一定体积的液体
视线与液体凹液面的最低处水平
仰视读数
读数偏小,
量得的液体体积偏大
②滴加
量取一定体积的液体
俯视读数
读数偏大,
量得的液体体积偏小
配得溶液浓度偏小
配得溶液浓度偏大
量筒的使用
‘羊’小‘虎’大
仰 小 俯 大
(4)溶解:先加固体,再加液体;用玻璃棒搅拌,使氯化钠溶解。
玻璃棒的作用:
搅拌,加速溶解
(4)溶解:
1.倾倒固体时,药品撒到烧杯外:
溶液浓度偏小
溶液浓度偏大
2.倾倒水时,水撒到烧杯外:
3.搅拌后,溶液撒到烧杯外:
溶液浓度无影响
实验探究1
(5)装瓶,贴标签
转移中,溶液撒到烧杯外
溶液浓度无影响
误差分析
溶质的质量分数= ×100%
溶质的质量
溶液的质量
结果偏大的原因(溶质偏多或溶剂偏少)
结果偏小的原因(溶质偏少或溶剂偏多)
注意:配置好溶液后转移过程中洒落不影响溶质质量分数。
(溶液的均一性)
学以致用
1.(2021·江西)用氯化钠固体配制50 g质量分数为6%的溶液,
不需要用到的仪器是( )
c
学以致用
2.欲配制20%的氯化钠溶液50 g,部分操作如图所示,正确的是( )
B
20%
某同学欲配制50g质量分数为9%的氯化钠溶液,全部操作过程如下图所示,看图回答下列问题:
(1)称量时,应称取 g食盐;把水的密度近似地看作1g/mL,则须量取 mL水。如果有10mL、50mL和100mL的量筒,最好选取 mL的量筒。
(2)实验中使用玻璃棒的目的是 。
(3)如果所配得的溶液溶质的质量分数小于9%,你认为可能的原因有(写一条): 。
实验室需要配制15%的氯化钠溶液50g。
(1)计算:需要氯化钠的质量为 。
(2)某同学按下图所示步骤依次操作: 。
其中操作错误的步骤是 (填字母序号);B中仪器的名为 。
(3)若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 。
(4)经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。
①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
知该实验要配
现在需要配制3%的氯化钠溶液,但是实验室没有氯化钠固体,只有刚配置好的6%的氯化钠溶液,聪明的你能想出解决办法吗?
稀释
实验仪器
托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
稀释配置质量分数为3%的氯化钠溶液
实验过程
稀释配置质量分数为3%的氯化钠溶液
(1)计算:配制20g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液_____g(体积____ml);水_____g,即_____ml。
由浓溶液配制稀溶液时,计算的依据是什么?
依据:稀释过程中,溶质质量不变
10
9.6
10
10
(2)量取:用量筒量取氯化钠溶液9.6ml,水10ml,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将配置好的氯化钠溶液装入试剂瓶,盖好瓶塞,并贴上标签。
稀释配置质量分数为3%的氯化钠溶液
1.称量氯化钠溶液时仰视读数
溶液浓度偏大
2.称量水时仰视读数
溶液浓度偏小
3.称量氯化钠溶液时俯视读数
4.称量水时俯视读数
溶液浓度偏大
溶液浓度偏小
误差分析
稀释配置质量分数为3%的氯化钠溶液
‘农业’附小
‘浓液俯小’
如要将100g溶质质量分数为20%的硝酸钾溶液变为溶质质量分数为10%的硝酸钾溶液,能达到目的的操作是 ( )
A.将水的质量增加一倍
B.加水使溶液质量增加一倍
C.将溶液倒掉一半
D.将溶质取走一半
某注射用药液的配制方法如下:
①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
③取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
④取0.4mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看做1g/cm 。则最终得到的药液(溶液d)中溶质的质量分数为 。
谢谢!
溶液的配制
一定溶质质量分数的氯化钠溶液的配制
农业上通常用16%的氯化钠溶液选种,该浓度的溶液可以使瘪种子浮起,成熟种子下沉,而水密度较它小,起不到选择作用
生理盐水就是0.9%的氯化钠水溶液,因为它的渗透压值和正常人的血浆、组织液都是大致一样的,能保持细胞的正常活性。
实验步骤
配置质量分数为6%的氯化钠溶液
(1)计算:配制20g质量分数为6%的氯化钠溶液所需的氯化钠和水的质量分别为:氯化钠_____g;水_____g.
依据:
溶质质量 =
溶液质量
溶质的质量分数
×
溶剂质量 = 溶液质量-溶质质量
1.2
18.8
(2)称量:用托盘天平称量所需的氯化钠的质量,放入烧杯中。
左物右码。
左右各放同样的纸片。
防止药品被污染
先调节砝码或游码,再逐渐加入药品直至天平平衡
天平的使用
注:砝码和物品放反(使用游码),
导致称量的药品的质量偏少。
砝码质量-游码质量=固体质量
配得溶液浓度偏小
注:称量一定质量的固体时,若过程中天平不平衡,只能改变固体的质量,不能移动游码或者砝码。
天平的使用
1.砝码和物品放反(使用游码)
2.称量氯化钠含杂质
3.称量时使用的砝码生锈
4.称量固体时,左盘放了纸片,右盘没有
浓度偏小
浓度偏小
浓度偏大
浓度偏小
误差分析
(3)量取:用量筒量取所需的水(水的密度近似看作1g/cm3),倒入盛有氯化钠的烧杯中。(需用水47g)
① 计算需要水的体积:
溶剂体积 = 溶剂质量÷溶剂密度
② 用量筒量取一定体积的水
量筒的使用
① 倾倒
量取一定体积的液体
视线与液体凹液面的最低处水平
仰视读数
读数偏小,
量得的液体体积偏大
②滴加
量取一定体积的液体
俯视读数
读数偏大,
量得的液体体积偏小
配得溶液浓度偏小
配得溶液浓度偏大
量筒的使用
‘羊’小‘虎’大
仰 小 俯 大
(4)溶解:先加固体,再加液体;用玻璃棒搅拌,使氯化钠溶解。
玻璃棒的作用:
搅拌,加速溶解
(4)溶解:
1.倾倒固体时,药品撒到烧杯外:
溶液浓度偏小
溶液浓度偏大
2.倾倒水时,水撒到烧杯外:
3.搅拌后,溶液撒到烧杯外:
溶液浓度无影响
实验探究1
(5)装瓶,贴标签
转移中,溶液撒到烧杯外
溶液浓度无影响
误差分析
溶质的质量分数= ×100%
溶质的质量
溶液的质量
结果偏大的原因(溶质偏多或溶剂偏少)
结果偏小的原因(溶质偏少或溶剂偏多)
注意:配置好溶液后转移过程中洒落不影响溶质质量分数。
(溶液的均一性)
学以致用
1.(2021·江西)用氯化钠固体配制50 g质量分数为6%的溶液,
不需要用到的仪器是( )
c
学以致用
2.欲配制20%的氯化钠溶液50 g,部分操作如图所示,正确的是( )
B
20%
某同学欲配制50g质量分数为9%的氯化钠溶液,全部操作过程如下图所示,看图回答下列问题:
(1)称量时,应称取 g食盐;把水的密度近似地看作1g/mL,则须量取 mL水。如果有10mL、50mL和100mL的量筒,最好选取 mL的量筒。
(2)实验中使用玻璃棒的目的是 。
(3)如果所配得的溶液溶质的质量分数小于9%,你认为可能的原因有(写一条): 。
实验室需要配制15%的氯化钠溶液50g。
(1)计算:需要氯化钠的质量为 。
(2)某同学按下图所示步骤依次操作: 。
其中操作错误的步骤是 (填字母序号);B中仪器的名为 。
(3)若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 。
(4)经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。
①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
知该实验要配
现在需要配制3%的氯化钠溶液,但是实验室没有氯化钠固体,只有刚配置好的6%的氯化钠溶液,聪明的你能想出解决办法吗?
稀释
实验仪器
托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
稀释配置质量分数为3%的氯化钠溶液
实验过程
稀释配置质量分数为3%的氯化钠溶液
(1)计算:配制20g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液_____g(体积____ml);水_____g,即_____ml。
由浓溶液配制稀溶液时,计算的依据是什么?
依据:稀释过程中,溶质质量不变
10
9.6
10
10
(2)量取:用量筒量取氯化钠溶液9.6ml,水10ml,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将配置好的氯化钠溶液装入试剂瓶,盖好瓶塞,并贴上标签。
稀释配置质量分数为3%的氯化钠溶液
1.称量氯化钠溶液时仰视读数
溶液浓度偏大
2.称量水时仰视读数
溶液浓度偏小
3.称量氯化钠溶液时俯视读数
4.称量水时俯视读数
溶液浓度偏大
溶液浓度偏小
误差分析
稀释配置质量分数为3%的氯化钠溶液
‘农业’附小
‘浓液俯小’
如要将100g溶质质量分数为20%的硝酸钾溶液变为溶质质量分数为10%的硝酸钾溶液,能达到目的的操作是 ( )
A.将水的质量增加一倍
B.加水使溶液质量增加一倍
C.将溶液倒掉一半
D.将溶质取走一半
某注射用药液的配制方法如下:
①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
③取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
④取0.4mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看做1g/cm 。则最终得到的药液(溶液d)中溶质的质量分数为 。
谢谢!
同课章节目录
