化学人教版(2019)必修第二册5.1.2硫酸及硫酸盐(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.2硫酸及硫酸盐(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 27.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-06 15:48:18 | ||
图片预览








文档简介
(共20张PPT)
5.1 硫及其化合物
第2课时 硫酸及硫酸盐
新课导入
最为低等的瓷器做旧手段
俗话说盛世古董,乱世黄金,古陶瓷的收藏是比较热门的一类,而有些人在利益的驱使下,就会烧制大量的仿古瓷器,然后用做旧来把这些仿古瓷做旧,得以获取暴利,而高锰酸钾加浓硫酸(做色)就是很多瓷器造假者最为常用的手段之一。
2KMnO4 + H2SO4(浓) Mn2O7 + H2O + 2KHSO4
化学方程式:
那么,浓硫酸到底有哪些性质呢?
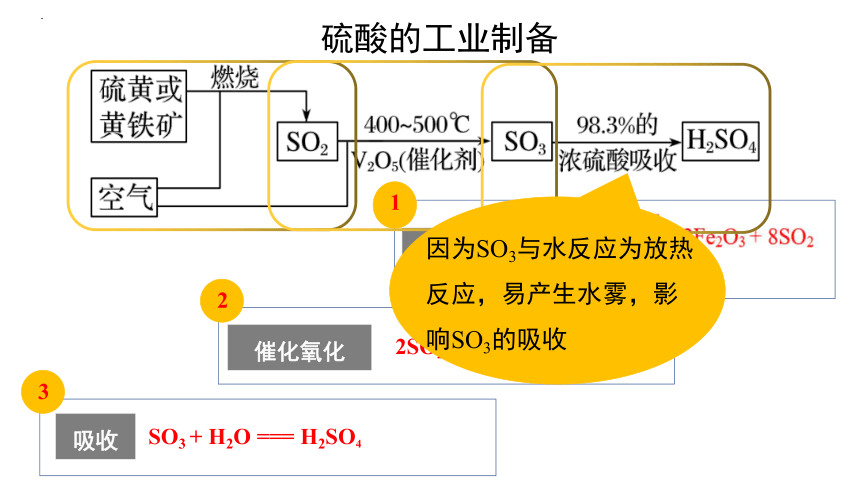
硫酸的工业制备
硫黄
黄铁矿
硫酸的工业制备
或
1
燃烧
催化氧化
2
吸收
3
SO3 + H2O === H2SO4
2SO2 + O2 2SO3
催化剂
因为SO3与水反应为放热反应,易产生水雾,影响SO3的吸收
回顾旧知
稀硫酸具有哪些化学性质?为什么具有这些性质?
石蕊变红
与活泼金属 (如Fe )
与碱 [如Mg(OH)2]
与碱性氧化物(如MgO)
与盐(如Na2CO3)
Fe+2H+===Fe2++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2++2H2O
与指示剂显色
硫酸是二元强酸
稀硫酸
H+
SO42-
H+
H+
SO42-
H+
H2SO4
H2SO4
H2SO4
H2SO4
H2SO4
稀硫酸
稀硫酸
浓硫酸
酸入水、沿器壁、缓慢倒、不断搅
稀释时,操作要领:
杯壁下流
浓硫酸能将有机物中的氢、氧元素按水的组成比脱去,这个过程体现了浓硫酸的脱水性。
资料卡片——脱水性
生成的黑色物质是什么?该过程体现了浓硫酸的什么性质
实验探究
C12H22O11
蔗糖
浓硫酸
12 C
+ 11H2O
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性
思考讨论
吸水性
吸水性与脱水性
气体、液体中的游离水或者固体中的结晶水
水是
水是
吸水性
脱水性
有机物中的H、O原子按个数比2∶ 1脱去生成的水
有H2O存在
无H2O存在
有水为吸 无水则脱
关键看:是否有“现成 ”的水
黑色物质体积急剧膨胀,长成黑色面包的原因是什么
实验探究
有刺激性气味的气体的主要成分是什么 请推测产物,并设计实验方案验证。
化合价降低
化合价升高
实验探究
设计实验,验证木炭和浓硫酸共热生成产生CO2、SO2和H2O。
提供以下试剂与装置(装置可多次使用)
木炭和浓硫酸
澄清石灰水
酸性高锰酸钾溶液
品红溶液
无水硫酸铜
1
5
3
4
2
强氧化性
浓硫酸具有强氧化性,能氧化不活泼的非金属,如碳。那么能氧化排在氢后面的不活泼的金属吗?
提出问题
实验探究
d将a试管里的溶液慢慢倒入水中,溶液变为蓝色。
a试管中铜丝表面变黑,有气泡逸出;
b试管中的品红溶液逐渐变为无色;
c试管中的紫色石蕊溶液逐渐变为红色;
实验现象
Cu+ H2SO4(浓)
CuSO4
+SO2↑
0
+2
+6
+4
化合价升高
化合价降低
2
+2H2O
2.铜和浓硫酸的反应需要什么条件
实验探究
3.随着反应的进行,硫酸的浓度逐渐减低,反应是否会继续进行?
1.该反应体现了浓硫酸的什么性质?
Cu+2H2SO4(浓) ===CuSO4+SO2↑+2H2O
酸性和强氧化性
稀硫酸和铜不反应。
4.可抽动的铜丝有什么作用?
控制反应的发生和停止
5.试管口浸NaOH溶液的棉团有什么作用?
吸收多余的SO2,以防污染环境
硫酸盐
胆矾
硫酸钙
硫酸钡
稀H2SO4 浓H2SO4
存在微粒
酸性
氧化性
脱水性
吸水性
归纳与整理
稀、浓H2SO4性质的差异
H+、SO42-
有
H+的弱氧化性
无
无
有
有
有
H2SO4分子
+6价S的强氧化性
浓硫酸
1
2
吸水性
脱水性
小结
3
强氧化性
与金属反应
与非金属反应
加热条件下,与大多数金属反应
常温下,使铁、铝钝化
还原性气体:H2S、HBr、HI
不能干燥
碱性气体:NH3
C12H22O11
蔗糖
浓硫酸
12 C
+ 11H2O
1.下列现象与用途和浓硫酸的脱水性有关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸加到蔗糖中,蔗糖变黑
C.浓硫酸加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与铜反应制取二氧化硫
2.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜晶体 B.木材炭化
C.红热木炭 D.氧化铝
C
B
随堂演练
课后作业
练习与应用P10第3—4题
5.1 硫及其化合物
第2课时 硫酸及硫酸盐
新课导入
最为低等的瓷器做旧手段
俗话说盛世古董,乱世黄金,古陶瓷的收藏是比较热门的一类,而有些人在利益的驱使下,就会烧制大量的仿古瓷器,然后用做旧来把这些仿古瓷做旧,得以获取暴利,而高锰酸钾加浓硫酸(做色)就是很多瓷器造假者最为常用的手段之一。
2KMnO4 + H2SO4(浓) Mn2O7 + H2O + 2KHSO4
化学方程式:
那么,浓硫酸到底有哪些性质呢?
硫酸的工业制备
硫黄
黄铁矿
硫酸的工业制备
或
1
燃烧
催化氧化
2
吸收
3
SO3 + H2O === H2SO4
2SO2 + O2 2SO3
催化剂
因为SO3与水反应为放热反应,易产生水雾,影响SO3的吸收
回顾旧知
稀硫酸具有哪些化学性质?为什么具有这些性质?
石蕊变红
与活泼金属 (如Fe )
与碱 [如Mg(OH)2]
与碱性氧化物(如MgO)
与盐(如Na2CO3)
Fe+2H+===Fe2++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2++2H2O
与指示剂显色
硫酸是二元强酸
稀硫酸
H+
SO42-
H+
H+
SO42-
H+
H2SO4
H2SO4
H2SO4
H2SO4
H2SO4
稀硫酸
稀硫酸
浓硫酸
酸入水、沿器壁、缓慢倒、不断搅
稀释时,操作要领:
杯壁下流
浓硫酸能将有机物中的氢、氧元素按水的组成比脱去,这个过程体现了浓硫酸的脱水性。
资料卡片——脱水性
生成的黑色物质是什么?该过程体现了浓硫酸的什么性质
实验探究
C12H22O11
蔗糖
浓硫酸
12 C
+ 11H2O
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性
思考讨论
吸水性
吸水性与脱水性
气体、液体中的游离水或者固体中的结晶水
水是
水是
吸水性
脱水性
有机物中的H、O原子按个数比2∶ 1脱去生成的水
有H2O存在
无H2O存在
有水为吸 无水则脱
关键看:是否有“现成 ”的水
黑色物质体积急剧膨胀,长成黑色面包的原因是什么
实验探究
有刺激性气味的气体的主要成分是什么 请推测产物,并设计实验方案验证。
化合价降低
化合价升高
实验探究
设计实验,验证木炭和浓硫酸共热生成产生CO2、SO2和H2O。
提供以下试剂与装置(装置可多次使用)
木炭和浓硫酸
澄清石灰水
酸性高锰酸钾溶液
品红溶液
无水硫酸铜
1
5
3
4
2
强氧化性
浓硫酸具有强氧化性,能氧化不活泼的非金属,如碳。那么能氧化排在氢后面的不活泼的金属吗?
提出问题
实验探究
d将a试管里的溶液慢慢倒入水中,溶液变为蓝色。
a试管中铜丝表面变黑,有气泡逸出;
b试管中的品红溶液逐渐变为无色;
c试管中的紫色石蕊溶液逐渐变为红色;
实验现象
Cu+ H2SO4(浓)
CuSO4
+SO2↑
0
+2
+6
+4
化合价升高
化合价降低
2
+2H2O
2.铜和浓硫酸的反应需要什么条件
实验探究
3.随着反应的进行,硫酸的浓度逐渐减低,反应是否会继续进行?
1.该反应体现了浓硫酸的什么性质?
Cu+2H2SO4(浓) ===CuSO4+SO2↑+2H2O
酸性和强氧化性
稀硫酸和铜不反应。
4.可抽动的铜丝有什么作用?
控制反应的发生和停止
5.试管口浸NaOH溶液的棉团有什么作用?
吸收多余的SO2,以防污染环境
硫酸盐
胆矾
硫酸钙
硫酸钡
稀H2SO4 浓H2SO4
存在微粒
酸性
氧化性
脱水性
吸水性
归纳与整理
稀、浓H2SO4性质的差异
H+、SO42-
有
H+的弱氧化性
无
无
有
有
有
H2SO4分子
+6价S的强氧化性
浓硫酸
1
2
吸水性
脱水性
小结
3
强氧化性
与金属反应
与非金属反应
加热条件下,与大多数金属反应
常温下,使铁、铝钝化
还原性气体:H2S、HBr、HI
不能干燥
碱性气体:NH3
C12H22O11
蔗糖
浓硫酸
12 C
+ 11H2O
1.下列现象与用途和浓硫酸的脱水性有关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸加到蔗糖中,蔗糖变黑
C.浓硫酸加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与铜反应制取二氧化硫
2.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜晶体 B.木材炭化
C.红热木炭 D.氧化铝
C
B
随堂演练
课后作业
练习与应用P10第3—4题
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
