【备考2023】浙教版科学中考第二轮复习讲义第18讲:溶液【word,含答案】
文档属性
| 名称 | 【备考2023】浙教版科学中考第二轮复习讲义第18讲:溶液【word,含答案】 |
|
|
| 格式 | doc | ||
| 文件大小 | 784.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-06 00:00:00 | ||
图片预览



文档简介
一、物质的溶解
1. 溶液的组成及特征
(1)概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
(3)特征:均一性、稳定性、混合物。
2. 物质溶解时的吸热或放热现象
3. 除污方法及原理
二、饱和溶液与不饱和溶液
1. 饱和溶液与不饱和溶液的判断
2. 饱和溶液和不饱和溶液的转化
(1)对于大多数固体(溶解度随温度升高而增大的物质,如KNO3):
三、溶解度及溶解度曲线
1. 固体的溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,单位为“g”。
(2)影响因素,内因:溶质和溶质的性质;外因:温度。
(3)物质溶解度与溶解性的关系
四、溶质质量分数的计算
1. 溶质质量分数
2. 溶液稀释的计算
浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数
3.一定溶质质量分数溶液的配制
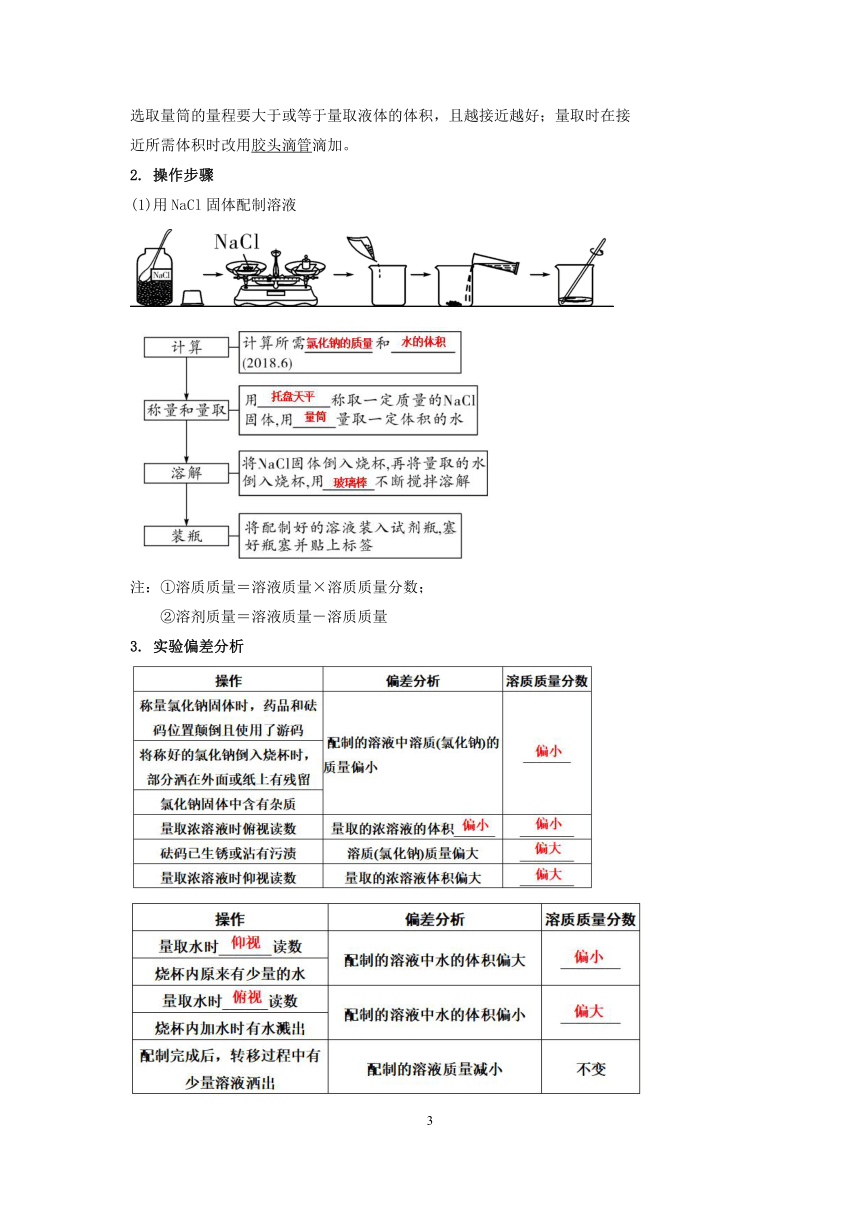
1. 仪器的选用及其作用
(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。
说明:用浓溶液稀释配制时不需要的仪器是托盘天平、镊子、药匙。
(2)玻璃棒的作用是搅拌,加速溶解;量筒的作用是量取一定体积的液体,
选取量筒的量程要大于或等于量取液体的体积,且越接近越好;量取时在接
近所需体积时改用胶头滴管滴加。
2. 操作步骤
(1)用NaCl固体配制溶液
注:①溶质质量=溶液质量×溶质质量分数;
②溶剂质量=溶液质量-溶质质量
3. 实验偏差分析
例1、已知:(1)20℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。(2)20℃时几种物质的溶解度如下
物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克) 36.0 0.165 7.4 31.6
下列说法正确的是( )
A.20℃时氢氧化钙是难溶物质
B.20℃时可以配制出20%的硝酸钾溶液
C.20℃时氯酸钾是易溶物质
D.20℃时硝酸钾的溶解度比氯化钠大
例2、如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,
可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
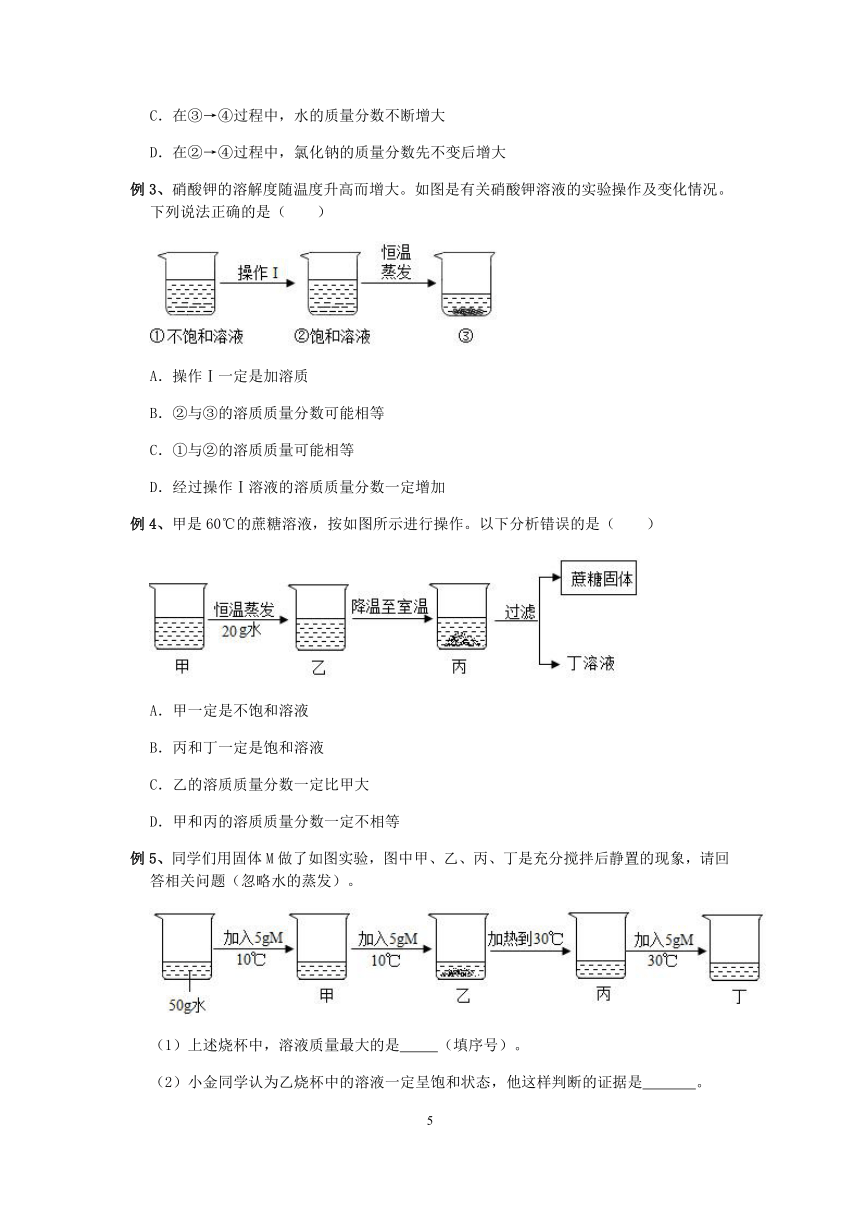
例3、硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
A.操作Ⅰ一定是加溶质
B.②与③的溶质质量分数可能相等
C.①与②的溶质质量可能相等
D.经过操作Ⅰ溶液的溶质质量分数一定增加
例4、甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )
A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
例5、同学们用固体M做了如图实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题(忽略水的蒸发)。
(1)上述烧杯中,溶液质量最大的是 (填序号)。
(2)小金同学认为乙烧杯中的溶液一定呈饱和状态,他这样判断的证据是 。
1.20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
2.如图为小明在实验室中模拟海水晒盐的过程,图中各烧杯中的液体一定属于饱和溶液的是( )
A.甲、乙 B.乙、丙 C.丙、丁 D.甲、丁
3.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
4.某同学在室温下(20℃)称7.5g物质N的固体颗粒,加入50mL水中(物质N不与水反应且溶解度随温度的升高而增大),最终形成无色溶液。通过传感器测得溶液温度变化情况如图所示。根据实验下列说法正确的是( )
A.20℃时N的溶解度是15g
B.最终所得溶液的溶质质量分数为15%
C.a、c两点时N的溶解度一定相同
D.b、c两点时所得溶液的溶质质量分数一定不相同
5.如表是甲物质在不同温度时的溶解度:
温度/℃ 10 20 30 40
溶解度/g 10.0 18.0 36.0 56.0
按如图步骤进行操作:
(1)在A﹣E的溶液中,溶质质量分数最大的是 (填字母)。
(2)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 克。
1.一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )
A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
2.现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示。下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
3.将30克固体物质X(不含结晶水)投入盛有20克水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别为如图中甲、乙、丙、丁点所示。下列判断不正确的是( )
A.0℃时,甲溶液中物质X的质量为4克
B.t1℃时,物质X的溶解度比0℃时大
C.t2℃时,丙溶液一定是饱和溶液
D.t3℃时的丁溶液降温到t2℃时,没有晶体析出
4.温度不变,对100mL氯化钠饱和溶液进行如下实验(如图所示):实验一,将烧杯甲中溶液转移出50mL到乙烧杯中。实验二,是把5g水和5g氯化钠分别加入在甲、乙烧杯中。则下列结论不正确的是( )
A.实验二后,乙溶液溶质质量分数不变
B.实验一后,甲和乙中溶质质量分数相等
C.实验二后,甲烧杯中食盐的溶解度减小
D.实验二后,甲和乙溶液中溶质质量相等
5.为了探究溶质质量分数与加入水的质量的关系,小明在配制20℃时硝酸钾溶液过程中,他向硝酸钾中分批加水,充分搅拌,流程如图:
(1)溶解过程中用玻璃棒搅拌的目的是 。
(2)图中可能符合上述实验结果的描点有 。
参考答案
例1、B
例2、D
例3、C
例4、D
例5、(1) 丁(2)烧杯中有未溶解的固体
1.B
2.C
3.D
4.C
5.(1) D (2) 50
1.B
2.B
3.C
4.C
5.(1) 加快溶质的溶解速率 (2) bd
【备考2023】浙教版科学中考第二轮复习--第18讲
溶 液
1. 溶液的组成及特征
(1)概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
(3)特征:均一性、稳定性、混合物。
2. 物质溶解时的吸热或放热现象
3. 除污方法及原理
二、饱和溶液与不饱和溶液
1. 饱和溶液与不饱和溶液的判断
2. 饱和溶液和不饱和溶液的转化
(1)对于大多数固体(溶解度随温度升高而增大的物质,如KNO3):
三、溶解度及溶解度曲线
1. 固体的溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,单位为“g”。
(2)影响因素,内因:溶质和溶质的性质;外因:温度。
(3)物质溶解度与溶解性的关系
四、溶质质量分数的计算
1. 溶质质量分数
2. 溶液稀释的计算
浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数
3.一定溶质质量分数溶液的配制
1. 仪器的选用及其作用
(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。
说明:用浓溶液稀释配制时不需要的仪器是托盘天平、镊子、药匙。
(2)玻璃棒的作用是搅拌,加速溶解;量筒的作用是量取一定体积的液体,
选取量筒的量程要大于或等于量取液体的体积,且越接近越好;量取时在接
近所需体积时改用胶头滴管滴加。
2. 操作步骤
(1)用NaCl固体配制溶液
注:①溶质质量=溶液质量×溶质质量分数;
②溶剂质量=溶液质量-溶质质量
3. 实验偏差分析
例1、已知:(1)20℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。(2)20℃时几种物质的溶解度如下
物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克) 36.0 0.165 7.4 31.6
下列说法正确的是( )
A.20℃时氢氧化钙是难溶物质
B.20℃时可以配制出20%的硝酸钾溶液
C.20℃时氯酸钾是易溶物质
D.20℃时硝酸钾的溶解度比氯化钠大
例2、如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,
可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
例3、硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
A.操作Ⅰ一定是加溶质
B.②与③的溶质质量分数可能相等
C.①与②的溶质质量可能相等
D.经过操作Ⅰ溶液的溶质质量分数一定增加
例4、甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )
A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
例5、同学们用固体M做了如图实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题(忽略水的蒸发)。
(1)上述烧杯中,溶液质量最大的是 (填序号)。
(2)小金同学认为乙烧杯中的溶液一定呈饱和状态,他这样判断的证据是 。
1.20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
2.如图为小明在实验室中模拟海水晒盐的过程,图中各烧杯中的液体一定属于饱和溶液的是( )
A.甲、乙 B.乙、丙 C.丙、丁 D.甲、丁
3.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
4.某同学在室温下(20℃)称7.5g物质N的固体颗粒,加入50mL水中(物质N不与水反应且溶解度随温度的升高而增大),最终形成无色溶液。通过传感器测得溶液温度变化情况如图所示。根据实验下列说法正确的是( )
A.20℃时N的溶解度是15g
B.最终所得溶液的溶质质量分数为15%
C.a、c两点时N的溶解度一定相同
D.b、c两点时所得溶液的溶质质量分数一定不相同
5.如表是甲物质在不同温度时的溶解度:
温度/℃ 10 20 30 40
溶解度/g 10.0 18.0 36.0 56.0
按如图步骤进行操作:
(1)在A﹣E的溶液中,溶质质量分数最大的是 (填字母)。
(2)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 克。
1.一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )
A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
2.现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示。下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
3.将30克固体物质X(不含结晶水)投入盛有20克水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别为如图中甲、乙、丙、丁点所示。下列判断不正确的是( )
A.0℃时,甲溶液中物质X的质量为4克
B.t1℃时,物质X的溶解度比0℃时大
C.t2℃时,丙溶液一定是饱和溶液
D.t3℃时的丁溶液降温到t2℃时,没有晶体析出
4.温度不变,对100mL氯化钠饱和溶液进行如下实验(如图所示):实验一,将烧杯甲中溶液转移出50mL到乙烧杯中。实验二,是把5g水和5g氯化钠分别加入在甲、乙烧杯中。则下列结论不正确的是( )
A.实验二后,乙溶液溶质质量分数不变
B.实验一后,甲和乙中溶质质量分数相等
C.实验二后,甲烧杯中食盐的溶解度减小
D.实验二后,甲和乙溶液中溶质质量相等
5.为了探究溶质质量分数与加入水的质量的关系,小明在配制20℃时硝酸钾溶液过程中,他向硝酸钾中分批加水,充分搅拌,流程如图:
(1)溶解过程中用玻璃棒搅拌的目的是 。
(2)图中可能符合上述实验结果的描点有 。
参考答案
例1、B
例2、D
例3、C
例4、D
例5、(1) 丁(2)烧杯中有未溶解的固体
1.B
2.C
3.D
4.C
5.(1) D (2) 50
1.B
2.B
3.C
4.C
5.(1) 加快溶质的溶解速率 (2) bd
【备考2023】浙教版科学中考第二轮复习--第18讲
溶 液
