第二章第一节钠及其化合物 课件(共58张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章第一节钠及其化合物 课件(共58张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 10:28:29 | ||
图片预览










文档简介
(共58张PPT)
第三章 金属及其化合物
金属钠的性质(第1课时)
新闻播报
2015年5月30日辽宁一药厂发生爆炸起火,沈阳市消防支队立即调派8个中队、22台消防车、130名官兵到达现场参加扑救,经查勘,发现为已停产十个月的厂房内存放的200公斤金属钠遇雨水后燃烧爆炸。13时40分,在爆炸现场记者看到,距离爆炸点数百米远处就能看到滚滚白烟,厂区门前的蒲裕路上聚集着数十辆消防救援车。
操作:从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
实验探究1
1.钠与氧气反应
4Na+O2═2Na2O(白色氧化钠)
4e-
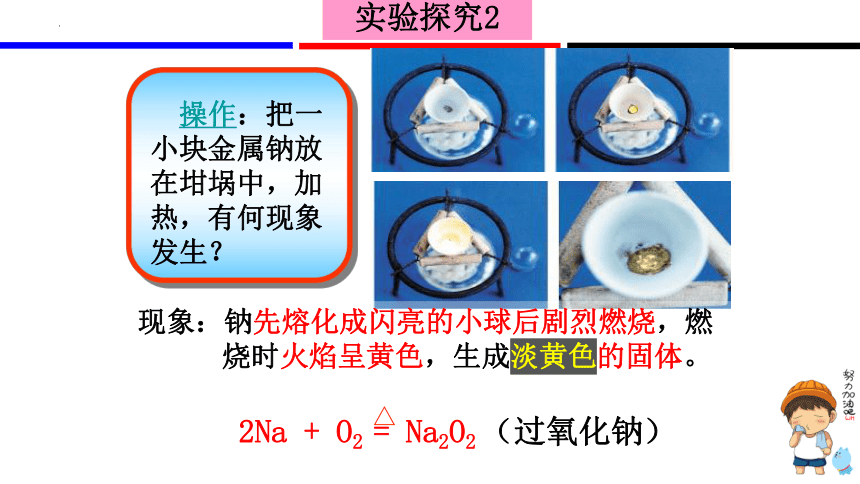
操作:把一小块金属钠放在坩埚中,加热,有何现象发生?
现象:钠先熔化成闪亮的小球后剧烈燃烧,燃烧时火焰呈黄色,生成淡黄色的固体。
实验探究2
2Na + O2 = Na2O2 (过氧化钠)
△
金属钠除了能和氧气反应生成金属氧化物外,金属还能被氯气、硫单质等氧化性的物质所氧化,生成相应的氯化物或硫化物。
请写出Na与Cl2在点燃的条件下、 Na与 S在研磨情况下的化学反应方程式!
2Na+Cl2 ═ 2NaCl 2Na + S ═ Na2S
点燃
举一反三
研磨
实验探究2
操作:向一只盛有水的大烧杯中滴加几滴酚酞试液,然后将一小块金属钠投入烧杯中,观察实验现象。
2.钠与水反应
实验探究3
结论
浮
现 象
熔
红
响
游
钠的密度小于水的密度(0.97g/cm3)
反应放热 ,钠的熔点低(97.81℃)
有气体产生
剧烈反应,快速产生大量气体
有碱性物质生成,NaOH
实验现象讨论
实验探究3
1、写出反应方程式金属钠与水的反应
2、把此反应用离子方程式表示
动动脑动动手
2Na+2H2O=2NaOH+H2↑
2Na +2H2O =2Na+ +2OH- +H2↑
实验探究3
在试管中加水和煤油(密度0.8g/cm3),
将钠 投入试管中,观察到的现象可能是( )
A.钠在水层中反应并四处游动
B.钠停留在煤油层中不反应
C.钠在煤油和水的界面处反应并四处游动
D.钠在煤油和水的界面处反应并可能上下跳动
D
问:钠能像其他的排在氢前的金属一样,和酸反应置换出氢气吗?
能
问:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?
(酸电离产生的H+浓度比水电离产生的H+浓度大)
先: 2Na + 2HCl = 2NaCl + H2↑
后:2Na + 2H2O = 2NaOH + H2↑
思维启迪
4.钠与酸溶液的反应
问:已知Fe能将Cu从它的盐溶液中置换出来, 若将钠放入硫酸铜溶液中,能否置换出铜单质?
实验探究4
分析:硫酸铜溶液中含有溶剂—H2O ,溶质—CuSO4
H2O电离产生H+,CuSO4电离产生Cu2+
①提出合理假设 .
假设1:钠能置换出铜单质;
假设2:钠只和水反应,不能置换出铜单质;
②设计实验方案,进行实验。请在写出实验步骤以及预期现象和结论。
实验步骤 预期现象和结论
从煤油中取一小块金属钠,将钠投入盛有硫酸铜溶液的烧杯中。 若产生红色固体则假设1成立;
若产生蓝色沉淀则假设2成立。
分析:假设1:2Na+CuSO4=Cu+Na2SO4
假设2: 2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
实验探究4
由实验现象可以得出结论:
假设1不成立
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
假设2成立
实验探究4
4 钠与硫酸铜溶液反应
4、与盐溶液反应 (先与水反应)
1、与非金属单质反应
3、与酸反应
2、与水反应
4Na+O2═2Na2O
2Na+O2═Na2O2
2Na+2H2O═2NaOH+ H2↑
2Na+2H+═2Na++H2↑
钠的化学性质:
钠的物理性质:银白色金属光泽、质软、熔点低、导电性导热性、ρ煤油<ρNa<ρ水 (保存在煤油中)
钠的总结
△
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
1.下列关于金属钠的叙述,错误的是( )
A.很软,具有银白色光泽
B.是电和热的良导体
C.比水轻,比煤油重,熔点低于100℃
D.和FeCl3溶液反应可以置换出单质铁
D
课堂练习
2.下列说法正确的是( )
(2015全国II卷)钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
(2013全国II卷)钠与CuSO4溶液反应:
2Na + Cu2+ = Cu↓+ 2Na+
C. (2010广东卷) 1mol/L氢氧化钠溶液中
含有的钠离子数目为 NA
D. (2015广东卷改编)在含下列离子的溶液中投入一小块钠后,各离子仍能大量共存:
K+、 NO3-、 Ca2+、 HCO3-
链接高考
A
第2-3课时 钠的化合物
看图说话
学习金属的主线:
单质→氧化物→ 碱→盐
【思考与交流】氧化钠与氧化钙类似,请说出氧化钠与水、CO2、盐酸反应会生成哪些物质?
氧化钠和过氧化钠
一. 氧化钠
白色固体
Na2O+H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O+2HCl = 2NaCl+H2O
化学小魔术:滴水生火
科学探究: Na2O2与H2O的反应
氧气和氢氧化钠
过氧化钠与水反应会生成
猜想
反应放热
二. 氧化钠
设计实验方案
请设计实验方案验证反应产物。
NaOH
酚 酞 试 液
O2
带火星的木条
反应放热
反应前后的温度变化
①把水滴入盛有少量Na2O2固体试管中, 有什么现象
②立即把带火星的木条伸入试管内有什么现象
③用手摸一摸试管外壁,有什么感觉
④滴入几滴酚酞,观察颜色变化
实验步骤
二. 氧化钠
实验现象 结论
反应生成O2;
反应放热;
反应生成NaOH;
Na2O2具有漂白性;
①试管中发生剧烈反应, 产生大量无色气泡,且此气体能使带火星木条复燃;
②试管发烫;
③无色酚酞变红;
④振荡后红色褪去;
1、过氧化钠与水反应
二. 氧化钠
1.过氧化钠与水反应
2Na2O2+2H2O = 4Na+ + 4OH- + O2↑
练习1:请把以上化学方程式改写成离子方程式?
2Na2O2+2H2O = 4 NaOH+O2↑
练习2:下列有关2Na2O2+2H2O =4NaOH+ O2↑说法正确的是( )
A、该反应为置换反应
B、该反应H2O是还原剂
C、Na2O2既是氧化剂又是还原剂
D、1molNa2O2参与反应时转移的电子数为2NA
C
二. 氧化钠
2、过氧化钠与CO2反应
为什么过氧化钠常用作呼吸面具和潜水艇中的供氧剂?
过氧化钠能与呼出的二氧化碳和水蒸气反应,释放出氧气。
2Na2O2+2CO2=2Na2CO3+O2
-1
-2
0
失去2×e-
得到2×e-
二. 氧化钠
3.过氧化钠与盐酸反应
【对比联想】Na2O能与盐酸反应生成盐和水,那么Na2O2能否与盐酸反应?
2Na2O2+4HCl ═ 4NaCl+2H2O+O2↑
4.Na2O2的用途和保存
③漂白剂
①供氧剂(用于潜水艇或呼吸面具)
②强氧化剂(杀菌、消毒)
用来漂白织物、麦杆、羽毛等。
⑴用途
⑵保存:
隔绝空气,远离易燃物,密封保存
二. 氧化钠
化学式
类 别
颜色、状态
Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
Na2O2
化
学
性
质
Na2O+H2O=2NaOH
与水反应
与CO2
反应
Na2O
碱性氧化物
过氧化物
白色固体
淡黄色固体
氧化钠和过氧化钠的比较
与酸
反应
Na2O+2HCl=
2NaCl+H2O
2Na2O2+4HCl=
4NaCl+2H2O+O2↑
某研究性小组对含有Na2O2杂质的Na2O样品进行探究,请你协助完成探究过程。
一、定性研究:检验过氧化钠的存在
取少量样品于试管中,滴加少量的_______________________________________________,证明存在Na2O2。
蒸馏水,把带火星的木条伸入试管中,木条复燃
方案设计的答题要点:取样→加检验试剂→现象→结论
【能力提升】
A
B
二、定量分析:样品中Na2O(含有Na2O2)含量的测定
1质量分析法
将样品mg与水充分反应,使产生的O2通过灼热的铜粉,测得反应前后B装置中固体质量增加ng,通过计算可得出Na2O的质量分数,此方案测定的结果误差较大,主要原因是_______________________________
【能力提升】
未排尽装置中的空气
1、下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
【反馈练习】
D
2、向紫色石蕊试液中加过量的Na2O2粉末,振荡,正确的叙述是( )
A.溶液仍为紫色
B.最后变蓝色
C.最后褪色
D.有气体产生
CD
【反馈练习】
3、把过氧化钠投入含有Ba2+、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是( )
A. Ba2+
B. Cl-
C. Mg2+
D. Na+
AB
【反馈练习】
NaHCO3
小苏打
Na2CO3
苏打
北宋三苏:
化学三苏:
Na2S2O3
大苏打
苏洵、苏轼、苏辙
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗称 纯碱或苏打 小苏打
色态
水溶性
酸碱性
1、溶解性和酸碱性
白色粉末
细小白色晶体
都易溶于水,溶解性:Na2CO3 > NaHCO3
水溶液均为碱性,碱性Na2CO3 > NaHCO3
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
Na2CO3与NaHCO3的热稳定性对比试验(套管实验)
2、热稳定性
现象 化学方程式 结论
加热Na2CO3
加热NaHCO3
碳酸钠和碳酸氢钠
2、热稳定性
澄清的石灰水变浑浊
澄清的石灰水不变浑浊
受热易分解
受热不分解
☆2NaHCO3
Na2CO3+ H2O + CO2 ↑
【思考】(1)怎样除去碳酸钠固体中的碳酸氢钠杂质?
(2)蒸馒头时,常在面粉中加入一定量的发酵粉(主要成分是小苏打),为什么?
Na+
Na+
Na+
Na+
Na+
CO32-
CO32-
CO32-
Cl-
H+
HCO3-
Na+
Cl-
H+
HCO3-
Cl-
H+
Na+
Na+
Na+
HCO3-
HCO3-
HCO3-
Cl-
H+
CO2
Cl-
H+
CO2
CO2
Cl-
H+
HCO3-
3、与酸的反应:HCl溶液
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
☆ Na2CO3+2HCl=2NaCl+H2O+CO2↑(慢)
☆ NaHCO3+HCl=NaCl+H2O+CO2↑(快)
现象:都产生大量无色气体,但NaHCO3反应更剧烈。
3、与酸的反应:HCl溶液
【思考1】通过逐滴加入盐酸的方法,能否鉴别碳酸钠和碳酸氢钠?
注意:碳酸钠与盐酸反应的产物与盐酸的用量有关!
可以
【思考3】如何除去碳酸氢钠溶液中混有的少量碳酸钠?
【思考2】如何除去CO2气体中混有的HCl杂质?
通入过量CO2气体。
通过饱和NaHCO3溶液,洗气。
碳酸钠和碳酸氢钠
【思考4】向饱和的碳酸钠溶液中通入过量的二氧化碳,有何现象?为什么?
现象:有白色晶体析出。
原因:反应消耗了一定的水;生成的NaHCO3的质量大于消耗的Na2CO3的质量但NaHCO3的溶解度却比Na2CO3小。
碳酸钠和碳酸氢钠
4、与碱反应:NaOH/Ca(OH)2
NaHCO3+NaOH = Na2CO3+H2O
☆ 1NaHCO3+Ca(OH)2 = CaCO3↓+H2O+NaOH
☆ 2NaHCO3+1Ca(OH)2 = CaCO3↓+2H2O+Na2CO3
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
(少量)
(过量)
5、与盐溶液的反应:CaCl2/BaCl2
Na2CO3+CaCl2=CaCO3↓+2NaCl
NaHCO3+CaCl2 → 不反应
碳酸钠和碳酸氢钠
碳酸钠Na2CO3 碳酸氢钠NaHCO3
溶解性
与盐酸反应
热稳定性
与CaCl2反应
与澄清石灰水
相互转化
较易溶于水
(小于碳酸钠)
易溶于水
不反应
Na2CO3+ CaCl2 =2NaCl +CaCO3↓
Na2CO3+HCl=NaHCO3+NaCl
NaOH / △
NaHCO3+HCl=H2O+CO2↑+NaCl
NaHCO3+HCl=H2O+CO2↑+NaCl
较稳定
2NaHCO3==Na2CO3+H2O+CO2↑
△
Na2CO3+ Ca(OH)2 =2NaOH+CaCO3↓
NaHCO3+ Ca(OH)2 =NaOH+
CaCO3↓ + H2O
Na2CO3
NaHCO3
CO2 ,H2O/H+
总结
【小结1】Na2CO3与NaHCO3的检验方法
1、
2、
3、
4、
或者同浓度溶液中,加入酚酞,颜色较深的是Na2CO3
Na
Na2O
NaOH
Na2O2
Na2CO3
NaHCO3
NaCl
总结:钠及其化合物之间的相互转化关系
CO2
H2O
O2
O2 点燃
CO2
Ca(OH)2
CO2(少量)
(aq)NaOH
固体 加热
(aq)CO2 过量
HCl
HCl
Cl2点燃、HCl
H2O
H2O
特别注意:
钠与酸溶液反应,先酸后水;
钠与盐溶液反应,先水后盐。
【拓展1】纯碱的工业方法
1.基本原理:利用NaHCO3在常见可溶盐中溶解度较小的特点,先制得NaHCO3,再加热分解制得Na2CO3。
2.基本步骤:制得饱和食盐水
通入足量NH3
饱和氨盐水
通入足量CO2
析出NaHCO3晶体
3.总反应:
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
△
2NaHCO3==Na2CO3+CO2↑+H2O
请思考:
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色试验。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
【拓展2】焰色试验
实验3-6用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。
仪器用品:铂丝、酒精灯、稀盐酸、蓝色钴玻璃、待测物
物理变化
步骤:
1)用稀盐酸清洗铂丝棒,并灼烧至与原来火焰颜色相同;
2)蘸取待测物灼烧,观察火焰颜色;
3)用稀盐酸洗并灼烧。
必须掌握:
钠——黄色
钾——紫色(要透过蓝色钴玻璃)
洗
烧
烧
蘸
【拓展2】焰色试验
注意事项:
1)火焰本身尽可能无色;
2)铂丝要洁净;
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
1.焰色反应要求铂丝洁净,用稀盐酸洗涤可以将其上面的杂质转化为氯化物,氯化物的沸点较低,灼烧时挥发。
2.蓝色钴玻璃的作用是滤去黄色的光,避免钠元素造成的干扰。
【拓展2】焰色试验
1.下列物质热稳定性最好的是( )
A石灰石 B.小苏打 C.纯碱 D.碳铵
2.下列离子方程式正确的是( )
A、钠与水反应:Na+2H2O==Na++2OH- + H2↑
B.过氧化钠与水反应:2Na2O2+2H2O===4Na++4OH-+O2↑
C、氧化钠与盐酸:O2-+2H+==H2O
D.小苏打与稀硫酸:CO32-+2H+===CO2↑十H2O
[课堂练习]
C
B
3. 如何鉴别Na2CO3 、NaHCO3和NaCl?
盐酸溶液
4. 下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
D
[课堂练习]
5.下列说法中不正确的是( )
A、Na2CO3比NaHCO3 易溶于水
B、Na2CO3比NaHCO3稳定
C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D、物质的量相等的Na2CO3和NaHCO3分别与盐酸反应
得CO2的物质的量之比为2︰1
D
[课堂练习]
6.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作
是( )
A、加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水
D
[课堂练习]
7.比较Na2CO3和NaHCO3的性质,下列叙述正确的是( )
A.热稳定性:Na2CO3B.常温时水溶解性:Na2CO3>NaHCO3
C.同浓度下与盐酸反应放出气体快慢: Na2CO3>NaHCO3
D.相同浓度下水溶液的碱性 :Na2CO3B
[课堂练习]
8.1 mol 过氧化钠与 2 mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体后冷却,残留的固体物质是( )
A.Na2CO3
C.NaOH、Na2CO3
B.Na2O2、Na2CO3
D.Na2O2、NaOH、Na2CO3
【小结】一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
A
[课堂练习]
9、由CO和H2组成的混合气体2.8g 在足量的O2 中充分燃烧后,立即通入足量的Na2O2 固体中,固体的质量增加( )
A.2.8g B.3.6g C.4.4g D.5.6
Na2O2与CO2反应时,固体增加的质量等于与CO2等物质的量的CO的质量。
A
Na2O2与H2O反应时,固体增加的质量等于与H2O等物质的量的H2的质量。
[课堂练习]
10、某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
。
[课堂练习]
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g。
实验步骤如下:
[课堂练习]
(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”);
(2)鼓入空气的目的是 ,装置A中试剂X应选用 ;
(3)若没有C装置,则会导致测定结果_____(填“偏大”或“偏小”);
(4)E装置的作用是 ;
(5)装置B中发生反应的离子方程式 ;
(6)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为 (结果保留一位小数)。
偏小
使B中的二氧化碳全部进入D中
氢氧化钠溶液
偏大
防止空气中CO2和水蒸气进入D中
88.3%
[课堂练习]
第三章 金属及其化合物
金属钠的性质(第1课时)
新闻播报
2015年5月30日辽宁一药厂发生爆炸起火,沈阳市消防支队立即调派8个中队、22台消防车、130名官兵到达现场参加扑救,经查勘,发现为已停产十个月的厂房内存放的200公斤金属钠遇雨水后燃烧爆炸。13时40分,在爆炸现场记者看到,距离爆炸点数百米远处就能看到滚滚白烟,厂区门前的蒲裕路上聚集着数十辆消防救援车。
操作:从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
实验探究1
1.钠与氧气反应
4Na+O2═2Na2O(白色氧化钠)
4e-
操作:把一小块金属钠放在坩埚中,加热,有何现象发生?
现象:钠先熔化成闪亮的小球后剧烈燃烧,燃烧时火焰呈黄色,生成淡黄色的固体。
实验探究2
2Na + O2 = Na2O2 (过氧化钠)
△
金属钠除了能和氧气反应生成金属氧化物外,金属还能被氯气、硫单质等氧化性的物质所氧化,生成相应的氯化物或硫化物。
请写出Na与Cl2在点燃的条件下、 Na与 S在研磨情况下的化学反应方程式!
2Na+Cl2 ═ 2NaCl 2Na + S ═ Na2S
点燃
举一反三
研磨
实验探究2
操作:向一只盛有水的大烧杯中滴加几滴酚酞试液,然后将一小块金属钠投入烧杯中,观察实验现象。
2.钠与水反应
实验探究3
结论
浮
现 象
熔
红
响
游
钠的密度小于水的密度(0.97g/cm3)
反应放热 ,钠的熔点低(97.81℃)
有气体产生
剧烈反应,快速产生大量气体
有碱性物质生成,NaOH
实验现象讨论
实验探究3
1、写出反应方程式金属钠与水的反应
2、把此反应用离子方程式表示
动动脑动动手
2Na+2H2O=2NaOH+H2↑
2Na +2H2O =2Na+ +2OH- +H2↑
实验探究3
在试管中加水和煤油(密度0.8g/cm3),
将钠 投入试管中,观察到的现象可能是( )
A.钠在水层中反应并四处游动
B.钠停留在煤油层中不反应
C.钠在煤油和水的界面处反应并四处游动
D.钠在煤油和水的界面处反应并可能上下跳动
D
问:钠能像其他的排在氢前的金属一样,和酸反应置换出氢气吗?
能
问:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?
(酸电离产生的H+浓度比水电离产生的H+浓度大)
先: 2Na + 2HCl = 2NaCl + H2↑
后:2Na + 2H2O = 2NaOH + H2↑
思维启迪
4.钠与酸溶液的反应
问:已知Fe能将Cu从它的盐溶液中置换出来, 若将钠放入硫酸铜溶液中,能否置换出铜单质?
实验探究4
分析:硫酸铜溶液中含有溶剂—H2O ,溶质—CuSO4
H2O电离产生H+,CuSO4电离产生Cu2+
①提出合理假设 .
假设1:钠能置换出铜单质;
假设2:钠只和水反应,不能置换出铜单质;
②设计实验方案,进行实验。请在写出实验步骤以及预期现象和结论。
实验步骤 预期现象和结论
从煤油中取一小块金属钠,将钠投入盛有硫酸铜溶液的烧杯中。 若产生红色固体则假设1成立;
若产生蓝色沉淀则假设2成立。
分析:假设1:2Na+CuSO4=Cu+Na2SO4
假设2: 2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
实验探究4
由实验现象可以得出结论:
假设1不成立
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
假设2成立
实验探究4
4 钠与硫酸铜溶液反应
4、与盐溶液反应 (先与水反应)
1、与非金属单质反应
3、与酸反应
2、与水反应
4Na+O2═2Na2O
2Na+O2═Na2O2
2Na+2H2O═2NaOH+ H2↑
2Na+2H+═2Na++H2↑
钠的化学性质:
钠的物理性质:银白色金属光泽、质软、熔点低、导电性导热性、ρ煤油<ρNa<ρ水 (保存在煤油中)
钠的总结
△
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
1.下列关于金属钠的叙述,错误的是( )
A.很软,具有银白色光泽
B.是电和热的良导体
C.比水轻,比煤油重,熔点低于100℃
D.和FeCl3溶液反应可以置换出单质铁
D
课堂练习
2.下列说法正确的是( )
(2015全国II卷)钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
(2013全国II卷)钠与CuSO4溶液反应:
2Na + Cu2+ = Cu↓+ 2Na+
C. (2010广东卷) 1mol/L氢氧化钠溶液中
含有的钠离子数目为 NA
D. (2015广东卷改编)在含下列离子的溶液中投入一小块钠后,各离子仍能大量共存:
K+、 NO3-、 Ca2+、 HCO3-
链接高考
A
第2-3课时 钠的化合物
看图说话
学习金属的主线:
单质→氧化物→ 碱→盐
【思考与交流】氧化钠与氧化钙类似,请说出氧化钠与水、CO2、盐酸反应会生成哪些物质?
氧化钠和过氧化钠
一. 氧化钠
白色固体
Na2O+H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O+2HCl = 2NaCl+H2O
化学小魔术:滴水生火
科学探究: Na2O2与H2O的反应
氧气和氢氧化钠
过氧化钠与水反应会生成
猜想
反应放热
二. 氧化钠
设计实验方案
请设计实验方案验证反应产物。
NaOH
酚 酞 试 液
O2
带火星的木条
反应放热
反应前后的温度变化
①把水滴入盛有少量Na2O2固体试管中, 有什么现象
②立即把带火星的木条伸入试管内有什么现象
③用手摸一摸试管外壁,有什么感觉
④滴入几滴酚酞,观察颜色变化
实验步骤
二. 氧化钠
实验现象 结论
反应生成O2;
反应放热;
反应生成NaOH;
Na2O2具有漂白性;
①试管中发生剧烈反应, 产生大量无色气泡,且此气体能使带火星木条复燃;
②试管发烫;
③无色酚酞变红;
④振荡后红色褪去;
1、过氧化钠与水反应
二. 氧化钠
1.过氧化钠与水反应
2Na2O2+2H2O = 4Na+ + 4OH- + O2↑
练习1:请把以上化学方程式改写成离子方程式?
2Na2O2+2H2O = 4 NaOH+O2↑
练习2:下列有关2Na2O2+2H2O =4NaOH+ O2↑说法正确的是( )
A、该反应为置换反应
B、该反应H2O是还原剂
C、Na2O2既是氧化剂又是还原剂
D、1molNa2O2参与反应时转移的电子数为2NA
C
二. 氧化钠
2、过氧化钠与CO2反应
为什么过氧化钠常用作呼吸面具和潜水艇中的供氧剂?
过氧化钠能与呼出的二氧化碳和水蒸气反应,释放出氧气。
2Na2O2+2CO2=2Na2CO3+O2
-1
-2
0
失去2×e-
得到2×e-
二. 氧化钠
3.过氧化钠与盐酸反应
【对比联想】Na2O能与盐酸反应生成盐和水,那么Na2O2能否与盐酸反应?
2Na2O2+4HCl ═ 4NaCl+2H2O+O2↑
4.Na2O2的用途和保存
③漂白剂
①供氧剂(用于潜水艇或呼吸面具)
②强氧化剂(杀菌、消毒)
用来漂白织物、麦杆、羽毛等。
⑴用途
⑵保存:
隔绝空气,远离易燃物,密封保存
二. 氧化钠
化学式
类 别
颜色、状态
Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
Na2O2
化
学
性
质
Na2O+H2O=2NaOH
与水反应
与CO2
反应
Na2O
碱性氧化物
过氧化物
白色固体
淡黄色固体
氧化钠和过氧化钠的比较
与酸
反应
Na2O+2HCl=
2NaCl+H2O
2Na2O2+4HCl=
4NaCl+2H2O+O2↑
某研究性小组对含有Na2O2杂质的Na2O样品进行探究,请你协助完成探究过程。
一、定性研究:检验过氧化钠的存在
取少量样品于试管中,滴加少量的_______________________________________________,证明存在Na2O2。
蒸馏水,把带火星的木条伸入试管中,木条复燃
方案设计的答题要点:取样→加检验试剂→现象→结论
【能力提升】
A
B
二、定量分析:样品中Na2O(含有Na2O2)含量的测定
1质量分析法
将样品mg与水充分反应,使产生的O2通过灼热的铜粉,测得反应前后B装置中固体质量增加ng,通过计算可得出Na2O的质量分数,此方案测定的结果误差较大,主要原因是_______________________________
【能力提升】
未排尽装置中的空气
1、下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
【反馈练习】
D
2、向紫色石蕊试液中加过量的Na2O2粉末,振荡,正确的叙述是( )
A.溶液仍为紫色
B.最后变蓝色
C.最后褪色
D.有气体产生
CD
【反馈练习】
3、把过氧化钠投入含有Ba2+、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是( )
A. Ba2+
B. Cl-
C. Mg2+
D. Na+
AB
【反馈练习】
NaHCO3
小苏打
Na2CO3
苏打
北宋三苏:
化学三苏:
Na2S2O3
大苏打
苏洵、苏轼、苏辙
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗称 纯碱或苏打 小苏打
色态
水溶性
酸碱性
1、溶解性和酸碱性
白色粉末
细小白色晶体
都易溶于水,溶解性:Na2CO3 > NaHCO3
水溶液均为碱性,碱性Na2CO3 > NaHCO3
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
Na2CO3与NaHCO3的热稳定性对比试验(套管实验)
2、热稳定性
现象 化学方程式 结论
加热Na2CO3
加热NaHCO3
碳酸钠和碳酸氢钠
2、热稳定性
澄清的石灰水变浑浊
澄清的石灰水不变浑浊
受热易分解
受热不分解
☆2NaHCO3
Na2CO3+ H2O + CO2 ↑
【思考】(1)怎样除去碳酸钠固体中的碳酸氢钠杂质?
(2)蒸馒头时,常在面粉中加入一定量的发酵粉(主要成分是小苏打),为什么?
Na+
Na+
Na+
Na+
Na+
CO32-
CO32-
CO32-
Cl-
H+
HCO3-
Na+
Cl-
H+
HCO3-
Cl-
H+
Na+
Na+
Na+
HCO3-
HCO3-
HCO3-
Cl-
H+
CO2
Cl-
H+
CO2
CO2
Cl-
H+
HCO3-
3、与酸的反应:HCl溶液
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
☆ Na2CO3+2HCl=2NaCl+H2O+CO2↑(慢)
☆ NaHCO3+HCl=NaCl+H2O+CO2↑(快)
现象:都产生大量无色气体,但NaHCO3反应更剧烈。
3、与酸的反应:HCl溶液
【思考1】通过逐滴加入盐酸的方法,能否鉴别碳酸钠和碳酸氢钠?
注意:碳酸钠与盐酸反应的产物与盐酸的用量有关!
可以
【思考3】如何除去碳酸氢钠溶液中混有的少量碳酸钠?
【思考2】如何除去CO2气体中混有的HCl杂质?
通入过量CO2气体。
通过饱和NaHCO3溶液,洗气。
碳酸钠和碳酸氢钠
【思考4】向饱和的碳酸钠溶液中通入过量的二氧化碳,有何现象?为什么?
现象:有白色晶体析出。
原因:反应消耗了一定的水;生成的NaHCO3的质量大于消耗的Na2CO3的质量但NaHCO3的溶解度却比Na2CO3小。
碳酸钠和碳酸氢钠
4、与碱反应:NaOH/Ca(OH)2
NaHCO3+NaOH = Na2CO3+H2O
☆ 1NaHCO3+Ca(OH)2 = CaCO3↓+H2O+NaOH
☆ 2NaHCO3+1Ca(OH)2 = CaCO3↓+2H2O+Na2CO3
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
(少量)
(过量)
5、与盐溶液的反应:CaCl2/BaCl2
Na2CO3+CaCl2=CaCO3↓+2NaCl
NaHCO3+CaCl2 → 不反应
碳酸钠和碳酸氢钠
碳酸钠Na2CO3 碳酸氢钠NaHCO3
溶解性
与盐酸反应
热稳定性
与CaCl2反应
与澄清石灰水
相互转化
较易溶于水
(小于碳酸钠)
易溶于水
不反应
Na2CO3+ CaCl2 =2NaCl +CaCO3↓
Na2CO3+HCl=NaHCO3+NaCl
NaOH / △
NaHCO3+HCl=H2O+CO2↑+NaCl
NaHCO3+HCl=H2O+CO2↑+NaCl
较稳定
2NaHCO3==Na2CO3+H2O+CO2↑
△
Na2CO3+ Ca(OH)2 =2NaOH+CaCO3↓
NaHCO3+ Ca(OH)2 =NaOH+
CaCO3↓ + H2O
Na2CO3
NaHCO3
CO2 ,H2O/H+
总结
【小结1】Na2CO3与NaHCO3的检验方法
1、
2、
3、
4、
或者同浓度溶液中,加入酚酞,颜色较深的是Na2CO3
Na
Na2O
NaOH
Na2O2
Na2CO3
NaHCO3
NaCl
总结:钠及其化合物之间的相互转化关系
CO2
H2O
O2
O2 点燃
CO2
Ca(OH)2
CO2(少量)
(aq)NaOH
固体 加热
(aq)CO2 过量
HCl
HCl
Cl2点燃、HCl
H2O
H2O
特别注意:
钠与酸溶液反应,先酸后水;
钠与盐溶液反应,先水后盐。
【拓展1】纯碱的工业方法
1.基本原理:利用NaHCO3在常见可溶盐中溶解度较小的特点,先制得NaHCO3,再加热分解制得Na2CO3。
2.基本步骤:制得饱和食盐水
通入足量NH3
饱和氨盐水
通入足量CO2
析出NaHCO3晶体
3.总反应:
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
△
2NaHCO3==Na2CO3+CO2↑+H2O
请思考:
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色试验。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
【拓展2】焰色试验
实验3-6用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。
仪器用品:铂丝、酒精灯、稀盐酸、蓝色钴玻璃、待测物
物理变化
步骤:
1)用稀盐酸清洗铂丝棒,并灼烧至与原来火焰颜色相同;
2)蘸取待测物灼烧,观察火焰颜色;
3)用稀盐酸洗并灼烧。
必须掌握:
钠——黄色
钾——紫色(要透过蓝色钴玻璃)
洗
烧
烧
蘸
【拓展2】焰色试验
注意事项:
1)火焰本身尽可能无色;
2)铂丝要洁净;
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
1.焰色反应要求铂丝洁净,用稀盐酸洗涤可以将其上面的杂质转化为氯化物,氯化物的沸点较低,灼烧时挥发。
2.蓝色钴玻璃的作用是滤去黄色的光,避免钠元素造成的干扰。
【拓展2】焰色试验
1.下列物质热稳定性最好的是( )
A石灰石 B.小苏打 C.纯碱 D.碳铵
2.下列离子方程式正确的是( )
A、钠与水反应:Na+2H2O==Na++2OH- + H2↑
B.过氧化钠与水反应:2Na2O2+2H2O===4Na++4OH-+O2↑
C、氧化钠与盐酸:O2-+2H+==H2O
D.小苏打与稀硫酸:CO32-+2H+===CO2↑十H2O
[课堂练习]
C
B
3. 如何鉴别Na2CO3 、NaHCO3和NaCl?
盐酸溶液
4. 下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
D
[课堂练习]
5.下列说法中不正确的是( )
A、Na2CO3比NaHCO3 易溶于水
B、Na2CO3比NaHCO3稳定
C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D、物质的量相等的Na2CO3和NaHCO3分别与盐酸反应
得CO2的物质的量之比为2︰1
D
[课堂练习]
6.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作
是( )
A、加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水
D
[课堂练习]
7.比较Na2CO3和NaHCO3的性质,下列叙述正确的是( )
A.热稳定性:Na2CO3
C.同浓度下与盐酸反应放出气体快慢: Na2CO3>NaHCO3
D.相同浓度下水溶液的碱性 :Na2CO3
[课堂练习]
8.1 mol 过氧化钠与 2 mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体后冷却,残留的固体物质是( )
A.Na2CO3
C.NaOH、Na2CO3
B.Na2O2、Na2CO3
D.Na2O2、NaOH、Na2CO3
【小结】一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
A
[课堂练习]
9、由CO和H2组成的混合气体2.8g 在足量的O2 中充分燃烧后,立即通入足量的Na2O2 固体中,固体的质量增加( )
A.2.8g B.3.6g C.4.4g D.5.6
Na2O2与CO2反应时,固体增加的质量等于与CO2等物质的量的CO的质量。
A
Na2O2与H2O反应时,固体增加的质量等于与H2O等物质的量的H2的质量。
[课堂练习]
10、某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
。
[课堂练习]
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g。
实验步骤如下:
[课堂练习]
(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”);
(2)鼓入空气的目的是 ,装置A中试剂X应选用 ;
(3)若没有C装置,则会导致测定结果_____(填“偏大”或“偏小”);
(4)E装置的作用是 ;
(5)装置B中发生反应的离子方程式 ;
(6)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为 (结果保留一位小数)。
偏小
使B中的二氧化碳全部进入D中
氢氧化钠溶液
偏大
防止空气中CO2和水蒸气进入D中
88.3%
[课堂练习]
