5.2.4 硝酸、酸雨及防治 课件(共18张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.4 硝酸、酸雨及防治 课件(共18张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 10:34:11 | ||
图片预览





文档简介
(共18张PPT)
第二节 氮及其化合物
第4课时 硝酸、酸雨及防治
第五章 化工生产中的重要非金属元素
硝酸的物理性质
01
颜色 气味 挥发性 状态 沸点 密度
无色
有刺激性气味
易挥发
液体
83℃
1.5027 g/cm3
① 硝酸能与水任意比互溶
② 常用浓硝酸质量分数为69%。
③ 质量分数为95%以上的硝酸为“发烟硝酸”
开瓶瓶口有白雾
发烟硝酸(w >95%)
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
硝酸的化学性质
02
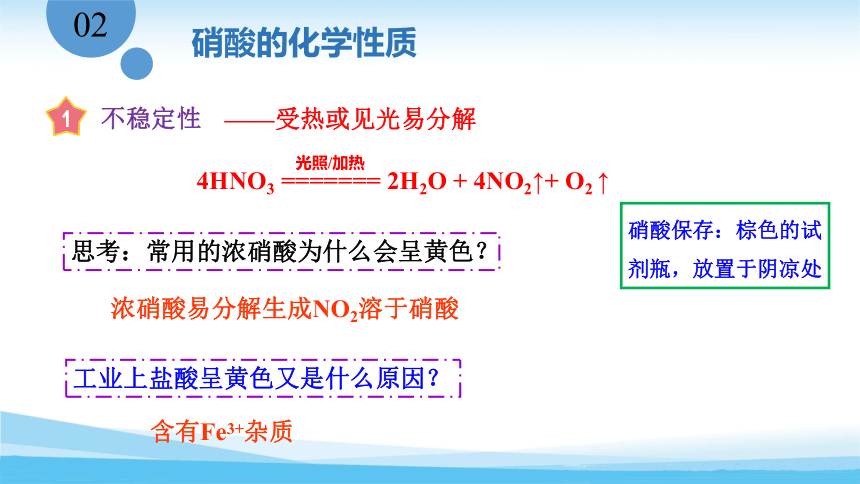
4HNO3 ======= 2H2O + 4NO2↑+ O2 ↑
光照/加热
硝酸保存:棕色的试剂瓶,放置于阴凉处
思考:常用的浓硝酸为什么会呈黄色?
浓硝酸易分解生成NO2溶于硝酸
工业上盐酸呈黄色又是什么原因?
含有Fe3+杂质
不稳定性
——受热或见光易分解
酸的通性
HNO3 = H+ + NO3-
与指示剂显色
与金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
硝酸
能不能生成H2
如 NaOH
H+ + OH- = H2O
如 CuO
2H+ + CuO = Cu2+ + H2O
如 Na2CO3
2H+ + CO32- = H2O + CO2↑
?
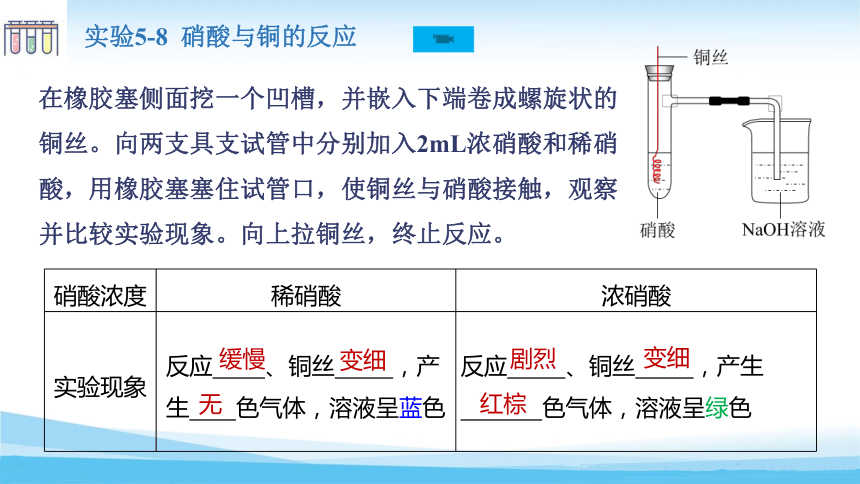
在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
实验5-8 硝酸与铜的反应
硝酸浓度 稀硝酸 浓硝酸
实验现象 反应 、铜丝 ,产生 色气体,溶液呈蓝色 反应 、铜丝 ,产生
色气体,溶液呈绿色
剧烈
变细
红棕
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
变细
无
缓慢
①与金属反应
稀或浓硝酸与活泼金属反应均不生成H2
原理:
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
(除Au和Pt外)
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
酸性和氧化性(1:1)
酸性和氧化性(3:1)
与金属反应的产物不同:浓HNO3→NO2,稀HNO3→NO
氧化性
2. 铜投入到稀硫酸中不会溶解,再向溶液中投入KNO3固体,铜会不会溶解?为什么?
思考与讨论
会溶解。由离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O可知,只要溶液中同时有H+和NO,铜就会发生反应而溶解。
1. 若铜与硝酸反应后,硝酸不足而铜剩余,向反应体系中加入稀硫酸,铜是否继续溶解?
会溶解
② 浓硝酸钝化反应
常温下,把铝、铁放在浓硝酸里钝化
实质:生成一层致密的氧化物保护膜,阻止内部金属继续跟硝酸起反应。
浓硫酸或浓硝酸的盛放:铁、铝制的容器
钝化是化学反应
常温下,铝、铁遇浓硫酸也发生钝化
Fe+6HNO3(浓) = Fe(NO3)3+3NO2↑+3H2O
△
若铁粉过量,产物有什么不同?
加热时可以反应
氧化性
③与非金属反应
④硝酸还能氧化Fe2+、 Br-、 I- 、S2-、 SO2等具有还原性的化合物。
硝酸浓度越大,氧化性越强
氧化性:浓HNO3 > 稀HNO3
氧化性
4HNO3(浓) + C === 4NO2↑+ CO2↑+ 2H2O
△
3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O
铂金饰品以其所代表着“永恒”的含义,受到大多数人的喜爱。但铂金真的永恒吗?
1体积浓硝酸与3体积浓盐酸的混合物叫做王水,它的氧化能力更强,金(Au )和 铂(Pt )不溶于硝酸,但溶于王水。
帮
你
记
三言(盐)一笑(硝)
工业制硝酸
N2
H2
O2
O2
H2O
NH3
NO
NO2
HNO3
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
N2→NH3: ________________________。
NH3→NO: _______________________。
NO→NO2: _______________________。
NO2→HNO3: _______________________。
2NO+O2 = 2NO2
3NO2+H2O = 2HNO3+NO
N2+3H2 2NH3
高温高压
催化剂
4NH3+5O2 == 4NO+6H2O
催化剂
写出有关化学方程式:
氮气发生还原反应
氨气发生氧化反应
NO发生氧化反应
NO2既发生氧化反应也发生还原反应
酸雨的类型
汽车的尾气
煤、石油和某些含硫的金属矿物的燃烧或冶炼
硫酸型:SO2
硝酸型:NOx
酸雨:主要指 pH<5.6 的雨水,主要含有硫酸和硝酸
成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
二
酸雨及其防治
酸雨的危害饮用酸化的地下水危害人类腐蚀建筑物和工业设备破坏土壤成分使农作物减产甚至死亡损坏植物叶面导致森林死亡破坏露天文物古迹使湖泊中鱼虾死亡酸雨的防治
污染造成的危害
NOx对环境的污染的危害
1
2
三危害
酸雨
硝酸型酸雨
臭氧层的破坏
2O3 3O2
NOx
3
光化学烟雾
氮氧化物+碳氢化合物→光化学烟雾
污染来源
NOx对环境的污染的防治
汽车尾气
硝酸工厂、氮肥厂、金属的冶炼厂的废气
化石燃料的燃烧
污染防治
开发清洁能源
安装尾气转化装置
工业废气处理
第二节 氮及其化合物
第4课时 硝酸、酸雨及防治
第五章 化工生产中的重要非金属元素
硝酸的物理性质
01
颜色 气味 挥发性 状态 沸点 密度
无色
有刺激性气味
易挥发
液体
83℃
1.5027 g/cm3
① 硝酸能与水任意比互溶
② 常用浓硝酸质量分数为69%。
③ 质量分数为95%以上的硝酸为“发烟硝酸”
开瓶瓶口有白雾
发烟硝酸(w >95%)
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
硝酸的化学性质
02
4HNO3 ======= 2H2O + 4NO2↑+ O2 ↑
光照/加热
硝酸保存:棕色的试剂瓶,放置于阴凉处
思考:常用的浓硝酸为什么会呈黄色?
浓硝酸易分解生成NO2溶于硝酸
工业上盐酸呈黄色又是什么原因?
含有Fe3+杂质
不稳定性
——受热或见光易分解
酸的通性
HNO3 = H+ + NO3-
与指示剂显色
与金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
硝酸
能不能生成H2
如 NaOH
H+ + OH- = H2O
如 CuO
2H+ + CuO = Cu2+ + H2O
如 Na2CO3
2H+ + CO32- = H2O + CO2↑
?
在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
实验5-8 硝酸与铜的反应
硝酸浓度 稀硝酸 浓硝酸
实验现象 反应 、铜丝 ,产生 色气体,溶液呈蓝色 反应 、铜丝 ,产生
色气体,溶液呈绿色
剧烈
变细
红棕
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
变细
无
缓慢
①与金属反应
稀或浓硝酸与活泼金属反应均不生成H2
原理:
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
(除Au和Pt外)
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
酸性和氧化性(1:1)
酸性和氧化性(3:1)
与金属反应的产物不同:浓HNO3→NO2,稀HNO3→NO
氧化性
2. 铜投入到稀硫酸中不会溶解,再向溶液中投入KNO3固体,铜会不会溶解?为什么?
思考与讨论
会溶解。由离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O可知,只要溶液中同时有H+和NO,铜就会发生反应而溶解。
1. 若铜与硝酸反应后,硝酸不足而铜剩余,向反应体系中加入稀硫酸,铜是否继续溶解?
会溶解
② 浓硝酸钝化反应
常温下,把铝、铁放在浓硝酸里钝化
实质:生成一层致密的氧化物保护膜,阻止内部金属继续跟硝酸起反应。
浓硫酸或浓硝酸的盛放:铁、铝制的容器
钝化是化学反应
常温下,铝、铁遇浓硫酸也发生钝化
Fe+6HNO3(浓) = Fe(NO3)3+3NO2↑+3H2O
△
若铁粉过量,产物有什么不同?
加热时可以反应
氧化性
③与非金属反应
④硝酸还能氧化Fe2+、 Br-、 I- 、S2-、 SO2等具有还原性的化合物。
硝酸浓度越大,氧化性越强
氧化性:浓HNO3 > 稀HNO3
氧化性
4HNO3(浓) + C === 4NO2↑+ CO2↑+ 2H2O
△
3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑ + 2H2O
铂金饰品以其所代表着“永恒”的含义,受到大多数人的喜爱。但铂金真的永恒吗?
1体积浓硝酸与3体积浓盐酸的混合物叫做王水,它的氧化能力更强,金(Au )和 铂(Pt )不溶于硝酸,但溶于王水。
帮
你
记
三言(盐)一笑(硝)
工业制硝酸
N2
H2
O2
O2
H2O
NH3
NO
NO2
HNO3
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
N2→NH3: ________________________。
NH3→NO: _______________________。
NO→NO2: _______________________。
NO2→HNO3: _______________________。
2NO+O2 = 2NO2
3NO2+H2O = 2HNO3+NO
N2+3H2 2NH3
高温高压
催化剂
4NH3+5O2 == 4NO+6H2O
催化剂
写出有关化学方程式:
氮气发生还原反应
氨气发生氧化反应
NO发生氧化反应
NO2既发生氧化反应也发生还原反应
酸雨的类型
汽车的尾气
煤、石油和某些含硫的金属矿物的燃烧或冶炼
硫酸型:SO2
硝酸型:NOx
酸雨:主要指 pH<5.6 的雨水,主要含有硫酸和硝酸
成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
二
酸雨及其防治
酸雨的危害饮用酸化的地下水危害人类腐蚀建筑物和工业设备破坏土壤成分使农作物减产甚至死亡损坏植物叶面导致森林死亡破坏露天文物古迹使湖泊中鱼虾死亡酸雨的防治
污染造成的危害
NOx对环境的污染的危害
1
2
三危害
酸雨
硝酸型酸雨
臭氧层的破坏
2O3 3O2
NOx
3
光化学烟雾
氮氧化物+碳氢化合物→光化学烟雾
污染来源
NOx对环境的污染的防治
汽车尾气
硝酸工厂、氮肥厂、金属的冶炼厂的废气
化石燃料的燃烧
污染防治
开发清洁能源
安装尾气转化装置
工业废气处理
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
